
- •11.Патологія клітинного ядра (зміни нуклеолеми, нуклеоплазми, стан хроматину,
- •12.Клітинні та позаклітинні механізми трофіки. Складові частини (первинний та вторинний месенджери) системи регуляції метаболізму.
- •13. Дистрофія: визначення, причини. Морфогенетичні механізми дистрофій.
- •15. Паренхіматозні дистрофії: визначення, класифікація, механізми, морфологічна характеристика, наслідки.
- •16. Спадкові ферментопатії (хвороби накопичення або тезаурисмози) як відображеність спадкових дистрофій, їх значення в патології дитячого віку.
- •17. Паренхіматозні білкові дистрофії (диспротеїнози): визначення, морфогенетичні механізми, локалізація, розповсюдженість процесу, морфологічна характеристика, наслідки
- •18.Паренхіматозні жирові дистрофії (ліпідози): визначення, морфогенетичні механізми, локалізація процесу, морфологічна характеристика, наслідки
- •19.Паренхіматозні вуглеводні дистрофії: визначення, патоморфологічні прояви, локалізація змін, наслідки
- •20. Морфо-функціональна характеристика позаклітинного середовища (матриксу): основна речовина, клітини, волокна.
- •21. Стромально-судинні дистрофії: визначення, механізми, класифікація за видом порушеного обміну речовин.
- •22. Дезорганізація сполучної тканини: визначення, основні механізми (підвищення судинної проникливості, деструкція клітин та позаклітинного матриксу).
- •24. Фібриноїдне набухання: визначення, механізми, патоморфологія, наслідки.
- •25. Гіаліноз: визначення, патоморфологічна характеристика, класифікація, наслідки.
- •26. Амілоїдоз: визначення, морфогенез, гістохімічна, імуногістохімічна та електронномікроскопічна характеристика амілоїду. Види амілоїду.
- •27. Класифікація амілоїдозу. Основні клініко-морфологічні форми амілоїдозу.
- •28. Морфологічні прояви основних видів амілоїдозу.
- •29. Патоморфологія внутрішніх органів при амілоїдозі («сагова» селезінка, «сальна» селезінка, велика «сальна» нирка, амілоїдне зморщення нирок). Значення амілоїдозу для організму.
- •30. Стромально-судинні жирові дистрофії (ліпідози): визначення, механізми та прояви
- •31. Стромально-судинні вуглеводні дистрофії: визначення, механізми, морфологічна характеристика, наслідки
- •32. Змішані дистрофії: визначення, механізми, класифікація.
- •33. Порушення обміну пігментів: класифікація, характеристика пігментів, значення для клініки.
- •34. Види гемоглобіногенних пігментів: феритин, гемосидерин, білірубін, гематини, гематоїдин, порфірини та механізми їх утворення.
- •35. Гемосидероз: визначення, класифікація, патоморфологія. Загальний та місцевий (есенціальний гемосидероз легень, синдром Целен-Геллерстедта) гемосидероз.
- •36. Гемохроматоз: визначення, класифікація, патоморфологія, прояви, наслідки.
- •37. Кругообіг жовчних пігментів в організмі. Прямий та непрямий білірубін – морфофункціональна характеристика.
- •Жовтяниця: визначення, класифікації, загальна характеристика, значення для клініки.
- •Гемолітична жовтяниця: визначення, механізми, морфологія. Жовтяниця новонароджених (icterus neonatorum).
- •Паренхіматозна жовтяниця: визначення, етіологія, механізми розвитку, морфологія.
- •Обтураційна (механічна) жовтяниця: визначення, етіологія, механізми розвитку, морфологія.
- •Холестаз та його морфологічні прояви.
- •Порушення обміну ліпідогенних пігментів: ліпофусциноз (первинний та вторинний), бура атрофія міокарда, печінки.
- •Порушення обміну нуклеопротеїдів: подагра, сечокам'яна хвороба, сечокислий інфаркт.
- •Порушення обміну мінералів. Мінеральні дистрофії, їхні види. Порушення обміну кальцію – кальцинози (вапняна дистрофія, звапнення).
- •47. Види кальцинозів: метастатичний, дистрофічний, метаболічний. Причини, патогенез, морфологічна характеристика.
- •48. Порушення обміну міді. Гепатоцеребральна дистрофія (хвороба Вільсона-Коновалова).
- •49. Порушення обміну калію і натрію: періодичний параліч, утворення каменів. Причини та механізм утворення каменів. Різновиди каменів. Наслідки каменеутворення.
- •50. Некроз: визначення та механізми розвитку (денатурація білків та лізис). Уявлення про паранекроз, некробіоз, парабіоз, аутоліз. Особливості некрозу у дитячому віці.
- •51. Патогенез некротичного процесу. Характеристика стадій некрозу.
- •53. Класифікація некрозу залежно від причини, що його викликала (травматичний, токсичний, трофоневротичний, алергічний, судинний) та механізму впливу патогенного фактора (прямий та непрямий некроз).
- •55. Інфаркт: причини, патогенез, наслідки. Морфологія інфаркту. Види інфаркту: білий, білий з геморагічним вінчиком (змішаний) та червоний.
- •56. Морфологічна характеристика інфарктів міокарда, головного мозку, легень, нирок, селезінки, кишківника.
- •57. Апоптоз: визначення, механізми, морфологія, значення для організму.
- •58. Порівняльна характеристика некрозу та апоптозу. Ультраструктурні ознаки некрозу та апоптозу. Роль апоптозу при різноманітних захворюваннях.
- •60. Постішемічно-реперфузійні пошкодження органів. Визначення, особливості морфогенезу, морфологічна характеристика, наслідки.
- •61. Смерть організму: визначення, ознаки, класифікація і терміни розвитку. Поняття про природну, насильницьку смерть і смерть від хвороб (передчасну і раптову).
- •62. Смерть клінічна та біологічна. Ознаки смерті і посмертні зміни. Визначення внутрішньоутробної смерті.
- •63. Постреанімаційний період: визначення, морфологічні особливості пошкодження життєво-важливих органів і відновлення їх функцій.
- •66. Порушення кровообігу: визначення, класифікація, механізми розвитку. Особливості порушення кровообігу у дітей.
- •67. Артеріальне повнокрів’я (гіперемія): визначення, види, значення.
- •68. Венозне повнокрів’я (гіперемія): визначення, класифікація (гостре, хронічне, місцеве, загальне), значення.
- •71. Серцево-судинна недостатність: визначення, види, механізми розвитку.
- •72. Гостра і хронічна лівошлуночкова серцево-судинна недостатність: основні причини, патогенез, зміни у внутрішніх органах (набряк легень, бура індурація легень).
- •73. Гостра і хронічна правошлуночкова серцево-судинна недостатність: основні причини, патогенез, зміни у внутрішніх органах ("мускатна" печінка, ціанотична індурація нирок і селезінки).
- •75. Набряк: визначення, термінологія, причини, класифікація, механізми розвитку, морфологічна характеристика, наслідки. Водянка порожнин.
- •76. Морфологічні прояви набряку легень та набряку головного мозку.
- •77. Морфологія стадій набряку легень при гострій серцевій недостатності.
- •78. Недостатність лімфообігу: причини, класифікація, морфологічні прояви.
- •79. Лімфедема: визначення, класифікація (гостра та хронічна, загальна та реґіонарна), морфологічна характеристика. Лімфостаз, слоновість.
- •80. Лімфорея: визначення, класифікація (зовнішня та внутрішня: хільозний асцит, хілоторакс), морфологічна характеристика. Значення порушення лімфообігу.
- •81. Кровотеча (геморагія) і крововилив: визначення, класифікації, значення. Термінологія, яка вживається для опису різних видів кровотеч та крововиливів.
- •82. Плазморагія: визначення, причини, механізм розвитку, морфологічна характеристика.
- •83. Стаз: визначення, причини, механізм розвитку, види, морфологічна характеристика, наслідки. Передстаз, сладж-феномен.
- •84. Тромбоз: визначення, механізми та патогенез. Тріада Вірхова (пошкодження ендотелію, гемодинамічні розлади, гіперкоагуляція).
- •87. Стадії розвитку двз-синдрому та відповідні морфологічні прояви (гіперкоагуляція, коагулопатія споживання, активація фібринолізу, відновлення).
- •88. Міопатії. Класифікація, клініко-морфологічна характеристика. Вроджені і токсичні міопатії.
- •90. Емболія: визначення, класифікація, морфологія. Основні види емболій: тромбоемболія, жирова, газова, тканинна, бактерійна.
- •91.Основні шляхи емболій та їх наслідки (системна, тромбоемболія легеневої артерії, по портальній системі). Ортоградна, ретроградна та парадоксальна емболії.
- •92. Тромбоемболічний синдром: визначення, характеристика.
- •93.Тромбоемболія легеневої артерії: визначення, етіологія, патогенез. Види та наслідки (раптова смерть, геморагії, інфаркт легень, легенева гіпертензія).
- •94. Патогенез та стадії розвитку інфаркту: ішемія, некроз, організація. Морфологічні прояви інфаркту в органах (серце, головний мозок, нирки, селезінка, легені, кишка).
- •95. Клініко-патологоанатомічні особливості і наслідки постішемічно-реперфузійних пошкоджень органів.
- •96.Захисні реакції організму людини, їх взаємодія та особливості (бар’єри, лейкоцитарна реакція, імунні реакції).
- •97. Медіатори та їх роль у захисних реакціях організму. Загальна характеристика, класифікація та особливості впливу медіаторів.
- •98. Поняття про імунокомпетентні клітини. Гуморальні і клітинні імунні реакції: загальна характеристика, механізми імунних реакцій.
- •100. Класифікації запалення та принципи, що лежать в їх основі (переважання певної фази, особливості перебігу,етіологія).
- •Гостре запалення: визначення, загальна характеристика. Клініко-морфологічні прояви гострого запалення.
- •Ексудативне запалення: визначення, класифікація, загальна характеристика. Самостійні і несамостійні форми ексудативного запалення.
- •Ексудат: визначення, його складові частини та основні види (серозний, фібринозний, гнійний, катаральний). Порівняльна характеристика ексудату та трансудату.
- •Механізми утворення ексудату та їх регуляція; нейтрофільний лейкоцит та його роль в ексудативному запаленні.
- •Гнійне запалення: визначення, етіологія, патогенез, морфологічні прояви. Склад гнійного ексудату. Наслідки і значення гнійного запалення.
- •109. Катаральне запалення: визначення, етіологія, класифікація (гостре і хронічне), морфологічна характеристика, наслідки.
- •110. Геморагічне, гнильне запалення: визначення, особливості ексудату.
- •111. Наслідки ексудативного запалення та роль у патогенезі захворювань.
- •112. Проліферативне та хронічне запалення: визначення, загальна характеристика. Тріада ознак, що характеризує хронічне запалення. Причини хронізації запалення.
- •113. Етіопатогенетичні фактори, що ведуть до розвитку проліферативного запалення.
- •114. Прояви хронічного запалення. Мононуклеарний інфільтрат (склад, механізми утворення). Макрофаг, як представник системи мононуклеарних фагоцитів, його трансформація та роль у хронічному запаленні.
- •115. Класифікація проліферативного запалення.
- •116. Інтерстиційне запалення: визначення, причини, морфологічні прояви, наслідки.
- •117. Гранулематозне запалення: визначення, причини, загальна характеристика. Гранулематозні захворювання.
- •120.Морфологія запалення при туберкульозі. Клініко- морлогічні особливості туберкульозного запалення
- •121. Продуктивне запалення з утворенням поліпів та гастрокінцевих кондилом: визначення, причини, морфологічна характеристика
- •131. Регенерація: визначення, біологічне значення. Види регенерації: фізіологічна, репаративна, патологічна, їх морфологічна характеристика. Повна (реституція) та неповна (субституція) регенерація.
- •132. Клітинна та внутрішньоклітинна форми регенерації. Загальні та місцеві умови, які визначають характер перебігу регенераторного процесу.
- •134. Особливості регенерації окремих видів тканин та органів: регенерація крові, судин, сполучної, жирової, хрящової, кісткової, м'язової тканини та епітелію.
- •135. Регенерація печінки, підшлункової залози, нирок, залоз внутрішньої секреції, легень, міокарда, головного та спинного мозку, периферичних нервів.
- •Патоморфологічна характеристика репаративної та патологічної регенерації.
- •Процеси компенсації і адаптації: основні поняття, стадії розвитку, значення.
- •Гіперплазія: визначення, механізми, типові приклади, морфологічні прояви.
- •Гіпертрофія: визначення, механізми (регуляція, зміни фенотипу), типові приклади, морфологічні прояви.
- •Атрофія: визначення, основні види, механізми (убіквітин-протеасомний комплекс), морфологічні прояви.
- •Метаплазія: визначення, механізми, типові приклади, морфологічні прояви. Поняття про дисплазію.
- •Загоєння ран: загальні механізми, особливості загоєння первинним та вторинним натягом, морфологічні прояви.
- •154. Особливості пухлинної клітини. Морфологічний, біохімічний, антигенний і функціональний атипізм пухлин. Характеристика пухлинного процесу. Диференціювання. Анаплазія.
- •155. Біологія пухлинного росту. Морфогенез, гістогенез (цитогенез) і диференціювання пухлин. Види росту пухлин.
- •156. Прогресія і гетерогенність пухлин. Особливості клітинної популяції в пухлинному фокусі.
- •157. Основні властивості пухлини. Особливості будови, паренхіма і строма пухлини.
- •158. Протипухлинний імунітет. Антигени пухлин. Імунний нагляд. Протипухлинні ефекторні механізми (клітинні і гуморальні).
- •159. Найважливіші клініко-патологічні прояви пухлинного росту. Поняття про рецидив пухлини.
- •160. Місцевий вплив пухлини.
- •161. Метастазування: види, закономірності, механізми. Метастатичний каскад.
- •162. Системні неметастатичні впливи пухлин. Порушення гомеостазу організму. Вторинні зміни в пухлині. Ракова кахексія. Паранеопластичні синдроми.
- •163. Номенклатура і принципи класифікації пухлин. Діагностика пухлин.
- •164. Морфологічні особливості доброякісних і злоякісних пухлин.
- •165. Епітеліальні пухлини: визначення, класифікація.
- •166. Морфологічні особливості carcinoma in situ.
- •167. Рак: визначення, класифікація, морфологічні особливості основних форм.
- •168. Доброякісні і злоякісні пухлини з багатошарового плоского і перехідного епітелію, їх форми та морфологічна характеристика.
- •169. Доброякісні і злоякісні пухлини із залозистого епітелію, їх форми та морфологічна характеристика.
- •170. Морфологічні особливості основних форм аденогенного і недиференційованого раку.
- •171. Морфологічні особливості пухлин печінки.
- •172. Морфологічні особливості пухлин нирок.
- •173. Морфологічні особливості пухлин шкіри
- •174. Морфологічні особливості пухлин та пухлиноподібних уражень грудної залози.
- •175. Морфологічні особливості епітеліальних органоспецифічних пухлин та пухлиноподібних уражень матки. Трофобластична хвороба.
- •176. Морфологічні особливості пухлин ендокринних органів: гіпофіза, епіфіза, щитоподібної залози, паращитоподібних залоз, надниркових залоз, підшлункової залози, тимуса.
- •177. Морфологічні особливості пухлин нейроендокринної системи. Синдром множинної ендокринної неоплазії.
- •178. Морфологічні особливості пухлин статевих залоз: яєчників, яєчок.
- •179. Мезенхімальні пухлини: визначення, гістогенез.
- •180. Пухлини м’яких тканин: класифікація.
- •181.Класифікація мезенхімальних пухлин.
- •183. Доброякісні і злоякісні пухлини з сполучної тканини. Назви, морфологічні особливості, найчастіша локалізація.
- •184.Доброякісні і злоякісні пухлини з жирової тканини. Назви, морфологічні особливості, найчастіша локалізація.
- •185. Доброякісні і злоякісні пухлини з м'язевої тканини. Назви, морфологічні особливості, найчастіша локалізація.
- •186. Доброякісні і злоякісні пухлини з кровоносних і лімфатичних судин. Назви, морфологічні особливості, найчастіша локалізація.
- •187. Доброякісні і злоякісні пухлини з синовіальних оболонок і мезотеліальної тканини. Назви, морфологічні особливості, найчастіша локалізація.
- •188. Доброякісні і злоякісні пухлини з кісткової тканини. Назви, морфологічні особливості, найчастіша локалізація.
- •189. Пухлини із меланінутворюючої тканини. Невус. Визначення. Класифікація.
- •190.Диспластичний (атиповий) невус, морфологічна характеристика, значення.
- •191.Меланома. Визначення. Фактори ризику і причини розвитку. Клініко- морфологічні типи, мікроскопічні різновиди, метастазування, прогностичні фактори меланоми.
- •192.Пухлини центральної нервової системи: нейроектодермальні і менінгосудинні. Морфологічні особливості та особливості метастазування.
- •1.Пухлини нейроепітеліальної тканини:
- •2. Пухлини оболонок мозку:
- •194.Пухлини вегетативної нервової системи. Класифікація, морфологічні особливості.
- •195.Особливості пухлин дитячого віку. Класифікація пухлин дитячого віку.
- •196. Гамартома та гамартобластома: визначення, морфологічна характеристика.
- •197. Тератома і тератобластома: визначення, морфологічна характеристика.
- •198.Пухлини з камбіальних ембріональних тканин. Морфологічна характеристика медулобластоми, ретинобластоми, нейробластоми.
- •199. Пухлини у дітей, що розвиваються за типом пухлин у дорослих: астроцитома, гемобластози, юнацька ангіофіброма носоглотки, остеома та хондрома, остеобластокластома, остеосаркома, саркома Юінга.
- •200. Особливості метастазування та прогноз пухлин дитячого віку.
- •202. Класифікації хвороб. Поняття про Міжнародну класифікацію хвороб.
- •203. Діагноз: визначення і загальна характеристика. Діагноз у педіатрії.
- •204. Види діагнозів.
- •205. Принципи побудови діагнозу.
- •206. Структура діагнозу
- •207. Основне захворювання: визначення, загальна характеристика. Комбіноване основне захворювання. Фонові захворювання.
- •208. Ускладнення основного захворювання: визначення, загальна характеристика.
- •209. Супутні захворювання: визначення, загальна характеристика.
- •210. Поняття про патрморфоз хвороб. Види патоморфозу.
- •212. Етіологія, патогенез, патоморфологія постгеморагічних анемій.
- •213. Етіологія, патогенез, класифікація, патоморфологія анемій внаслідок порушення кровотворення.
- •214. Етіологія, патогенез, класифікація, патоморфологія гемолітичних анемій.
- •215. Геморагічні синдроми: вазопатії, васкулопатії, тромбоцитопенії, тромбоцитопатії, коагулопатії. Особливості геморагічних синдромів в дитячому віці.
- •216. Тромбоцитопатії: визначення, класифікації, характеристика.
- •Тромбоцитопенії: визначення, класифікації, характеристика.
- •Коагулопатії: визначення, класифікації, характеристика.
- •Поширені форми спадкових анемій (сфероцитоз, серповидноклітинна анемія, таласемія) та геморагічних діатезів (гемофілія, хвороба Віллебранда).
- •Пухлини системи крові (гемобластози). Визначення. Класифікація. Особливості гемобластозів у дітей.
- •Лейкози. Загальна характеристика. Етіологія, патогенез, класифікації лейкозів.
- •Гострі лейкози. Загальна характеристика. Франко-Американо-Британська класифікація гострих лейкозів (fab).
- •Морфологічні прояви гострих лейкозів, ускладнення і причини смерті. Особливості гострих лейкозів у дітей.
- •Хронічні лейкози. Класифікація. Загальна характеристика. Хронічні мієлолейкоз і лімфолейкоз. Морфологічні прояви, ускладнення і причини смерті.
- •Парапротеїнемічні лейкози. Загальна характеристика. Мієломна хвороба. Визначення, клініко-морфологічні прояви, ускладнення і причини смерті.
- •226.Лімфоми. Етіологія, патогенез, класифікація. Особливості лімфом у дитячому віці.
- •227. Лімфома Ходжкіна. Морфологічні варіанти класичної лімфоми Ходжкіна.
- •228.Неходжкінські лімфоми. Класифікація, морфологічні прояви, прогноз
- •229. Основні принципи морфологічної діагностики пухлин системи крові.
- •230.Захворювання серцево-судинної системи у дитячому віці: клініко-морфологічна характеристика.
- •231. Атеросклероз. Визначення. Фактори ризику розвитку атеросклерозу. Теорії патогенезу атеросклерозу. Стадії атеросклерозу, їх морфологічна характеристика.
- •232. Атеросклеротична бляшка. Визначення. Морфогенез і будова атеросклеротичної бляшки. Стадії і ускладнення атеросклерозу.
- •233.Клініко-морфологічні форми атеросклерозу, їх морфологічна характеристика, причини смерті.
- •235. Патоморфологічні зміни в судинах, серці та внутрішніх органах при гіпертонічній хворобі.
- •236. Клініко-морфологічні форми гіпертонічної хвороби, їх морфологічна характеристика, ускладнення, причини смерті.
- •237. Аневризма аорти
- •238. Ішемічні хвороби серця (іхс). Визначення. Фактори ризику і патогенез іхс. Безпосередні причини ішемічних пошкоджень міокарда при іхс. Класифікація та патологічна анатомія іхс.
- •239. Інфаркт міокарда. Визначення. Класифікація інфаркту міокарда.
- •240. Стадії інфаркту міокарда: морфологічна характеристика. Наслідки, ускладнення і причини смерті при інфаркті міокарда.
- •241. Клінічна та морфологічна діагностика інфаркту міокарда. Послідовність морфологічних змін в зоні інфаркту міокарда.
- •242. Патоморфологія гострого, рецидивуючого та повторного інфаркту міокарда.
- •243. Морфологічна характеристика екстракардіальних змін при інфаркті міокарда.
- •244. Класифікація і морфологічна характеристика хронічних форм ішемічної хвороби серця (хіхс). Типи кардіосклерозу при хіхс та їх механізми.
- •244. Класифікація і морфологічна характеристика хронічних форм ішемічної хвороби серця (хіхс). Типи кардіосклерозу при хіхс та їх механізми.
- •245. Кардіоміопатії. Визначення, класифікація, патоморфологія. Особливості кардіоміопатій у дитячому віці.
- •246. Цереброваскулярні хвороби (цвх). Визначення, причини, морфогенез. Класифікація, морфологічна характеристика. Наслідки, ускладнення і причини смерті.
- •247. Цереброваскулярні хвороби: інфаркт головного мозку. Визначення, причини, морфологічна характеристика інфаркту головного мозку. Наслідки, ускладнення і причини смерті.
- •248. Цереброваскулярні хвороби: спонтанний внутрішньомозковий і субарахноїдальний крововиливи. Визначення, причини, морфологічна характеристика. Наслідки, ускладнення і причини смерті.
- •249. Ревматичні хвороби. Визначення, класифікація, загальна клініко-морфологічна характеристика. Особливості ревматичних хвороб у дітей.
- •250. Ревматизм. Визначення, етіологія, патогенез, морфогенез. Класифікація. Патоморфологія імунних порушень і процесів системної дезорганізації сполучної тканини.
- •251. Клініко-морфологічні форми ревматизму. Патологічна анатомія, ускладнення і причини смерті.
- •252. Ревматичні ендокардити. Визначення, класифікація, морфологічна характеристика клапанних ендокардитів, ускладнення, наслідки.
- •Неревматичні ендокардити, еозинофільний ендокардит Лєфлєра, морфологічна характеристика.
- •254.Ревматичний міокардит. Визначення, види, морфологічна характеристика, наслідки. Особливості ревматичного міокардиту у дітей.
- •255.Міокардити. Визначення, класифікація, морфогенез, патоморфологія. Неревматичні міокардити, ідіопатичний міокардит Абрамова-Фідлера. Кардіосклероз: види, механізми розвитку.
- •256.Набуті вади серця. Причини, механізми розвитку, патоморфологія. Комбіновані і поєднані вади серця. Морфологічна характеристика компенсованих і декомпенсованих вад серця
- •257.Стеноз лівого атріовентрикулярного отвору і недостатність мітрального клапана. Причини розвитку, морфологічні зміни (кардіальні і ектракардіальні), ускладнення та причини смерті.
- •258.Стеноз гирла аорти і недостатність аортального клапану. Причини розвитку, морфологічні зміни (кардіальні і ектракардіальні), ускладнення та причинисмерті.
- •259.Ревматоїдний артрит – етіологія, патогенез, патоморфологія змін в суглобах, ускладнення.
- •261.Хвороба Бехтєрєва – етіологія, патогенез, патоморфологічна характеристика, ускладнення.
- •262. Системний червоний вовчак. Визначення, етіологія, патогенез, особливості дезорганізації сполучної тканини, патоморфологія. Діагностичні імунологічні тести при системному червоному вовчаку.
- •263. Системний червоний вовчак. Морфологічні зміни (ураження шкіри, судин, нирок, серця і органів імунної системи). Ускладнення та причини смерті.
- •264. Системна склеродермія. Визначення, етіологія, патогенез, особливості дезорганізації сполучної тканини, патологічна анатомія, ускладнення.
- •265. Вузликовий периартеріїт. Визначення, етіологія, патогенез, особливості дезорганізації сполучної тканини, патологічна анатомія, ускладнення.
- •266. Дерматоміозит. Визначення, етіологія, патогенез, особливості дезорганізації сполучної тканини, патологічна анатомія, ускладнення.
- •268. Анца-асоційовані васкуліти: мікроскопічний поліангіїт, гранулематоз з поліангіїтом (Вегенера), еозинофільний гранулематоз з поліангіїтом (синдром Черджа-Строса).
- •269. Гострі запальні захворювання верхніх дихальних шляхів (риніт, синусит, ларингіт, епіглотит, ларинготрахеобронхіт): патологічна анатомія.
- •270. Гострий бронхіт: патологічна анатомія. Гострий бронхіоліт (первинний, фолікулярний, облітеруючий): патологічна анатомія. Ускладнення.
- •271. Пневмонія.Визначення, класифікація. Особливості первинних і вторинних пневмоній. Особливості пневмоній у дитячому віці.
- •272. Крупозна (лобарна) пневмонія. Визначення, синоніми. Етіологія, патогенез, морфогенез і патологічна анатомія стадій, ускладнення, причини смерті.
- •273. Бронхопневмонія. Визначення, синоніми. Етіологія, патогенез, патологічна анатомія, ускладнення, причини смерті.
- •274. Морфологічні особливості пневмоній, що викликаються пневмококом, стафілококом, стрептококом, синьогнійною паличкою, грибами.
- •276. Респіраторний дистрес-синдром дорослих (дифузне альвеолярне пошкодження). Визначення, етіологія, патогенез, морфогенез і патологічна анатомія, причини смерті.
- •277. Вірусні пневмонії. Етіологія, патогенез, патологічна анатомія, ускладнення, причини смерті.
- •278. Хронічні обструктивні захворювання легень (хозл). Визначення, класифікація, клініко-морфологічна характеристика легеневих і позалегеневих уражень, ускладнення, причини смерті.
- •279. Хронічний бронхіт. Визначення, етіологія, патогенез, класифікація, морфогенез і патологічна анатомія. Ускладнення.
- •280 Бронхоектази – визначення, етіологія, патогенез, патоморфологічна характеристика, ускладнення.
- •281.Емфізема легень – визначення, етіологія, патогенез, патоморфологічна характеристика, ускладнення.
- •282 Бронхіальна астма – визначення, етіологія, патогенез, патоморфологічна характеристика, ускладнення.
- •283 Хронічні інтерстиційні хвороби легень – визначення, класифікація, етіологія, патогенез, патоморфологічна характеристика, ускладнення.
- •284. Ідіопатичний легеневий фіброз. Визначення, класифікація, патогенез, патологічна анатомія, наслідки.
- •285. Легене́ва гіперте́нзія— будь-яке підвищення кров'яного тиску в легеневій артерії, вище звичайного (25 мм.Рт.Ст)
- •287. Хвороби нервової системи у дитячому віці: морфологічна характеристика.
- •288. Хвороба Альцгеймера. Визначення, етіологія, патогенез, морфологічна характеристика, ускладнення
- •289. Розсіяний склероз. Визначення, етіологія, патогенез, морфологічна характеристика, ускладнення
- •290. Боковий аміотрофічний склероз. Визначення, етіологія, патогенез, морфологічна характеристика, ускладнення.
- •292. Захворювання периферичних нервів і парагангліїв. Ушкодження периферичних нервів. Дегенеративні зміни в периферичних нервах. Периферичні невропатії. Діабетична, уремічна і інша форми невропатій.
- •293. Хвороба Педжета. Визначення, етіологія, патогенез, морфологічна характеристика, ускладнення.
- •294. Фіброзна дисплазія. Визначення, етіологія, патогенез, морфологічна характеристика, ускладнення.
- •295. Остеомієліт. Визначення, етіологія, патогенез, морфологічна характеристика, ускладнення.
- •296. М'язова дистрофія Дюшена. Визначення, етіологія, патогенез, морфологічна характеристика, ускладнення.
- •297. Міотонія. Визначення, патогенез, клініко-морфологічна характеристика.
- •298. Міопатії. Класифікація, клініко-морфологічна характеристика. Вроджені і токсичні міопатії.
- •299. Міастенія (myastenia gravis). Визначення, етіологія, патогенез, морфологічна характеристика, ускладнення.
- •300. Ангіни: визначення, етіологія, патогенез. Класифікація, патологічна анатомія і диференціальна діагностика різних форм. Ускладнення ангін.
- •302. Рак стравоходу. Фактори ризику, фонові захворювання і передракові зміни, макроскопічні і гістологічні форми, метастазування, ускладнення і причини смерті.
- •303. Гастрит. Визначення. Класифікація. Етіологія, патогенез і патоморфологія хронічного гастриту. Характеристика процесів атрофії, метаплазії, дисплазії.
- •304. Виразкова хвороба шлунка та дванадцятипалої кишки. Визначення, морфогенез.
- •307. Апендицит. Визначення. Класифікація. Патологічна анатомія форм гострого апендициту. Ускладнення гострого апендициту.
- •308. Патоморфологія хронічного апендициту. Ускладнення хронічного апендициту.
- •309. Ентерит. Коліт. Визначення. Класифікація. Морфологічні критерії хронічного коліту.
- •310. Коліт, пов'язаний з терапією антибіотиками (псевдомембранозний, медикаментозний коліт). Етіологія, патогенез, клініко-морфологічна характеристика, прогноз.
- •312. Синдром мальабсорбції: целіакія, спру, хвороба Уіппла, дефіцит лактази, абеталіпопротеїнемія – морфологічна характеристика.
- •313. Неспецифічний виразковий коліт. Етіологія, патогенез, патологічна анатомія, ускладнення.
- •314. Хвороба Крона. Етіологія, патогенез, патологічна анатомія, ускладнення.
- •315. Дивертикули. Визначення. Класифікація. Патологічна анатомія, ускладнення.
- •316.Перитоніт . Визначення. Етіологія . Патогенез, класифікація , клініко-морфологічна характеристика, наслідки .
- •317. Рак кишківника
- •318. Хвороби печінки, жовчного міхура та підшлункової залози.
- •319. Стеатоз печінки. (жировий гепатоз)
- •320. Масивний некроз печінки (токсична дистрофія печінки).
- •321. Гепатит .
- •322. Гострі вірусні гепатити.
- •323. Хронічні вірусні гепатитии
- •324. Алкогольний гепатит.
- •Метаболічні захворювання печінки (неалкогольна жирова хвороба печінки, гемохроматоз, хвороба Вільсона, дефіцит а1-антитрипсину). Медикаментозні гепатити.
- •Цироз печінки. Визначення, етіологія, класифікація, патологічна анатомія. Позапечінкові зміни при цирозі печінки. Ускладнення цирозу печінки. Причини смерті.
- •Біліарний цироз печінки . Первинний міліарний цироз
- •Гепатоцелюлярна недостатність
- •VI. Ускладнення
- •Рак печінки. Фактори ризику, гістогенез, класифікація, морфологічна характеристика, метастазування, ускладнення і причини смерті.
- •330Холецистит. Визначення, етіологія, патогенез, морфологічні ознаки клініко- морфологічних форм гострого холециститу, хронічного холециститу.
- •Жовчнокам'яна хвороба. Характеристика жовчних каменів і умови їх утворення. Ускладнення холециститу і жовчнокам'яної хвороби.
- •332Панкреатит. Визначення, етіологія, патогенез, класифікація, морфологічна характеристика і ускладнення гострого та хронічного панкреатиту.
- •333Рак підшлункової залози. Фактори ризику, гістогенез, класифікація, морфологічна характеристика, метастазування, ускладнення і причини смерті.
- •334.Захворювання нирок. Загальна клініко-морфологічна характеристика і класифікація. Особливості захворювань нирок у дитячому віці.
- •Гломерулопатії. Визначення, класифікація. Гломерулонефрит: визначення, класифікація, морфологічна характеристика, наслідки.
- •336. Гострий гломерулонефрит. Визначення, етіологія, патогенез,патологічна анатомія, ускладнення, прогноз.
- •Підгострий швидкопрогресуючий гломерулонефрит. Визначення, етіологія, патогенез, патологічна анатомія, ускладнення, прогноз.
- •338.Хронічні гломерулонефрити. Визначення, етіологія, патогенез, класифікація, патологічна анатомія, ускладнення, прогноз.
- •339.Незапальні гломерулопатії. Визначення. Класифікація. Ліпоїдний нефроз. Патологічна анатомія, ускладнення, прогноз. Нефротичний синдром.
- •340 Незапальні гломерулопатії. Визначення. Класифікація. Мембранозна нефропатія. Патологічна анатомія, ускладнення, прогноз. Нефротичний синдром.
- •Тубулопатії. Визначення, причини, класифікація, морфологічна характеристика.
- •344. Сечокам’яна хвороба (нефролітіаз). Визначення, етіологія, патогенез, характеристика сечових конкрементів і патологічна анатомія нефролітіазу, ускладнення і причини смерті.
- •345. Гідронефроз. Визначення. Морфогенез, морфологічна характеристика, наслідки
- •346. Кістозні хвороби нирок: класифікація, морфологічна характеристика.
- •347. Амілоїдознирок.Визначення,причини,морфологічнахарактеристика, наслідки.
- •348. Нефросклероз.Визначення. Причинипервинногоі вторинного зморщення нирок. Морфогенез нефросклерозу. Патологічна анатомія уремії.
- •349. Хронічна ниркова недостатність. Визначення. Причини. Патологічна анатомія ниркових і позаниркових змін.
- •350. Ракнирки.Факториризику,гістогенез,морфологічнахарактеристика, метастазування, ускладнення і причини смерті
- •351. Акромегалія. Визначення, причини розвитку, клініко-морфологічні прояви.
- •352. Хвороба Іценко-Кушинга. Визначення, причини розвитку, клініко-морфологічні прояви.
- •353. Нецукровий діабет. Визначення, причини розвитку, класифікація, клініко- морфологічні прояви.
- •354. Хвороба Аддісона. Визначення, етіологія, патогенез, морфологічні прояви, причини смерті.
- •355. Синдром Уотерхауза-Фридеріксена. Визначення, етіологія, клініко- морфологічні прояви.
- •356. Тироїдит. Визначення. Етіологія, патогенез, морфологічна характеристика гострого, підгострого і хронічного тироїдитів.
- •357. Тиреоїдит Хашимото. Визначення, етіологія, патоморфологія, наслідки.
- •358. Зоб (струма, воло). Визначення. Класифікація. Причини, механізми розвитку, морфологічні прояви.
- •359. Хвороба Грейвса (дифузний токсичний зоб, Базедова хвороба). Визначення. Етіологія і патогенез. Морфологічна характеристика, вісцеральні прояви, наслідки.
- •360. Гіпотиреоїдизм. Кретинізм. Мікседема. Визначення, етіологія, морфологічна характеристика.
- •361. Рак щитоподібної залози. Класифікація, патоморфологічна характеристика.
- •362. Гіперпаратиреоз. Визначення, причини, механізм розвитку, патологічна анатомія. Паратиреоїдна остеодистрофія.
- •363. Гіпопаратиреоз. Визначення, причини, механізм розвитку, морфологічна характеристика.
- •364. Цукровий діабет. Визначення. Класифікація, етіологія і патогенез цукрового діабету. Патологічна анатомія, ускладнення цукрового діабету, причини смерті.
- •365. Цукровий діабет і типу. Етіологія, патогенез, патологічна анатомія, ускладнення, причини смерті.
- •366. Цукровий діабет іі типу. Етіологія, патогенез, патологічна анатомія, ускладнення, причини смерті.
- •367. Цукровий діабет. Морфологічна характеристика діабетичних макро- та мікроангіопатій. Діабетична нефропатія. Наслідки, причини смерті.
- •368. Запальні, дисгормональні і передракові захворювання шийки матки. Морфологічна характеристика, наслідки.
- •369. Рак шийки матки. Фактори ризику, фонові захворювання і передракові зміни, гістологічні форми, метастазування, ускладнення і причини смерті.
- •372. Ендометріоз. Визначення, причини, морфологічна характеристика.
- •373. Рак тіла матки (ендометрію). Фактори ризику, фонові захворювання і передракові зміни, гістологічні форми, метастазування, ускладнення і причини смерті.
- •374. Пухлини міометрію. Класифікація, морфологічна характеристика.?
- •375. Пухлини яєчників. Класифікація, морфологічна характеристика. Особливості раку яєчників.
- •376. Мастит. Визначення, класифікація, морфологічна характеристика, ускладнення, наслідки.
- •378. Доброякісні пухлини грудної залози. Класифікація, морфологічна характеристика фіброаденоми грудної залози.
- •380. Нодулярна гіперплазія передміхурової залози. Визначення, причини, класифікація, морфологічна характеристика, ускладнення, наслідки.
- •381. Рак передміхурової залози. Фактори ризику, фонові захворювання і передракові зміни, гістологічні форми, метастазування, ускладнення і причини смерті.
- •382. Запальні захворювання яєчок. Класифікація, морфологічна характеристика.
- •383. Пухлини яєчок. Класифікація, морфологічна характеристика. Клініко- морфологічні особливості семіном.
- •385 Ектопічна вагітність: класифікація, причини, морфологічна характеристика, ускладнення і наслідки.
- •386. Гестози: класифікація, етіопатогенез, клініко-морфологічна характеристика змін в організмі матері та в організмі плода.
- •387. Емболія навколоплідними водами. Етіологія, патогенез, морфологічна характеристика, наслідки.
- •389. Хоріокарцинома. Етіологія. Морф.Х-тика,особливості будови пухлини; метастазування, прогноз.
- •391. Інфекції, що передаються статевим шляхом (сифіліс, гонорея, папілома-вірусна інфекція, хламідіоз, уреаплазмоз, трихомоніаз): морфологічна характеристика.
- •392. Генетичні захворювання: менделевські хвороби, цитогенетичні, ураження з мультифакторіальним та некласичними успадкуваннями.
- •393. Гаметопатії, бластопатії, ембріопатії: етіологія, патогенез, морф характеристика.
- •394. Фетопатії. Патоморф. Х-тика, наслідки інфек. Та неінфек. Діабетичної і алкогольної фетопатії.
- •395. Вроджені вади розвитку: причини.
- •396. Недоношеність і переношеність. Затримка внут.Утробного розвитку. Клініко-морф х-стика. Прогноз.
- •Пологова травма: класифікація, морфологічна характеристика.
- •Геморагічна хвороба новонародженого
- •Гемолітична хвороба новонародженого. Етіолгія, патогенез, патологічна анатомія.
- •Асфіксія. Морфологічна характеристика.
- •Внутрішньоутробні інфекції : морфологічні прояви. Інфекційні захворювання torch-комплексу. Некротичний ентероколіт.
- •Молекулярна діагностика менделівських та комплексних розладів.
- •Захворювання шкіри.
- •Хвороби порушеного і недостатнього харчування: причини, морфологічна характеристика.
- •407.Алкоголізм. Визначення, класифікація, патогенез, клініко-морфологічна характеристика, ускладнення, причини смерті.
- •408. Наркоманія і токсикоманія. Визначення, класифікація, патогенез, клініко-морфологічна характеристика, ускладнення, причини смерті.
- •409. Пневмоконіози
- •410. Ушкодження, що пов’язані зі змінами атмосферного тиску.Висотна хвороба.Повітряна емболія. Декомпенсаційна ( кесонна) хвороба.
- •411. Ушкодження від температурних впливів. Опіки. Тепловий удар.
- •412 Променева хвороба.
- •413. Ятрогенна лікарська патологія.
- •414. Інфекційний процес, інфекція і інфекційна хвороба.
- •416. Особливості інфекційних захворювань у дитячому віці.
- •417. Сепсис. Визначення. Особливості сепсису, що відрізняють його від інших інфекційних захворювань. Етіологія, патогенез, місцеві і загальні зміни при сепсисі. Класифікація сепсису.
- •418. Особливості сепсису, що відрізняють його від інших інфекційних захворювань. Патологічна анатомія клініко-морфологічних форм сепсису. Ускладнення, причини смерті.
- •419. Черевний тиф. Визначення, етіологія, епідеміологія, патогенез, патологічна анатомія, ускладнення, причини смерті.
- •420. Сальмонельоз. Визначення, етіологія, епідеміологія, патогенез, клініко-морфологічна класифікація, патологічна анатомія, ускладнення.
- •421. Дизентерія. Визначення, етіологія, епідеміологія, патогенез, патологічна анатомія, ускладнення, причини смерті.
- •422. Амебіаз. Визначення, етіологія, епідеміологія, патогенез, патологічна анатомія, ускладнення. Диференціальна діагностика морфологічних змін в кишківнику при дизентерії та амебіазі.
- •423. Ієрсиніоз. Визначення, етіологія, епідеміологія, патогенез, патологічна анатомія, ускладнення, причини смерті.
- •424 Вірусний, кампілоподібний, стафілококовий та коліентерити.
- •425. Гострі респіраторні вірусні інфекції( грві): грип, парагрип, риновірусна інфекція, аденовірусна інфекція.
- •427Дифтерія.
- •429. Скарлатина.
- •430. Менінгококова інфекція.
- •445 Вторинний туберкульоз. Загальна характеристика. Форми-фази вторинного туберкульозу, їх морфологічна характеристика і ускладнення.
- •446. Ускладнення і причини смерті хворих на первинний, гематогенний і вторинний туберкульоз.
- •447.Сучасний патоморфоз туберкульозу.
- •448.Сифіліс. Визначення, етіологія, епідеміологія, патогенез, патологічна анатомія, ускладнення, наслідки. Вроджений сифіліс: форми, клініко-морфологічна характеристика.
- •449.Повільні вірусні нейроінфекції і пріонові хвороби (куру, хвороба Крейтцфельдта - Якоба). Етіологія, епідеміологія, морфологічна характеристика.Начало формы
- •451.Тропічні інфекції. Епідеміологія, етіологія, патогенез, клініко- морфологічна характеристика, ускладнення, наслідки, причини смерті.
- •453.Чума. Визначення, етіологія, епідеміологія, патогенез,патологічна анатомія, ускладнення, насідки, причини смерті.
- •454. Сибірка. Визначення, етіологія, епідеміологія, патогенез,патологічна анатомія, ускладнення, насідки, причини смерті.
- •455.Холера. Визначення, етіологія, епідеміологія, патогенез,патологічна анатомія, ускладнення, насідки, причини смерті.
- •456.Туляремія. Визначення, етіологія, епідеміологія, патогенез,патологічна анатомія, ускладнення, насідки, причини смерті.
- •457.Малярія. Визначення, етіологія, епідеміологія, патогенез,патологічна анатомія, ускладнення, насідки, причини смерті
- •458.Мікози. Визначення, етіологія, епідеміологія, патогенез,патологічна анатомія, ускладнення, насідки, причини смерті.
- •459.Вісцеральні мікози. Визначення, етіологія, епідеміологія, патогенез,патологічна анатомія, ускладнення, насідки, причини смерті.
- •460.Ехінококоз, цистицеркоз, опісторхоз, шистосомоз. Визначення, етіологія, епідеміологія, патогенез,патологічна анатомія, ускладнення, насідки, причини смерті.
Патологія, патологічна анатомія і патоморфологія: визначення, задачі, історія і напрямки розвитку, значення для медичної освіти, науки і практики. Загальна та спеціальна патоморфологія.
Патоморфологія (патологічна анатомія) — навчальна дисципліна, яка дає поняття про структурне підґрунтя хвороб людини для поглибленого засвоєння фундаментальних основ медицини та клінічної картини захворювань з подальшим використанням одержаних знань у практичній роботі лікаря. Загальна патоморфологія закладає розуміння структурних основ клітинно-органної патології — типових загальнопатологічних процесів, сукупність яких зумовлює морфофункціональні прояви певних захворювань. Спеціальна (клінічна) патоморфологія дає знання структурних основ розвитку хвороб людини та їх клінічних проявів, одужання, ускладнень і наслідків; знання змін захворювань, що розвиваються у зв’язку зі змінами умов життя людини та навколишнього середовища (патоморфоз);
Предметом вивчення навчальної дисципліни є структурне підґрунтя хвороб людини для поглибленого засвоєння фундаментальних основ медицини та клінічної картини захворювань із подальшим використанням одержаних знань у практичній роботі лікаря.
та та завдання навчальної дисципліни
Метою патоморфології є вивчення мікроскопічної та ультрамікроскопічної будови структур людського організму, їх розвитку і змін у різноманітних умовах життєдіяльності.
Вивчення типових загальнопатологічних процесів, сукупність яких зумовлює морфологічні прояви захворювань.
Вивчити структурне підґрунтя розвитку хвороб та їх клінічних проявів, структурних основ одужання, ускладнень та наслідків.
Вивчення методів патоморфологічних досліджень: аутопсія, біопсія, дослідження біопсійного матеріалу, експериментальне моделювання захворювань.
Патологія — наука про структурні, біохімічні та функціональні зміни в клітинах, тканинах та органах, спричинені хворобою.
Як самостійна дисципліна патологічна анатомія розвивалася повільно у зв'язку з тим, що розтин тіл померлих довго було заборонено. У XVI столітті почали накопичувати матеріали з патологічної анатомії хвороб, отримані при розтині трупів. У 1761 році вийшла у світ праця італійського анатома Дж. Морганьї (1682-1771) «Про місце знаходження та причини хвороб, виявлених анатомом» ,. У XIX столітті відкривалися кафедри патологічної анатомії в Берліні, Парижі, Відні, Москві, Петербурзі. Представник віденської школи К. Рокитанський (1804-1878) на підставі величезного особистого досвіду створив одне з кращих в той час посібників з патологічної анатомії. К. Рокитанський був останнім представником панувала протягом століть теорії гуморальної патології людини, яка не мала наукової основи. У XX столітті патологічна анатомія стала бурхливо розвиватися, залучаючи до вирішення своїх завдань біохімію і біофізику, імунологію і генетику, молекулярну біологію, електроніку й інформатику. У багатьох країнах були створені інститути патології, з'явилися фундаментальні керівництва і журнали з патологічної анатомії; створені Міжнародне, Європейське та національні наукові товариства патологоанатомів. У другій половині XIX-початку XX століття відкрилися кафедри патологічної анатомії в медичних інститутах Харкова та Києва.
Патологічний процес та захворювання: визначення, загальна характеристика. Типові загальнопатологічні процеси.
Патологічний процес - це певна послідовність змін і реакцій, що закономірно виникають і розвиваються в організмі внаслідок дії патогенного фактора. Це поєднання процесів руйнування (ушкодження) і захисних компенсаторних реакцій, що виникають на різних рівнях організації організму під дією патогенного фактор
Захворювання — патологічний процес, який проявляється порушеннями морфології, обміну речовин чи / та функціонування організму (його частин) у людини. До типових загальнопатологічних процесів відносяться порушення крово- та лімфообігу , дистрофія, запалення, неопластична прогресія, некроз, імунні реакції.
Розрізняють чотири періоди захворювання:
1) латентний (інкубаційний);
2) продромальний;
3) період виражених клінічних ознак;
4) завершення хвороби.
Методи патоморфологічних досліджень (аутопсія, біопсія, дослідження операційного матеріалу, експеримент) та рівні дослідження (макроскопічний, мікроскопічний (тканинний та клітинний), електронномікроскопічний, молекулярний).
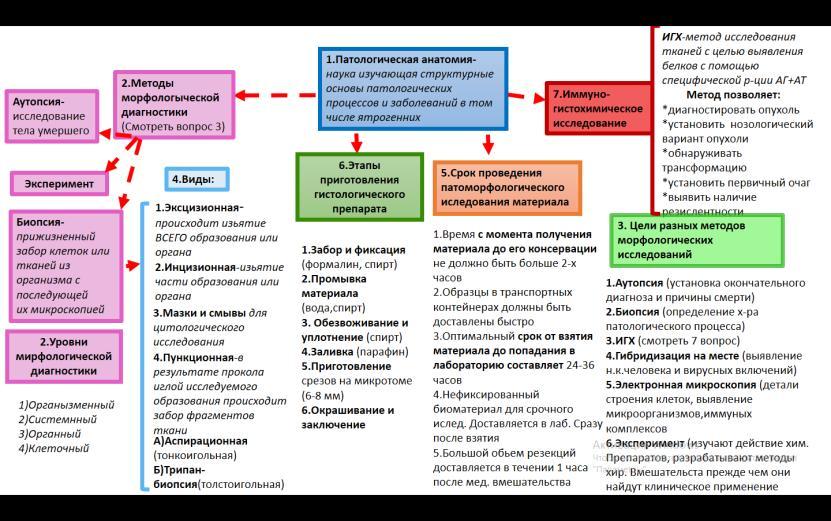
Організмений рівень дозволяє бачити хворобу цілісного організму й у взаємозв’язку всіх органів і систем.
Системний рівень – це рівень вивчення якої-небудь системи органів чи тканин, що поєднані спільністю функцій (наприклад, системи сполучної тканини, системи крові, системи травлення та ін.).
Органний рівень дозволяє виявляти зміни окремо взятих органів.
Тканинний і клітинний рівні – це рівні вивчення змінених тканин, клітин і міжклітинної речовини за допомогою світлооптичних методів дослідження.
Субклітинний рівень дозволяє спостерігати за допомогою електронного мікроскопа зміни ультраструктур клітин і міжклітинної речовини, які в більшості випадків є першими морфологічними проявами хвороби.
Молекулярний рівень – вивчення хвороби можливе при використанні комплексних методів дослідження з залученням електронної мікроскопії, імуногістохімії, цитохімії, радіоавтографії.
Основні терміни та поняття, що використовуються при морфологічному дослідженні: паренхіма, строма, клітина, екстрацелюлярний матрикс, гістіон, нефрон, печінкова часточка, легеневий ацинус, морфологічна класифікація епітелію.
Паренхіма — тканина внутрішнього середовища багатоклітинних організмів, що складається з приблизно однакових неполяризованих клітин. Також використовується для опори.
Строма — основа органів тварин, яка складається з пухкої або щільної волокнистої неоформленої сполучної тканини.
Клітина — структурно-функціональна одиниця всіх живих організмів, для якої характерний власний метаболізм та здатність до самовідтворення.
Екстрацелюлярний матрикс — це позаклітинна частина тканин тваринних організмів (передусім сполучної тканини), що залягає у міжклітинному просторі.
Гістіон - структурно-функціональна одиниця сполучної тканини.
Нефрон — це епітеліальна структура, яка являє собою систему звивистих і прямих канальців, що сліпо починаються капсулою від судинного клубочка кожного ниркового тільця, та впадає у збірну трубочку.
Печінкові часточки — структурно-функціональні одиниці печінки.
Легеневий ацинус — структурно-функціональна одиниця легень. Складається з гілок термінальної бронхіоли - респіраторних бронхіол 1, 2 і 3-го порядків і альвеолярних ходів, розгалужуються на альвеолярні мішечки.
Класифікація покривного епітелію:
- одношаровий:
плоский;
Одношаровий плоский епітелій, або мезотелій локалізується у кровоносних судинах, серозних оболонках, вистеляє очеревину, плевру, перикард. Функції мезотелію: вистелення, полегшення руху внутрішніх органів, секреція біологічно активних речовин, піноцитоз.
кубічний;
Одношаровий кубічний епітелій локалізується у нирковому канальці, бронхіолах легень. Функції: вистелення, секреція та транспорт речовин.
-
призматичний (циліндричний);
Одношаровий циліндричний епітелій локалізується у кишках, шлунку, жовчному міхурі, вивідних протоках печінки, порожнині матки та яйцеводів. Функції: вистелення, захист, абсорбція, секреція речовин.
-
циліндричний багаторядний війчастий (респіраторний), або псевдобагатошаровий;
Одношаровий багаторядний епітелій локалізується у трахеї, бронхах та деяких відділах статевої системи.Функції: вистелення, захист, секреція.
- багатошаровий:
-
плоский незроговілий;
Багатошаровий плоский незроговілий епітелій локалізується у рогівці ока, стравоході, ротовій порожнині, піхві, анальній частині прямої кишки. Має три види клітинних шарів: базальний, остистий, шар плоских клітин. Функції: вистелення та захист.
-
плоский зроговілий;
Багатошаровий плоский зроговілий епітелій,або епідерміс локалізується на шкірі. Має п'ять шарів: базальний, остистий, зернистий, блискучий, роговий. Функції: вистелення та захист.
-
перехідний;
Багатошаровий перехідний епітелій локалізується у сечоводі, сечівнику, сечовому міхурі. Має три шари: базальний, проміжний, покривний. Функції: вистелення та захист.
Класифікація залозистого епітелію:
- за місцем розташування клітин:
-
ендотелій,
-
екзотелій;
- за структурою:
-
одноклітинний,
-
багатоклітинний;
- за знаходженням відносно епітелію:
-
ендоепітеліальні,
-
екзоепітеліальні.
Алгоритм вивчення патологічних процесів та захворювань: етіологія, патогенез, морфогенез, патологічна анатомія, функціональні розлади, ускладнення, наслідки, прогноз та значення.
Етіологія в медицині— теоретичний розділ медицини, який вивчає причини виникнення хвороб, зокрема інфекційних. Також часто це у вузькому розумінні визначають як окреслення безпосередньої причини хвороби, синдрому або патологічного стану.
Патогенез — механізми виникнення і розвитку хвороби і окремих її проявів на різних рівнях організму — від молекулярних порушень до змін в органах і системах; розділ патології, що трактує питання патогенезу.
Морфогенез в біології — процес виникнення і розвитку органів, систем і частин тіла організмів як в індивідуальному (онтогенез), так і в історичному, еволюційному, розвитку (філогенез).
Патологічна анатомія — клінічний розділ медицини, що вивчає основи патологічних процесів в організмі людини з метою встановлення діагнозу та / або причини смерті.Підрозділом патологічної анатомії є патоморфологія, яка вивчає як загальні патологічні зміни органів і тканин під дією загальних факторів (запалення, травма, тощо), так і їхні особливості при окремих хворобах.
Функціональні розлади — це різноманітні комбінації хронічних та/чи рецидивуючих симптомів, які часто свідчать про порушення рухової функції та чутливості.
Ускладнення — новий медичний стан чи захворювання, яке виникло як наслідок іншої, попередньої хвороби.
Прогноз— спеціальне наукове дослідження конкретних перспектив розвитку якого-небудь явища.
Пошкодження клітини (альтерація): визначення, загальна характеристика. Зворотнє і незворотнє пошкодження. Особливості альтерації у дитячому віці.
В патології під пошкодженням, або альтерацією, розуміють зміни структури клітин, міжклітинної речовини, тканин і органів, які супроводжуються порушенням їх життєдіяльності.
Пошкодження здатні викликати найрізноманітніші причини. Вони можуть діяти на клітинні і тканинні структури безпосередньо або опосередковано (через гуморальні і рефлекторні впливу), причому характер і ступінь ушкодження залежать від сили і природи патогенного чинника, структурно-функціональних особливостей органу або тканини, а також від реактивності організму. В одних випадках виникають поверхневі і оборотні зміни, що стосуються зазвичай лише ультраструктур, в інших - глибокі і незворотні, які можуть завершитися загибеллю не тільки клітин і тканин, а й цілих органів. Пошкодження має різне морфологічне вираження на клітинному і тканинному рівнях. На клітинному рівні воно представлено різноманітними ультраструктурнимі змінами клітини, що становить зміст великого розділу загальної патології - патології клітини. На тканинному рівні ушкодження представлено двома загальнопатологічними процесами - дистрофією і некрозом, які нерідко є послідовними стадіями альтерації.
Характерною особливістю перебігу процесів пошкодження у дитячому віці є виражена інтоксикація. Це пов'язано з тим, що печінка і нирки, які здійснюють виведення продуктів метаболізму, закінчують своє формування в основному до 6-8 років.
Основні пошкоджуючі фактори: екзогенні (фізичні, хімічні, біологічні), ендогенні (генетичні дефекти, гормони, метаболіти) та приклади впливів, що найчастіше зумовлюють розвиток патологічного процесу (гіпоксія/ішемія, дія вільних радикалів, імунні реакції, генетичні впливи, розлади харчування).
Пошкоджуючий фактор чинить безпосередній пошкоджуючий вплив на клітину.
Основні пошкоджуючі фактори:
1. Екзогенні: фізичні (шум, вібрація, тиск, радіація); хімічні (побутові, виробничі, лікарські засоби); біологічні (інфекційні);
2. Ендогенні: генні та хромосомні аберрації; хвороби матері (непрохідність маткових труб, дефіцит ваги та ін.), гормональні (гіпер або гіпопродукція), метаболітичні(накопичення або недостатність певних метаблолітів, що призводить до патологічних станів).
Гіпоксія — патологічний стан, під час якого тканини і органи недостатньо насичуються киснем або кисню достатньо, але він не засвоюється тканинами.
Ішемія — зниження кровопостачання чи повне його припинення у тканинах, що призводить до нестачі кисню і глюкози, необхідних для клітинного метаболізму.
Дія вільних радикалів призводить до перетворення кисню, ліпідів, нуклеїнових кислот, білків та інших сполук, їх окиснення. Накопичення пероксидів у значній кількості в мітохондріях викликає набрякання та руйнування, що призводить до порушення впорядкованості фіксації та функцій ферментативних систем дихання. У разі посилення окислення спостерігається роз’єднання дихання і фосфорилювання, що є причиною послаблення біосинтезу макроергічних сполук, особливо АТФ. Це гальмує процеси біосинтезу білків, нуклеїнових кислот та інших сполук.
Розвиток імунних реакцій гуморального й клітинного типу починається з проникнення антигену в організм людини й взаємодії з ним імунокомпетентних клітин. Цей процес завершується елімінацією антигенів, які викликали реакцію, або відторгненням трансплантату. Антиген може потрапити до організму через різні бар'єрні тканини організму: шкіру, слизові оболонки шлунково-кишкового та урогенітального трактів, дихальні шляхи та різні органи й тканини. Імунний процес носить генералізований характер, зачіпляючи, не залежно від місця втручання антигенів, всі органи імунітету. Це обумовлено деякими факторами, у тому числі тім, що лімфоїдні клітини постійно циркулюють між усіма лімфоїдними органами й тканинами. У розвитку імунної реакції як гуморального, так і клітинного типу, розрізняють 3 етапи: 1. Аферентний; 2. Центральний; 3. Еферентний. На аферентному етапі відбувається розпізнавання антигенно чужорідного агента (наприклад, патогенних мікроорганізмів) антигенпрезентуючими клітинами (макрофагами, дендритними клітинами, В-лімфоцитами), його поглинання, процессинг антигену і його презентація в спеціальній імуногенній формі. На цьому етапі спостерігається посилення міграції імунокомпетентних клітин у зони концентрації антигенів. На центральному етапі спостерігаються реакції міжклітинних взаємодій, проліферація й диференціювання клонів специфічних Т- і В-лімфоцитів, формування ефекторних клітин і клітин імунної «пам'яті». У випадку розвитку гуморальної імунної реакції утворюються плазматичні клітини - продуценти антитіл, при розвитку клітинного імунітету - цитотоксичні ефекторні клітини. 6 На еферентному етапі відбувається реалізація імунної реакції, що проявляється в знищенні чужорідних клітин-мішеней цитотоксичними лімфоцитами й макрофагами або нейтралізації розчинного антигену (наприклад, екзотоксину бактерій), лізисі позаклітинних бактерій антитілами. Основною умовою розвитку імунної реакції є розпізнавання антигену, яке здійснюється як розчинними молекулами, так і молекулами, що вбудовані в мембрану клітин.
Генетичні хвороби — порушення нормальної роботи організму через зміни послідовності генів або структури хромосом. Деякі генетичні хвороби викликаються хромосомними порушеннями, що виникають через помилки процесу мейозу між генеративними клітинами. Приклади таких генетичних хвороб включають синдром Дауна (додаткова хромосома 21), синдром Шерешевського-Тернера (45X0) і синдром Клайнфельтера (чоловік з 2 X-хромосомами). Інші генетичні зміни можуть відбуватися протягом формування генеративних клітин одним з батьків. Один приклад — мутації тріплетного повторення, які можуть викликати fragile X синдром та хворобу Хантінгтона. Дефектні гени також можуть бути цілком успадковані від батьків. Типи генетичних хвороб: моногенні, полігенні, хромосомні, мітохондріальні.
Розлади харчування призводять до дистрофії всії тканин організму, некрозу та патологісних станів як кома чи кахексія.
Варіанти відповіді клітини на пошкодження: гостре пошкодження, хронічне нелетальне пошкодження, внутрішньоклітинні нагромадження, адаптації, кальциноз, старіння клітини.
Ультраструктурні зміни клітин, як відповідь на дію пошкоджуючих агентів:
1. Гіперплазія – збільшення кількості органел за рахунок гіперплазії мембранних структур.
2. Гіпертрофія – збільшення розміру органел за рахунок гіперплазії мембранних структур.
3. Атрофія – зменшення розміру органел з редукцією окремих структурних компонентів.
4. Набрякання – збільшення об\єму органел за рахунок накопичення води.
5. Розширення – приріст мембранних органел.
6. Фрагментація – поділ клітини/органел/їх частин на фрагменти.
7. Гомогенізація – надання компонентам клітини однорідної структури.
8. Конденсація – ущільнення хроматину.
9. Вакуолізація – різновид клітинної дистрофії, що характеризується утроренням в цитоплазмі вакуолів, що містять в собі воду, глікоген або ліпіди.
10. Руйнування – порушення цілісності клітини або її компонентів.
11. Включення – поява в клітини структур з хімічними сполуками.
12. Мієлінові фігури – аутофагосоми з нагромадженим мембранним матеріалом, що довго залишається в клітині.
13. Випинання – деформація структурних елементів клітини із виходом їх за межі клітини.
14. Рексис – розрив клітинних структур.
15. Пікноз – зморщування, процес дегенерації ядра.
16. Кальциноз — патофізіологічний і метаболічний синдром, який відбувається через відкладення кальцієвих солей у тканинах та в різних патологічних утвореннях.
17. Клітинне старіння — перманентна зупинка клітинного циклу, під час якої клітина зберігає метаболічну активність. Оборотні зміни:
-
Набряк клітини;
-
Жирові зміни;
-
Руйнування плазматичної мембрани;
-
Втрата мікроворсинок (за їх наявності);
-
Еозинофілія (через зменшення вмісту цитоплазматичної РНК);
-
Аутофагія.
Необоротні зміни:
-
Некроз;
-
Апоптоз.
Зворотні пошкодження клітин та тканин виникають внаслідок порушення тканинного або клітинного метаболізму і супроводжуються внутрішньоклітинними чи тканинними накопиченнями тих речовин (білки, жири, вуглеводи), які є в нормі, або появою патологічних, яких в нормі немає. Такі зміни називаються патологічними накопиченнями продуктів обміну речовин, або ж дистрофіями і мають свій морфологічний вираз. Внутрішньоклітинне накопичення речовин викликає розвиток паренхіматозних дистрофій. Паренхіматозні дистрофії виникають в основному у високоспеціалізованих клітинах паренхіматозних органів (нирки, печінка, серце, головний мозок тощо). В основі розвитку паренхіматозних дистрофій лежать набуті або спадкові ферментопатії. Останні складають велику групу хвороб накопичення.
Пошкодження клітини (альтерація): морфологічні прояви зворотніх та незворотніх змін на ультраструктурному та світлооптичному рівнях.
Світлооптичний рівень:
Оборотні зміни:
-
Набряк клітини;
-
Жирові зміни;
-
Руйнування плазматичної мембрани;
-
Втрата мікроворсинок (за їх наявності);
-
Еозинофілія (через зменшення вмісту цитоплазматичної РНК);
-
Аутофагія- роцес перетравлення клітиною власних органел та ділянок цитоплазми за допомогою лізосом.
Необоротні зміни:
-
Некроз — патологічний стан при якому відбувається денатурація внутрішньоклітинних протеїнів та ферментативне перетравлення змертвілих клітин.
-
Апоптоз — це сукупність клітинних процесів, що призводять до запрогромованої загибелі клітини.
Ультраструктурний см. вопрос 8.
Патологія поверхневого комплексу клітини (надмембранний комплекс, плазматична мембрана, підмембранний компонент) та органел цитоплазми (зміни плазматичних мембран ендоплазматичної сітки, внутрішнього пластинчастого комплексу, гранул, мітохондрій, лізосом, мікротілець).
Надмембранний комплекс або глікокалікс наявний практично у всіх клітинах, але ступінь його вираженості буває різним. Особливістю глікокаліксу клітин є висока швидкість відновлення. Цим пояснюється широка функціональна та філогенетична пластичність систем поверхневих структур. В утворенні глікокаліксу беруть участь олігосахаридні ланцюги глікопротеїнів і гліколіпідів, кислі глікозаміноглікани, сіалові кислоти. Глікокалікс, перебуваючи в безпосередньому контакті з зовнішнім середовищем, має важливе значення в рецепторній функції поверхневого апарату клітини, тому що надмембранний компонент рецепторів входить до складу глікокаліксу і за своєю природою є глікопротеїн. Рецептори здатні вільно переміщуватись як по поверхні клітинної мембрани, так і всередині її (так звана латеральна дифузія рецепторів) або мати обмежену рухливість.
Порушення механізмів рецепції відіграє важливу роль у розвитку цілого ряду хвороб людини. Одні з них пов'язані з відсутністю або блокадою рецепторів клітини. Так, відсутність апо - , В- і Е-рецепторів у паренхіматозних та мезенхімальних клітинах веде до розвитку гомозиготної гіперліпопротеїнемії IIа типу, що відома також як сімейна ессенціальна гіперхолестеринемія. Трансплантація печінки із збереженням апо-, В- і Е-рецепторів при гомозиготній гіперліпопротеїнемії знижує рівень холестерину в крові до норми, що супроводжується зменшенням проявів атеросклерозу та ішемічної хвороби серця. З вродженим дефектом рецепторів до Fc-фрагментів імуноглобулінів у мезангіоцитах пов'язують ідіопатичну мембранозну нефропатію. Блокаду рецепторів клітини часто викликають аутоантитіла. Виникає одна із різновидностей цитотоксичних реакцій — реакція інактивації й нейтралізації, що проявляється антитільними хворобами рецепторів. Зокрема, це міастенія, в розвитку якої беруть участь антитіла до ацетилхолінових рецепторів нервово-м'язової пластинки, а також резистентний до інсуліну цукровий діабет, при якому антитіла проти клітинних рецепторів до інсуліну блокують ці рецептори і не дозволяють клітині відповідати на інсуліновий сигнал. Пошкодження функції рецепторів на поверхні В- і Т-лімфоцитів призводять до недостатності імунної системи організму.
З функцією надмембранного клітинного шару пов'язана і властивість клітин до адгезії. Наявність на поверхні клітини білкових молекул клітинної адгезії (МКА) забезпечує процеси морфогенезу (формування тканин, органів, систем). Зміна структури МКА призводить до порушень морфогенезу в період ембріонального розвитку людини, або викликає розвиток деяких захворювань.
Основним структурним компонентом поверхневого апарату є плазматична мембрана (плазмолема), або зовнішня клітинна мембрана. Вона найбільш стійка і є універсальною для всіх клітин. Основу її складає ліпопротеїновий комплекс. Плазматична мембрана має рідинно-мозаїчний принцип будови, тобто фосфоліпіди утворюють суцільний подвійний шар, в який частково або повністю занурюються молекули білків. Існує три різновиди білків: інтегральні, напівінтегральні і периферичні.
Основною функцією плазматичної мембрани є транспорт речовин представлений у вигляді:
а) дифузії (пасивний транспорт);
б) полегшеної дифузії;
в) активного транспорту речовин через мембрану проти градієнту концентрації з використанням енергії за рахунок розщеплення АТФ
Порушення структури мембран умовно можна поділити на: транспортні, функціонально-метаболічні та структурні.
Порушення транспортних функцій і, насамперед, збільшення проникливості мембран - універсальна ознака пошкодження клітини. У людини порушення транспортних функцій зумовлює більше двадцяти так званих "транспортних" хвороб (ниркова глікозурія, цистинурія, порушення всмоктування глюкози, вітаміну В12, спадковий сфероцитоз та ін.). Серед функціонально-метаболічних процесів клітинних мембран центральними є зміни процесів біосинтезу, а також різні відхилення в енергозабезпеченні живих систем. Структурні пошкодження мембрани головним чином пов'язані зі змінами її конфігурації. Останні можуть бути зумовлені змінами ригідності в деяких її ділянках, що в свою чергу залежить від вмісту в мембрані холестерину.
Підмембранний компонент є третім структурним компонентом поверхневого мембранного комплексу, який контактує з внутрішньої сторони клітини з плазматичною мембраною (підмембранний, або субмембранний шар). Фактично це периферична спеціалізована частина цитоплазми, в якій сконцентровані ферментативні системи, які забезпечують процеси трансмембранного транспорту і рецепції, а також здійснюють загальні процеси внутрішньоклітинного метаболізму. В структурному плані опорно-скорочувальна система субмембранного апарату є спеціалізованою частиною загальної внутрішньоклітинної опорно-скорочувальної системи цитоплазми ("скелет" клітини) і, в зв'язку з тим, що він представлений мікрофіламентами (фібрилами) та мікротрубочками, патологічні зміни підмембранного шару пов'язані саме з цими структурами. Патологія мікрофіламентів досить різноманітна. З їхньою дисфункцією пов'язують, зокрема, деякі види холестазу, а також первинний біліарний цироз печінки. З патологією проміжних філаментів, переважно їх акумуляцією, пов'язують багато патологічних процесів: утворення алкогольного гіаліну (тільця Мелорі), нейрофібрилярних сплетінь в нейроцитах та сенільних бляшок при хворобі Альцгеймера; скупчення мікрофіламентів при деяких формах кардіоміопатій. Накопичення алкогольного гіаліну з характерною ультраструктурою в клітинах епітеліального та мезенхімального походження є морфологічним маркером хронічного алкоголізму. Патологія мікротрубочок може бути основою деяких клініко-морфологічних синдромів. Наприклад, синдром нерухомих війок (вроджений синдром Картагенера), при якому війки епітелію дихальних шляхів і слизової оболонки середнього вуха стають малорухомими. У нормі війки рухаються в результаті переміщення дублетів мікротрубочок, завдяки наявності в ручках білка динеїну. Недостатність або відсутність цього білка різко послаблює мукоцелюлярний транспорт або ж він повністю припиняється, що призводить до хронічного запалення дихальних шляхів і середнього вуха. У таких хворих виникає безпліддя, бо стають нерухомими сперматозоїди, хвости яких еквівалентні війкам.
Ендоплазматична сітка (лат. reticulum endoplasmicum, EC) — це сукупність канальців, мішечків і цистерн, утворених мембранами, що безпосередньо контактують з плазмолемою клітини та каріолемою. Розрізняють два типи EC: гранулярну та агранулярну. Перша представлена сукупністю канальців, мішечків і цистерн, до мембран яких з боку гіалоплазми прикріплені рибосоми. Функція гранулярної EC, крім біосинтезу білків, полягає в транспортуванні цих білків в інші ділянки клітини.
Агранулярна ендоплазматична сітки — це система розгалужених канальців, вакуолей і цистерн, на мембранах яких, на відміну від гранулярної EC, відсутні рибосоми. Функціями агранулярної (гладенької) EC є: участь у синтезі ліпідів, ліпопротеїдів, стероїдних гормонів, дезактивація різних шкідливих речовин та лікарських препаратів, синтез глікогену. Ступінь складності будови цієї органели пов'язаний з функціональною активністю клітини, в якій вона міститься.
Зміни гранулярної і агранулярної EC можуть свідчити про пошкодження різних функцій клітини і проявляються гіперплазією і атрофією, дезагрегацією (дисоціацією) рибосом і полісом, утворенням аномальних рибосомально-пластинчастих комплексів.
Зміни ендоплазматичної сітки досить стереотипні: збільшення (при гіперфункції клітини) або зменшення (при гіпофункції клітини) кількості та розмірів канальців, концентричне розташування мембран, розширення канальців з появою в них осміофільного вмісту (при токсичній дії), вакуолізація, фрагментація, зникнення рибосом, накопичення в канальцях фрагментів мембран, залишків клітинних органел (при дистрофії та некробіозі). Комплекс Гольджі (лат. Complex Golgi, синоніми: внутрішній сітчастий апарат, пластинчастий комплекс) — мембранна органела загального призначення. Основними структурними компонентами його є скупчення сплющених цистерн, маленьких пухирців та великих вакуолей. Весь цей комплекс мембранних утворень називають диктіосомою, вона має дві поверхні (випукла проксимальна та вігнута дистальна). Функції комплексу Гольджі: накопичення, хімічна модифікація та дозрівання продуктів, синтезованих в елементах гранулярної ендоплазматичної сітки; синтез полісахаридів, глікопротеїдів, ряду ферментів та гормонів; участь в утворенні лізосом та пероксисом.
Морфологічними проявами порушення діяльності пластинчастого комплексу і секретоутворення може бути гіпертрофія та атрофія.
Гіпертрофія комплексу Гольджі, тобто збільшення кількості диктіосом за рахунок гіперплазії його мембран, секреторних гранул, везикул і вакуолей, є проявом підвищеного синтезу і секреції білків, гліколіпідів або полісахаридів. Продукти синтезу можуть накопичуватися в гіпертрофованих диктіосомах комплексу Гольджі в результаті порушення секреції та виведення їх, що може супроводжуватись пошкодженням канальців. Приклад — накопичення жовчі в пластинчастому комплексі гепатоцитів при холестазі.
Атрофія комплексу Гольджі, тобто зменшення його розмірів з редукцією окремих компонентів, свідчить про зниження його функціональної активності. Однією з причин цього процесу є недостатність білкових запасів організму. У зв'язку з тим, що синтетична діяльність цієї органели тісно пов'язана з ендоплазматичною сіткою, другою причиною атрофії є порушення взаємодії пластинчастого комплексу з ендоплазматичною сіткою, тобто пошкодження внутрішньоклітинного конвеєра.
Лізосоми (лат. lysosomae) — мембранні органели загального призначення. Вони представлені у вигляді електронне щільних утворень круглої форми діаметром 0,2-0,4 мкм, які містять біля 60 гідролітичних ферментів, основною функцією яких є розщеплення в клітині цілого ряду речовин (внутрішньоклітинне травлення). На зовнішній поверхні їхніх мембран розташований розвинений рецепторний апарат. Значення лізосом у патології різноманітне, і важко уявити патологічний процес, в якому вони б не брали участі. Остання може бути двоякою. По-перше, вони відіграють важливу роль у розвитку таких патологічних процесів, як запалення, некроз, гіпоксія, голод та інші. де участь лізосом має вторинний характер. По-друге, може мати місце пошкодження структури самих лізосом, що супроводжується розвитком патологічних процесів. У цих випадках пошкодження лізосом є первинним і розглядається як пусковий механізм у розвитку захворювання. До патології лізосомальних мембран можуть призводити різні мембранотропні речовини екзогенного та ендогенного походження. Проникність мембран лізосом значно підвищується при гіпоксії, дії токсичних речовин та лікарських препаратів, змінах кислотно-лужної рівноваги, після травм та оперативних втручань, змін гормонального статусу організму, дії радіації, при деяких захворюваннях суглобів, атеросклерозі, інфекційних захворюваннях. Серед патологічних станів, які пов'язані з пошкодженням лізосомальних мембран, найбільш вивчені хвороби суглобів. У патогенезі цих хвороб важлива роль належить комплексу ферментів, які звільнюються з лізосом. В основному, це кислі гідролази і, перш за все, протеази типу катепсину Д, які здатні руйнувати глікопротеїдні структури хряща, а також глюкуронідази, колагенази і катіонні білки. Речовини, що стабілізують лізосомальні мембрани (до них належать і саліцилати), значно зменшують ступінь запалення.
На особливу увагу заслуговує дія лікарських препаратів на лізосомальні ферменти пухлинних клітин, що можна розглядати як один із можливих підходів до цілеспрямованого використання хіміотерапевтичних засобів. Так, при дії цитотоксину або його комбінацій з вітаміном А виявлено збільшення кількості лізосом у клітинах, активація кислої фосфатази та вихід її в цитоплазму, що характеризується зростанням дистрофічних змін у клітинах пухлини, затримує їхній ріст.
Відсутність у людини одного або кількох лізосомальних ферментів проявляється генетичне зумовленими тяжкими спадковими захворюваннями - хвороби накопичення (тезаурисмози). Група спадкових лізосомних ензимопатій досить велика. Особливо чітко вона представлена серед глікогенозів (хвороба Помпе), гангліозидозів (хвороба Тея-Сакса. Сандхофа, ювенільний гангліозидоз), гепатозів (хвороба Дабина-Джонсона), ожиріння (недостатність ліпаз адипозоцитів). Друга група спадкових захворювань пов'язана з пошкодженням функції лізосом, що призводить до порушення мембранних взаємодій між органелами і утворень велетенських органел, у тому числі велетенських лізосом. Ця група захворювань невелика: синдром Чедіака-Хігасі, або так звана циклічна нейтропенія.
Мітохондрії (лат. mitochonriae) - мембранні органели загального призначення, напівавтономна структура клітини. Вона має власний генетичний матеріал (ДНК) і може ділитись самостійно, незалежно від поділу клітини. Мітохондрія — органела синтезу АТФ (аденозинтрифосфат), який відбувається в результаті процесів окислення органічних субстратів і фосфорування АДФ (аденозиндифосфат). При патологічних процесах зміни мітохондрій досить стереотипні, хоча деякі патологічні стани несуть специфічні ознаки пошкодження. Серед змін структури мітохондрій найбільше значення має їх набухання та конденсація матриксу. Подібні зміни можуть відображати функціональне напруження клітини в умовах гіпоксії. Як правило, вони носять зворотний характер, але якщо прогресують, то приводять до загибелі мітохондрій. У цих випадках до набухання органел приєднується ущільнення їх матриксу, деформація крист, втрата мітохондріальних гранул, гомогенізація матриксу і розрив зовнішньої мітохондріальної мембрани.До основних ознак пошкодження мітохондрій слід віднести: набухання мітохондрій, просвітлення матриксу, його вакуолізацію, вогнищеву гомогенізацію, деструкцію та фрагментацію крист, дифузну гомогенізацію мітохондрій, появу вакуолей та включень кальцію, руйнування зовнішньої мембрани мітохондрії. Пероксисоми(мікротільця) (peroxysoma) — мембранні органели спеціального призначення. Це округлої форми структури діаметром 0,2-0,5 мкм. Вони мають гранулярний матрикс, у центрі якого містяться кристалоподібні структури (серцевина, нуклеоїд). Гістохімічним маркером пероксисом є фермент каталаза, який розкладає токсичний для клітини перекис водню, що утворюється в процесі перекисного окислення. Основна функція пероксисом — утилізація хімічно активного атомарного кисню, а також розщеплення етилового спирту, сечової кислоти, регуляція обміну ліпідів. Пероксисомні хвороби пов'язані з метаболічними розладами і є спадковими. Наприклад, акаталаземія, при якій активність каталази в печінці та інших органах дуже низька, як результат зниження її термостабільності. Єдиний клінічний синдром цього захворювання — виразки порожнини рота. Цереброгепаторенальний синдром Целлвегера характеризується відсутністю пероксисом в гепатоцитах. Каталазна активність печінки у цих хворих складає приблизно 20 % норми. Результатом недостатності пероксисом при цьому синдромі є порушення синтезу жовчних кислот. Системна недостатність карнатину клінічне характеризується міопатією з періодичними пошкодженнями функцій печінки і головного мозку. Виражений дефіцит карнатину спостерігається в скелетних м'язах, де не відбувається окислення жирних кислот.
11.Патологія клітинного ядра (зміни нуклеолеми, нуклеоплазми, стан хроматину,
зміни структури ядерець); патологія мітозу, хромосомні аберації та хромосомні хвороби.
Варіанти патології ядра:
1. випинання зовнішньої мембрани ядерної оболонки розвивається при дії іонізуючого випромінювання, гіпоксії, голоданні, вірусних інфекціях, пухлинному рості;
2. зміна форми ядра з утворенням глибоких інвагінацій у ядерній оболонці при дії токсичних речовин, при гіпоксії, гіперфункції клітини;
3. розширення перинуклеарного простору виникає при гіпоксії, дії іонізуючого випромінювання, голоданні;
4. випинання та викривлення внутрішньої мембрани спостерігається при пухлинних процесах;
5. зменшення розміру пор у ядерній оболонці розвивається при дії іонізуючого випромінювання, вірусних інфекцій тощо;
6. зменшення кількості ядерних пор розвивається при дії іонізуючого випромінювання, старінні клітини;
7. збільшення кількості ядерних пор спостерігається при інтоксикаціях, пухлинному рості, порушенні регенерації;
8. пошкодження зв’язку ядерної оболонки з ендоплазматичною сіткою виникає при інтоксикаціях, білковій недостатності, пухлинному процесі;
9. просвітлення нуклеоплазми та її набряк виникає в умовах гіпоксії, дії іонізуючої радіації;
10. маргінація хроматину у дрібні або великі довільно розташовані агрегати під впливом іонізуючого випромінювання, дії хімічних речовин та різних мутагенів;
11. поява в ядрі ліпідних, вірусних, білкових, глікогенових включень при дії пестицидів, вірусних інфекцій, інтоксикаціях, цукровому діабеті тощо;
12. патологія мітозу спостерігається під впливом іонізуючого випромінювання, хімічних агентів;
13. пікноз ядра (зморщення ядра в однорідну гіперхромну масу), каріорексис (руйнація ядра на окремі фрагменти), каріолізис (повне розчинення ядра)
-
Патологія мітозу
-
В життєвому циклі клітини мітоз займає особливе місце. З його допомогою здійснюється репродукція клітин, а значить, і передача їх спадкових властивостей. Підготовка клітин до мітозу складається з ряду послідовних процесів: репродукції ДНК, подвоєння маси клітини, синтезу білкових компонентів хромосом і мітотичного апарату, подвоєння клітинного центру, накопичення енергії для цитотомії. В процесі мітотичного поділу, як відомо, розрізняють 4 основні фази: профазу, метафазу, анафазу і телофазу.
-
При патології мітозу може страждати будь-яка з цих фаз. Виділяються наступні типи патології мітозу:
-
Пошкодження хромосом:
-
затримка клітин у профазі;
-
порушення спіралізаціі і деспіралізаціі хромосом;
-
фрагментація хромосом;
-
освіта мостів між хромосомами в анафазе;
-
раннє роз’єднання сестринських хроматид;
-
пошкодження кінетохора.
-
Пошкодження мітотичного апарату:
-
затримка розвитку мітозу в метафазі;
-
розосередження хромосом в метафазі;
-
тригрупові метафаза;
-
порожниста метафаза;
багатополюсні мітози;
-
асиметричні мітози;
моноцентричні мітози;
-
К-мітози.
-
Порушення цитотомії:
-
передчасна цитотомії;
-
затримка цитотомії;
відсутність цитотомії.
Патологію мітозу можуть викликати різноманітні впливи на клітину: ультрафіолетове та іонізуюче випромінювання, висока температура, хімічні речовини, в тому числі канцерогени і митотические отрути і ін Велико кількість патологічних мітозів при малігнізації тканин.
Під хромосомними абераціями розуміють зміни структури хромосом, викликані їхнім розривом з наступним розподілом, втратою або подвоєнням генетичного матеріалу. Вони відображають різні види аномалій хромосом. У людини хромосомні аберації, що супроводжуються розвитком глибокої патології, пов’язані з аномаліями числа та структури хромосом. Зміна числа хромосом може проявлятися відсутністю однієї із пари гомологічних хромосом (моносомія) або появою додаткової, третьої, хромосоми (трисомія). Загальна кількість хромосом у каріотипі в цих випадках відрізняється від модального числа і дорівнює 45 або 47. Поліплоїдія та анеуплоїдія мають менше значення для розвитку хромосомних синдромів. До пошкоджень структури хромосом при загальному нормальному їх числі в каріотипі відносять різні типи їх «зламу»: транслокацію (обмін сегментами між двома негомологічними хромосомами), делецію (випадіння частини хромосоми), фрагментацію, кільцеві хромосоми.
Хромосомні аберації є причиною різноманітних відхилень у будові та життєдіяльності організму, які проявляються хромосомними хворобами.
Хромосомні хвороби поділяють на пов’язані з аномаліями соматичних хромосом (аутосом) і з аномаліями статевих хромосом (тільця Барра). При цьому враховують характер хромосомної аномалії — порушення числа окремих хромосом, кількості хромосомного набору або структури хромосом. Ці критерії дозволяють виділити повні чи мозаїчні клінічні форми хромосомних хвороб. Ті з них, які зумовлені порушенням числа окремих хромосом (трисоміями і моносоміями), можуть бути пов’язані як з аутосомами, так і з статевими хромосомами.
Моносомії аутосом (будь-які хромосоми, окрім X- та Y-xpoмосом) несумісні з життям. Трисомії аутосом достатньо поширені в патології людини. Найчастіше вони представлені синдромами Патау (13-та пара хромосом) і Едвардса (18-та пара), а також хворобою Дауна (21-а пара). Хромосомні синдроми при трисоміях інших пар аутосом зустрічаються значно рідше. Моносомія статевої Х-хромосоми (генотип ХО) лежить в основі синдрому Шерешевського-Тернера, трисомія статевих хромосом (генотип XXY) — в основі синдрому Клейнфелтера. Порушення числа хромосом у вигляді тетра- чи триплоідії можуть бути представлені як повними, так і мозаїчними формами хромосомних хвороб.
Порушення структури хромосом дають найбільшу групу вроджених хромосомних синдромів (понад 700 типів), але можуть бути зумовлені й іншими етіологічними факторами.
Для всіх форм хромосомних хвороб характерна множинність проявів у вигляді вроджених вад розвитку, причому їхнє формування починається на стадії гістогенезу і продовжується в органогенезі. Це пояснює схожість клінічних проявів при різних формах хромосомних хвороб.
