- •Оборотні зміни:
- •Необоротні зміни:
- •2) Специфіка фібрилярного білка амілоїду дозволяє виділити al-, аа-, af- і asc1- амілоїдоз.
- •3)Враховуючи розповсюдження амілоїдозу,
- •1.Надпечінкова (гемолітична):
- •2.Печінкова (паренхіматозна):
- •3.Підпечінкова (механічна):
- •1. Руйнівні:
- •2. Консервувальні:
- •Регенерація крові
- •Регенерація судин
- •Регенрація сполучної тканини
- •Утворення «молодої» незрілої сполучної тканини
- •Утворення «дозріваючої грануляційної тканини»
- •Далі зріла грануляційна тканина рубцеву тканина
- •Грануляційна тканина (макро і мікроскопія)
- •Регенерація жирової тканини
- •Регенерація кісткової тканини
- •Регенерація хрящової тканини
- •Регенерація епітелію
- •Регенерація нервової тканини
- •Загоювання ран
- •Безпосереднє закриття дефекту епітеліального покриву
- •Загоювання під струпом
- •Загоювання рани первинним натягом
- •Загоювання вторинним натягом (загоювання через нагноєння або загоювання за допомогою гранулювання)
- •Класифікація ексудативного запалення
- •Морфологічна характеристика склеромної гранульоми.
- •Механізми розвитку реакцій гіперчутливості
- •Надгостре:
- •Гостре:
- •Хронічне:
- •Класифікація кровотеч
- •Повітряна емболія – це патологічний процес в організмі, при якомі відбувається емболізація повітрям мікроциркуляторного русла та судин.
- •Ріст пухлини
- •Принципи класифікації
- •Порівняльна характеристика критеріїв злоякісності і доброякісності
- •Доброякісні пухлини зі сполучної тканини:
- •Доброякісні пухлини з жирової тканини:
- •Доброякісні пухлини з м’язової тканини:
- •Доброякісні пухлини з кровоносних судин:
- •Передракові стани
- •1)Диференціювання клітин:
- •3)Метастазування:
- •4)Вплив на організм:
- •Диференційні ознаки доброякісних і злоякісних пухлин
- •1. Епітеліальні пухлини
- •4. Некласифіковані пухлини
- •1.Епітеліальні пухлини
- •1.Тимоми:
- •Лімфангіосаркома
- •Злоякісна мезотеліома
- •1.Пухлини нейроепітеліальної тканини:
- •2. Пухлини оболонок мозку:
- •Види біопсії
- •Хронічні лейкози лімфоцитарного походження
- •4 Варіанти (стадії):
- •Обмінні (екзо- та ендогенні):
- •Спадковість
- •3) Ускладнені ураження:
- •Атеросклероз артерій нижніх кінцівок
- •Патогенез
- •Етіологія
- •Вплив на дихальну систему –
- •Патогенез
- •Ускладнення
- •Хронічний бронхіт
- •Пневмококи і, іі, ііі і IV типів
- •Диплобацила Фрідлендера (рідко)
- •Некласичні прояви крупозної пневмонії:
- •Загальні прояви крупозної пневмонії:
- •Ускладнення
- •Особливості бронхопневмоній залежно від віку хворих:
- •Морфологічні особливості залежно від виду інфекційного агента:
- •Ускладнення
- •Нагноєння з утворенням абсцесів
- •Плеврит
- •Етіологія
- •Мікоплазми
- •Патоморфологічна характеристика
- •Ускладнення
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика
- •Типові патоморфологічні зміни при бронхоектазах:
- •Ускладнення
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика
- •Варіанти розвитку емфіземи легень:
- •Ускладнення
- •1. Легенева (дихальна) недостатність.
- •2. «Легеневе» серце.
- •3. Хронічна правошлуночкова серцева недостатність.
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика
- •Ускладнення
- •Патогенез
- •Патоморфологічна характеристика
- •Ускладнення
- •Гіпертензія в малому колі кровообігу
- •Гіпертрофія правого серця
- •Серцево-легенева недостатність
- •Класифікація Клініко-анатомічна класифікація раку легені:
- •Етіологія
- •Морфологія
- •Мікроскопічна будова:
- •Ускладнення
- •Метастази – лімфогенні та гематогенні –
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика Клініко-морфологічні форми гострої ангіни:
- •Ускладнення
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика Морфологічні форми езофагіту:
- •Гангренозна
- •Геморагічна
- •Ускладнення
- •Етіологія
- •Патогенез
- •Патоморфологічна характеристика Макроскопічні форми раку стравоходу:
- •Мікроскопічні форми раку стравоходу:
- •Метастазування
- •Ускладнення
- •Гастрити
- •Аутоімунний.
- •Етіологія
- •Патоморфологічна характеристика форм
- •Ускладнення
- •Етіологія
- •Екзогенні фактори –
- •Патоморфологічна характеристика форм
- •Хронічний ентерит без атрофії слизової оболонки –
- •Хронічний атрофічний ентерит –
- •Ускладнення
- •Етіологія
- •Інфекційні фактори –
- •Порушення проникності кишкового бар’єру Патогенез
- •Патоморфологічна характеристика форм
- •Ускладнення
- •Етіологія і патогенез
- •Патоморфологічна характеристика
- •Ускладнення
- •Етіологія
- •Патогенез
- •Класифікація
- •IV. За морфологічними змінами:
- •2) Пухлинні
- •3) Запальні
- •2) Пухлинні
- •3) Запальні
- •2) Пухлинні
- •3) Запальні
- •2) Пухлинні
- •3) Запальні
- •Морфологічно:
- •4) Стадія чистих виразок:
- •Загальні зміни:
- •Стадіїї місцевих змін:
- •Ускладнення
- •2. Генералізована форма
- •3. Рідкі форми :
- •Паразитарні інфекції
- •Грип середньої тяжкості
- •Класифікація
- •115. Парагрип – визначення, етіологія, патогенез, клініко-морфологічна характеристика, ускладнення.
- •116. Респіраторно-синцитіальна інфекція – етіологія, патогенез, патоморфологія. Наслідки.
- •117. Аденовірусна інфекція –– визначення, етіологія, патогенез, клініко-морфологічна характеристика, ускладнення.
- •118. Коронавірусна інфекція –– визначення, етіологія, патогенез, клініко-морфологічна характеристика, ускладнення.
- •119. Морфологічні особливості пневмонії обумовленої короновірусною інфекцією.
- •120. Віл інфекція –– визначення, етіологія, патогенез, клініко-морфологічна характеристика.
- •121. Кір: етіологія, патоморфологія, ускладнення. Причини смерті.
- •122. Краснуха. Етіологія, патогенез, морфологічна характеристика, наслідки.
- •123. Скарлатина: етіологія, патоморфологія, ускладнення. Причини смерті.
- •124. Поліомієліт: етіологія, патоморфологія, ускладнення. Причини смерті.
- •125. Дифтерія: етіологія, класифікація, патоморфологія, ускладнення. Причини смерті.
ПАТОЛОГІЧНА АНАТОМІЯ
Екзаменаційні питання
І + ІІ семестр
Питання №1 для екзаменаційного білету
Визначення науки «патологічна анатомія».
+
Методи та рівні морфологічної діагностики.
+
Методи морфологічного дослідження, їх задачи.
+
Види біопсій та умови направлення біопсійного матеріалу на патоморфологічне дослідження.
+
Термін проведення патоморфологічного дослідження біопсійного матеріалу.
+
Етапи приготування гістологічного препарату.
+
Дайте визначення, що таке імуногістохімічне дослідження, його задачі, застосування в клініці.
Дайте визначення, що таке етіологія, значення знання етіології для профілактики захворювання.
Етіологія – це теоретичний розділ медицини, який вивчає причини виникнення хвороби.
Значення: знання точної причини виникнення хвороби є основою для розроблення раціонального лікування та ефективних профілактичних заходів. Наприклад, в інфекційних хворобах – це вплив конкретно на чинник, який викликав захворювання (бактерія, вірус, гриби). Також, знаючи причину хвороби, можна визначити шляхи її передачі та запобігти її розповсюдженню.
Ультраструктурні зміни клітин, як відповідь на дію пошкоджуючих агентів.
1. Гіперплазія – збільшення кількості органел за рахунок гіперплазії мембранних структур.
2. Гіпертрофія – збільшення розміру органел за рахунок гіперплазії мембранних структур.
3. Атрофія – зменшення розміру органел з редукцією окремих структурних компонентів.
4. Набрякання – збільшення об\єму органел за рахунок накопичення води.
5. Розширення – приріст мембранних органел.
6. Фрагментація – поділ клітини/органел/їх частин на фрагменти.
7. Гомогенізація – надання компонентам клітини однорідної структури.
8. Конденсація – ущільнення хроматину.
9. Вакуолізація – різновид клітинної дистрофії, що характеризується утроренням в цитоплазмі вакуолів, що містять в собі воду, глікоген або ліпіди.
10. Руйнування – порушення цілісності клітини або її компонентів.
11. Включення – поява в клітини структур з хімічними сполуками.
12. Мієлінові фігури – аутофагосоми з нагромадженим мембранним матеріалом, що довго залишається в клітині.
13. Випинання – деформація структурних елементів клітини із виходом їх за межі клітини.
14. Рексис – розрив клітинних структур.
15. Пікноз – зморщування, процес дегенерації ядра.
Дайте визначення, що таке патогенез. Співвідношення між функціональними та морфологічними змінами клітин, тканин, органів.
Патогенез – це механізм виникнення і розвитку хвороби і окремих її проявів на різних рівнях організму.
При морфологічній зміні органу змінюється і його функціональні активність. Розглянемо це на прикладах:
-
Клітинний рівень: при атрофії ЕПС відбувається зменшення синтезу білка.
-
Тканинний рівень: заміщення одношарового призматичного епітелію бронхів на багатошаровий плоский незроговілий епітелій – бронхи не можуть нормально виконувати свою функцію і затримували частинки пилу та інші речовини.
-
Органний рівень: заміщення тканини печінки на сполучну тканину при її цирозі – печінка припиняє виконувати всі свої функції.
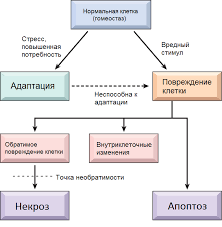
Відповідь клітин на стрес на ультраструктурному та клітинному рівні.
Ультраструктурний рівень: див. №9.
Клітинний рівень:
-
Оборотні зміни:
-
Набряк клітини;
-
Жирові зміни;
-
Руйнування плазматичної мембрани;
-
Втрата мікроворсинок (за їх наявності);
-
Еозинофілія (через зменшення вмісту цитоплазматичної РНК);
-
Аутофагія.
-
Необоротні зміни:
-
Некроз;
-
Апоптоз.
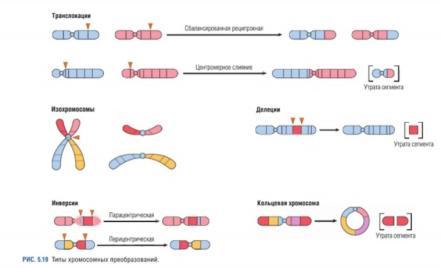
Елементи ультраструктурної патології клітини: хромосомні хвороби.
|
Хромосомні хвороби |
||||||
|
Порушення к-ті хромосом |
Порушення структури хромосом |
|||||
|
Причина |
||||||
|
Геномні мутації: Анеуплоїдія (не кратне гаплоїному числу хр.), Поліплоїдія (кратне зб. числу хромосом) *нерасхождение хр. Во время кл. Деления* |
Хромосомні аберації(відбуваються синхронно в обох хроматидах): *виникають під час кросинговеру, фізичних(іоніз. Випром) та біологічних (віруси) факторів* |
|||||
|
Результат |
||||||
|
Моносомія*2п-1* (відсутність 1 пари гомологічної хромосоми) |
Трисомія*2п+1* (наявність 3Ї додаткової хромосоми) |
Делеція Кільцева хромосома-вариінт делеції |
Дуплікація |
Інверсія |
Транслокація |
|
|
Приклад |
||||||
|
Статеві хромосоми: |
Патологічна |
|||||
|
Х0-Синдром Шершевського-Тернера |
ХХУ-синдром Клейнфелтера |
Синдром кошачого крику |
Мутація Bar у дразофіли |
|
Синдром Дауна |
|
|
Аутосоми |
Мутація , яка не завжди шкодить |
|||||
|
моносомія аутосом не сумісна з життям |
Синдром: Дауна(21) Патау(13) Едварса(18) |
ССR5-мутація рецептору (стійкість до ВІЛ) |
Згідно теорії Сусуму Оно, так зявились: гемоглобін, трипсин, міоглобін |
9-ї хр-ми (у нормі зустрічається) |
|
|
|
*визначають ще повні та мозаїчні форми* Мозаїцизм-це формування 2 і більше популяції клітин за різними хромосомати(зустрічається під час дроблення) 1.Визначають G(Гимза)0сегментуванням |
1.Визначають FISH-методом
|
|||||
Клітинні та позаклітинні механізми трофіки. Морфологія порушень обміну речовин.
Трофіка-це сукупність механізмів,що контролює метаболізм и структурну організацію тканин та клітин з метою підтримання іх функції
Клітинні механізми трофіка забезпечуються структурною організацією клітини та її ауторегуліцією.
Позаклітинна трофіка забезпечується “навколишньою середою клітини” і ругулюється системами організму (транспортною-кров’ю, лімфою,мікроциркуляторним руслом та интегративною-нейрогуморальною та нейроендокринною системами)
Дистрофія-це морфологічний вираз порушення обміну речовин.
За локалізацією вони бувають:
а) паренхіматозні-зміни відбуваються в паренхіматозних клітинах.тобто тих,що являються функціональной структурною одиницею органа (кардіоміоцит,гепатоцит,гангліозні клітини головного мозку)
б) стромально-судинні (зміни відбуваються у стромі органів)
в) змішані (зміни відбуваються і у стромі, і у паренхімі)
Дистрофії: визначення, причини виникнення, класифікація, механізми.
Дистрофія- складний патологічний процес в основі якого лежить порушення тканинного(клітинного) метаболізму, що призводить до структурних змін ( тобто виникає їх пошкодження або альтерація).
Причини:
Порушення процесів ауторегуляції клітини;
Порушення функції транспортних систем трофіки(кров, лімфа, мікроциркуляторне русло,проміжна тканина);
Порушення координації інтегративних систем трофіки (нейрогуморальні , нейроендокринні).
Класифікація:
Залежно від виду порушеного обміну речовин:
Білкові (диспротеїнози)
Жирові (ліпідози)
Вуглеводні
Мінеральні
За локалізацією:
Паренхіматозні (клітинні)
Стромально-судинні (мезенхімальні,позаклітинні)
Змішані
За походженням:
Набуті
Спадкові
За розповсюдженням процесу:
Місцеві
Загальні
Механізми розвитку:
Інфільтрація- надмірне проникнення і накопичення продуктів обміну в клітини і проміжну тканину (позаклітинну речовину) з крові та лімфи. (пов’язано з недостатністю ферментних систем , які метаболізують ці продукти).
Декомпозиція (фанероз) – розпад мембранних структур (цитоскелета) клітини шляхом руйнування ліпопротеїдних комплексів (жирова дистрофія кардіоміоцитів при дифтерійній інтоксикації , фібриноїдний некроз при ревматизмі).
Спотворений синтез – синтез в кл. або тканинах речовин , які в нормі для них не характерні (алкогольний гіалін в гепатоцитах, поява глікогену в клітнах тонкого відділу петлі Генле при цукровому діабеті, синтез аномального білка амілоїду).
Трансформація- утворення речовин одного виду обміну з спільних похідних тих продуктів , з яких утворюються білки, жири, вуглеводи (полімеризація глюкози в глікоген, утворення гіаліну в стінках судин, трансіормація компонентів жирів і вуглеводів у білки).
Морфогенетичні
механізми дистрофій


|
ІНФІЛЬТРАЦІЯ |
|
Виникнення ензимопатії Нагромадження продуктів обміну речовин |

|
ДЕКОМПОЗИЦІЯ (ФАНЕРОЗ) |
|
Розпад структур клітини та екстрацелюлярного матриксу Порушення механізмів трофіки Нагромадження продуктів порушеного обміну речовин |

|
СПОТВОРЕНИЙ СИНТЕЗ |
|
Поява в клітині речовин, які в нормі в ній не утворюються |

|
ТРАНСФОРМАЦІЯ |
|
Перехід одних речовин в інші |
Паренхіматозні дистрофії: визначення, причини виникнення, класифікація, механізми розвитку.
Паренхіматозні дистрофії – це прояви порушень обміну в високоспеціалізованих у функціональному відношенні клітинах.
*Переважають порушення клітинних механізмів трофіки.
Причини
При спадковій - ферментопатія (порушення функції ферментних систем клітини).
При набутій див. пит. №15
Класифікація:
За походженням :
Набуті
Спадкові (тезаурісмози)
Залежно від порушень виду обміну :
Білкові (диспротеїнози)
Жирові (ліпідози)
Вуглеводні
Механізм розвитку див. пит.15
Білкові паренхіматозні дистрофії: визначення, причини виникнення, класифікація, механізм розвитку.
БІЛКОВІ ДИСТРОФІЇ (диспротеїнози) – це структурно-функціональні порушення клітин і тканин у зв’язку зі змінами хімічного складу, фізико-хімічних властивостей і структурної організації білків. Вони виникають при порушенні рівноваги між синтезом і розпадом білків, їх патологічному синтезі, змінах просторової організації та колоїдних властивостей білкових молекул, а також при надходженні в організм чужорідних білків. Всі білкові дистрофії поділяють на клітинні, позаклітинні та змішані.
В основі білкової паренхіматозної дистрофії лежать зміни фізико-хімічних і морфологічних властивостей білків клітини, які можуть спричиняти денатурацію й коагуляцію білків або, навпаки, їхнє розчинення(коліквація), що призводить до порушення осмотичних або дифузійних співвідношень між клітиною та навколишнім середовищем і, нарешті, до накопичення аномальних продуктів білкового обміну.
*Внаслідок цих порушень може розвинутися коагуляційний(сухий) або колікваційний( вологий ) некроз.
Класифікація:
Гіаліново-крапельна
Гідропічна (вакуольна)
Рогова (патологічне зроговіння)
*Зерниста (у Струкові не визнач. як самостійна форма диспротеїнозів)
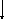
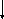
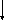
МОРФОГЕНЕЗ
ПАРЕНХІМАТОЗНИХ ДИСПРОТЕЇНОЗІВ
Денатурація
і коагуляція білків цитоплазми Гідратація,
коліквація цитоплазми (актив. лізосомних
гідролаз)
Гіаліново-
крапельна дисрофія Гідропічна
дистрофія
Коагуляційний
фокальний некроз клітини Колікваційний
фокальний некроз клітини(балонна
дистрофія)
Коагуляційний
тотальний некроз клітини Колікваційний
тотальний некроз клітини
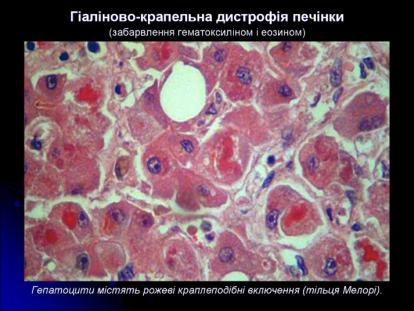
Дистрофії. Білкові паренхіматозні дистрофії. Гіаліново-крапельна дистрофія. Визначення. Механізм розвитку. Морфологічна характеристика. Наслідки.
Гіаліново-крапельна дистрофія. Характеризується утворенням у цитоплазмі великих гіаліноподібних білкових крапель, які зливаються між собою, заповнюючи цитоплазму клітини. Найчастіше зустрічається в нирках рідко – в печінці, інших залозистих органах, а в поодиноких випадках – у м’язовій тканині (особливо в міокарді). У зв’язку з безповоротною денатурацією цитоплазматичного білку вона необоротна й закінчується коагуляційним некрозом клітини. Клінічно характеризується різко вираженою недостатністю органу.
Механізм розвитку
В нирках вона розвивається при підвищенні проникливості для білкових сполук клубочкового апарату. При цьому відбувається глибока денатурація ліпопротеїдів цитоплазми з випадінням грубої дисперсної фази внаслідок втрати білками гідрофільних властивостей, або резорбція й патологічна інфільтрація клітин грубодисперсними білками (парапротеїнами), що надходять з током крові.Досить часто при нефротичному синдромі.
В печінці алкогольний гіалін (тільця Малорі). Розвивається при алкогольному гепатиті, первинному біліарному цирозі печінки , хворобі Вільсона-Конавалова.
Морфологічна характеристика
Макроскопічні зміни: ззовні органи, як правило, без змін.
Мікроскопічні зміни: накопичення гіалінових крапель у цитоплазмі клітин, при цьому відбувається деструкція органоїдів.
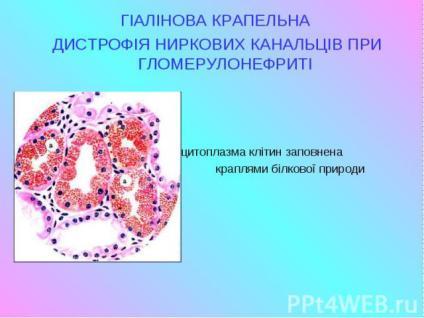
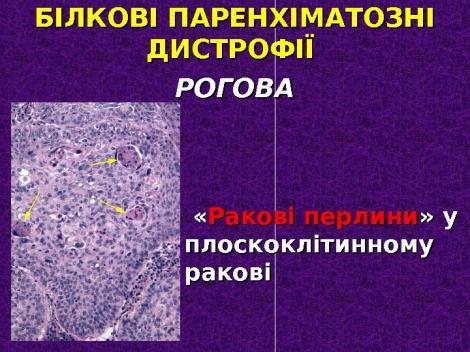
Дистрофії. Білкові паренхіматозні дистрофії. Рогова дистрофія. Визначення. Механізм розвитку. Морфологічна характеристика. Наслідки.
Рогова дистрофія,або патологічне зроговіння.При цьому виді дистрофії спостерігається надлишкове утворення рогової речовини в клітинах, в яких вона утворюється і в нормі (наприклад, іхтіоз, гіперкератоз), або там, де в нормі утворення рогової речовини відсутнє (наприклад, зроговіння слизової оболонки — лейкоплакія).
Види рогової дистрофії:
1) гіперкератоз – збільшення утворення рогової речовини в клітинах, в яких вона утворюється в нормі (природжений гіперкератоз всієї шкіри називають іхтіозом);
2) гіпокератоз – зменшення утворення рогової речовини в клітинах, в яких вона утворюється в нормі;
3) паракератоз – утворення рогової речовини нехарактерного складу в клітинах, в яких вона утворюється в нормі;
4) патологічне зроговіння – утворення рогової речовини в клітинах тканин, в яких вона в нормі відсутня (зазвичай в епітелії слизових оболонок, а також у клітинах деяких пухлин епітеліального походження – папілома, плоскоклітинний рак).
Механізм розвитку
Рогова дистрофія розвивається в зв’язку з надмірним, порушеним або зменшеним синтезом кератину в епідермісі шкіри або патологічним його синтезом в епітелії слизових оболонок. Вона виникає при білковій, мінеральній (цинк, кальцій, фосфор, йод) і вітамінній (гіповітаміноз А, пелагра) недостатності, хронічних неінфекційних, інфекційних і паразитарних хворобах, що супроводжуються запаленням шкіри, фізичних і хімічних впливах на шкіру, іноді – при спадкових хворобах (іхтіоз) і в пухлинах (папіломи, канкроїд).
Морфологічна характеристика
Макроскопічно
При гіперкератозі реєструється підвищене злущування рогових лусочок, або ж мозолеподібне потовщення шкіри, часто з грубими складками й тріщинами. Шкіра втрачає еластичність, стає щільною, сухою, шорсткою та жорсткою; поверхня розрізу – біла, блискуча (салоподібна). При вогнищевому ураженні знаходять зроговілі, сірувато-білі утворення, подібні до папілом.
При патологічному зроговінні на слизових оболонках виникають різного розміру вогнища зроговілого епітелію в вигляді тяжів і бляшок (горбків) сіро-білого кольору, що виступають над поверхнею слизової оболонки (лейкоплакія).
Мікроскопічно
При гіперкератозі :
потовщення епідермісу в результаті гіперплазії клітин мальпігієвого шару й надмірного накопичення рогової речовини.
В слизових оболонках шкіряного типу і в епідермісі шкіри можлива поява сосочкоподібних потовщень внаслідок гіперплазії шару шипуватих клітин і подовження шипуватих відростків (акантоз).
При гіпокератозі та паракератозі :
виражена атрофія зернистого шару шкіри.
Роговий шар рихлий з дискомплексованими клітинами, що мають палочкоподібні ядра.
При патологічном зроговінні :
-
метаплазію однорядного секреторного епітелію в багаторядний зроговілий плоский епітелій.
Наслідки
Рогова дистрофія – процес оборотний, але новонароджені тварини з іхтіозом як правило гинуть в перші дні життя. Часто ускладнюється вторинною інфекцією, а лейкоплакія може стати джерелом розвитку пухлин (папілом, рідше – раку).
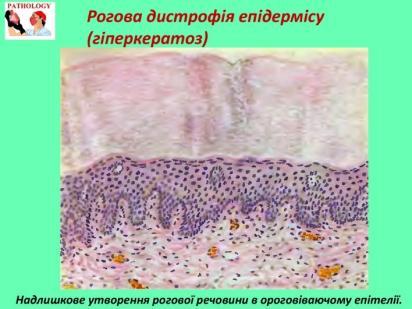
Дистрофії. Білкові паренхіматозні дистрофії. Гідропічна дистрофія. Визначення. Механізм розвитку. Морфологічна характеристика. Наслідки.
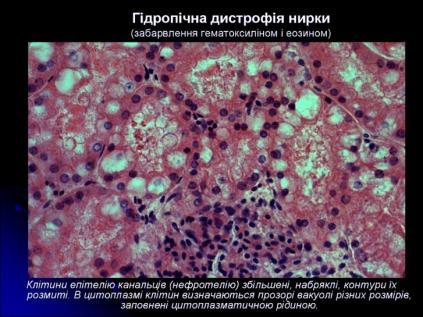
Цей вид дистрофії називається ще водянковою, або вакуольною. Найчастіше спостерігається в епітелії шкіри й ниркових канальців, клітинах печінки, м'язових і нервових клітинах. Характеризується появою в клітині вакуолей, які заповнені цитоплазматичною рідиною.
Механізм розвитку
Розвивається внаслідок гіпоксії тканин у зв’язку зі звільненням і затримкою в клітині зв’язаної води та надходженням води з тканинної рідини, крові й лімфи внаслідок підвищення колоїдно-осмотичного тиску й порушення проникливості клітинних мембран.
В нирках зумовлена ураженням гломерулярного фільтра, в печінці при гепатитах.
Морфологічна характеристика
Макроскопічно несуттєві зміни , звичайно ця дистрофія виявл. при мікроскопічному дослідженні.
Мікроскопічно
-
Клітини збільшені в об’ємі
-
Цитоплазма заповнена вакуолями з прозорою рідиною
-
Ядро зміщене на периферію, іноді у ньому з’являються вакуолі або воно зморщується.
-
Клітина перетворюється на балони, заповнені рідиною, в якій плаває пухиревидне ядро.
Наслідки – фокальний/тотальний колікваційний некроз (балонна дистрофія).
Дистрофії. Жирові паренхіматозні дистрофії. Визначення. Причини. Класифікація. Механізм розвитку. Морфологічна характеристика. Наслідки.
Паренхіматозні жирові дистрофії - це структурні прояви порушення обміну цитоплазматичних ліпідів, які можуть виражатися в накопиченні жиру у вільному стані в клітинах, де він присутній і в нормі,в появі ліпідів там, де вони зазвичай не зустрічаються, і в синтезі жирів незвичайного хімічного складу.
Причини
-
Тканинна гіпоксія
-
Важкі або тривалі за перебігом інфекції
-
Інтоксикації
-
Авітамінози, нераціональне харчування
Класифікація
-
Набуті
-
Спадкові (системні ліпідози)
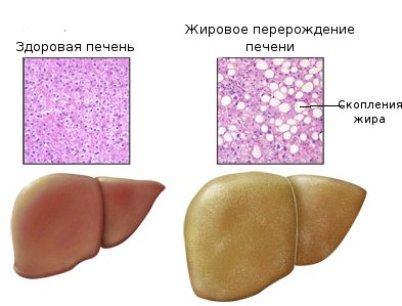
Жирова дистрофія печінки проявляється різким збільшенням вмісту і зміною складу жиру в гепатоцитах. У клітинах печінки спочатку з'являються гранули ліпідів (пиловидне ожиріння), потім дрібні краплі (дрібнокрапельне ожиріння), які в подальшому зливаються у великі краплі (крупнокрапельне ожиріння) або в одну жирову вакуоль, яка заповнює всю цитоплазму і відсуває ядро на периферію. Змінені таким чином печінкові клітини нагадують жирові. Частіше відкладення жиру в печінці починається на периферії, рідше - в центрі часточок; при значно вираженій дистрофії ожиріння клітин печінки має дифузний характер.
Макроскопічно печінка при жировій дистрофії
-
Збільшена
-
Недокрівна
-
Тістоподібної консистенції
-
Має жовтий або охряно-жовтий колір, з жирним блиском на розрізі.
-
При розрізі на лезі ножа і поверхні розрізу видно наліт жиру.
Причини жирової дистрофії печінки:
1) Збільшення мобілізації жиру в жировій тканині, що призводить до збільшення кількості жирних кислот, які досягають печінки, наприклад, при голодуванні і цукровому діабеті;
2) коли швидкість перетворення жирних кислот в тригліцериди в клітині печінки збільшена через підвищену активність відповідних ферментних систем. Це - головний механізм впливу алкоголю, який є потужним стимулятором ферментів.
3) коли зменшене окислення тригліцеридів до ацетил-КоА і кетонових тіл в органах, наприклад, при гіпоксії, і принесений потоком крові і лімфи жир не окислюється - жирова інфільтрація;
4) коли синтез білків-акцепторів жирів недостатній. Таким шляхом виникає жирова дистрофія печінки при білковому голодуванні і при отруєнні деякими гепатотоксинами, наприклад, чотирьоххлористим вуглецем і фосфором.
Типи жирової дистрофії печінки:
a. Гостра жирова дистрофія печінки . При гострій жировій дистрофії печінки тригліцериди накопичуються в цитоплазмі як маленькі, обмежені мембраною вакуолі (дрібнокрапельна жирова дистрофія печінки).
b. Хронічна жирова дистрофія печінки. Може виникати при хронічному алкоголізмі, недоїданні та при отруєнні деякими гепатотоксинами. Жирові краплі в цитоплазмі з'єднуються, формуючи значно більші вакуолі (крупнокрапельна жирова дистрофія печінки).
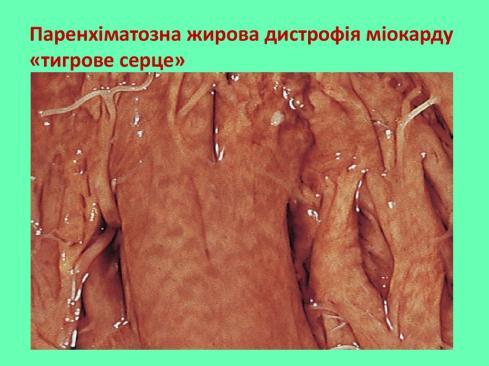
Жирова дистрофія міокарда характеризується накопиченням тригліцеридів в міокарді.
Причини жирової дистрофії міокарда:
- Хронічні гіпоксичні стани, особливо при вираженій анемії. При хронічній жировій дистрофії жовті смуги чергуються з червоно-коричневими ділянками («тигрове серце»). Клінічні ознаки в основному не дуже виражені.
- Токсичне ураження, наприклад, дифтеритический міокардит, викликає гостру жирову дистрофію.
Макроскопічно :
-
серце в'яле
-
дифузне жовте забарвлення
-
серце виглядає збільшеним в обсязі, камери його розтягнуті.
Мікроскопічно:
-
Більшість мітохондрій розпадається
-
поперечна смугастість волокон зникає
-
поява в м'язових клітинах дрібненьких жирових крапель (пиловидне ожиріння). При наростанні змін краплі (дрібнокрапельне ожиріння) повністю заміщають цитоплазму. Процес має вогнищевий характер і спостерігається в групах м'язових клітин, розташованих за ходом венозного коліна капілярів і дрібних вен, частіше субендо-і субепікардіально.
-
ТИГРОВЕ СЕРЦЕ
У нирках при жировій дистрофії
Макроскопічно:
-
вони збільшені
-
в'ялі (при поєднанні з амілоїдозом щільні)
-
кіркова речовина набрякла, сіра з жовтим крапом, помітним на поверхні та розрізі.
Механізм розвитку жирової дистрофії нирок пов'язаний з інфільтрацією епітелію ниркових канальців жиром при ліпемії і гіперхолестеринемії (нефротичний синдром), що веде до загибелі нефроцитів.
Наслідки
-
Залежать від глибини процесу
-
Оборотна якщо вона не супроводжується грубою поломкою клітинних структур
-
Глибоке порушення обміну клітинних ліпідів в більшості випадків закінчується смертю клітини.

Дистрофії. Вуглеводні паренхіматозні дистрофії. Визначення
Причини. Класифікація. Механізм розвитку. Морфологічна характеристика. Наслідки.
Паренхіматозні вуглеводні дистрофії пов'язані з порушенням обміну глікогену чи глікопротеїдів.
Порушення обміну глікогену
Порушення вмісту глікогену проявляється в зменшенні чи збільшенні кількості його в тканинах або появі там, де він звичайно не виявляється. Ці порушення найбільш яскраво виражені при цукровому діабеті і при спадкоємних вуглеводних дистрофіях - глікогенозах.
При цукровому діабеті спостерігають недостатнє вироблення інсуліну, що пов'язують з патологією бета-клітин острівців підшлункової залози. При цьому відбувається недостатнє використання глюкози тканинами, збільшення її вмісту в крові (гіперглікемія) і виведення із сечею (глюкозурія). Тканинні запаси глікогену різко зменшуються. Це в першу чергу стосується печінки, у якій порушується синтез глікогену, що веде до інфільтрації її жирами - розвивається жирова дистрофія печінки, в ядрах гепатоцитів з'являються включення глікогену, вони стають світлими ("порожні" ядра - симптом "дірчастих ядер").
З глюкозурією пов'язані характерні зміни нирок при діабеті. Вони виражаються в глікогенній інфільтрації епітелію канальців, головним чином вузького і дистального сегментів (морфогенетичний механізм - спотворений синтез). Епітелій стає високим, зі світлою пінистою цитоплазмою; зерна глікогену спостерігають у просвіті канальців. Зазначені зміни відбивають стан синтезу глікогену (полімеризація глюкози) у канальцевому епітелії при резорбції багатого глюкозою ультрафільтрату плазми. При діабеті страждають не тільки ниркові канальці, але і капілярні петлі клубочків, базальна мембрана яких стає більш проникливою для цукрів і білків плазми. Виникає один із проявів діабетичної мікроангіопатії - діабетичний гломерулосклероз.
Спадкові вуглеводні дистрофії, в основі яких лежать порушення обміну глікогену, називаються глікогенозами. Глікогенози обумовлені відсутністю чи недостатністю ферменту, що приймає участь у розщепленні депонованого глікогену, і відносяться тому до спадкоємних ферментопатій, чи хворобам накопичення. В даний час гарно вивчені 6 типів глікогенозів, обумовлених спадкоємною недостатністю 6 різних ферментів. Це хвороби Гірке (І тип), Помпе (ІІ тип), Мак-Ардля (V тип) і Герса (VІ тип), при яких структура глікогену, що накопичується в тканинах, не порушена, і хвороби Форбса-Корі (ІІІ тип) і Андерсена (ІV тип), при яких вона різко змінена.
Морфологічна діагностика глікогеноза того чи іншого типу можлива при дослідженні біопсії за допомогою гістоферментних методів, а також з урахуванням локалізації глікогену, що накопичується.
Вуглеводні дистрофії, зв'язані з порушенням обміну глікопротеїдів
При порушенні обміну глікопротеїдів у клітинах чи у міжклітинній речовині відбувається накопичення муцинів і мукоїдів. У зв'язку з цим при порушенні обміну глікопротеїдів говорять про слизову дистрофію.
Мікроскопічна картина: спостерігається накопичення слизу, загибель секретуючих клітин і їхня десквамація; обтурація слизом вивідних проток залоз веде до розвитку кіст. Нерідко в цих випадках приєднується запалення. Слиз може закривати просвіти бронхів, наслідком чого є виникнення ателектазів і осередків пневмонії. Іноді в залозистих структурах накопичується не слиз, а слизеподібні речовини (псевдомуцини). Ці речовини можуть ущільнюватися і приймати характер колоїду. Тоді говорять про колоїдну дистрофію, що спостерігається, наприклад, при колоїдному зобі.
Причини слизової дистрофії різноманітні, але найчастіше це запалення слизових оболонок у результаті дії різних патогенних подразників (катаральне запалення).
Слизова дистрофія лежить в основі спадкоємного системного захворювання муковісцидоза, для якого характерна зміна якості слизу, що виробляється епітелієм слизових залоз: слиз стає густим і в'язким, він погано виводиться, що обумовлює розвиток ретенційних кіст і склерозу (кістозний фіброз). Уражаються екзокринний апарат підшлункової залози, залози бронхіального дерева, травного і сечового тракту, жовчних шляхів, потові і слізні залози.
Для того щоб виявити вуглеводи в клітинахорганізму, проводять специфічний тест - ШИК-реакцію. Суть її в тому, що тканина обробляють йодною кислотою, а потім фуксином. І все альдегіди стають червоними. Якщо потрібно виділити глікоген, то до реактивів додають амилазу. Глікозаміноглікани і глікопротеїди фарбуються метиленовим синім. Паренхіматозні вуглеводні дистрофії пов'язані, як правило, з порушенням обміну глікогену і глікопротеїдів.
Наслідки значною мірою визначаються ступенем і тривалістю підвищеного слизеутворення. В одних випадках регенерація епітелію приводить до повного відновлення слизуватої оболонки, в інших – в ній розвивається атрофія з переходом у склероз, що суттєво влпиває на функцію органа.
Дистрофії. Стромально-судинні дистрофії. Визначення. Причини, класифікація. Механізм розвитку.
Дистрофія (від. грец. dys — порушення і trophe — харчую) — складний патологічний процес, в основі якого лежить порушення тканинного (клітинного) метаболізму, що приводить до структурних змін.
Стромально-судинні (мезенхімальні) дистрофії – структурні прояви порушення обміну речовин в сполучній тканині, що виявляються в стромі органів, стінках судин та розвиваються на території гістіона
Гістіон – структурно-функціональна одиниця сполучної тканини, що
складається з відрізка мікроциркуляторного русла із оточуючими його елементами
Причини:Порушення обміну речовин в сполучній тканині( стромі органів і стінках судин)
(Более подробно причины будут рассмотрены дальше. В других вопросах)
Класифікація
В залежності від виду порушеного обміну мезенхімальні дистрофії поділяються на:
-
Білкові(диспротеїнози)
-
Жирові(ліпідози)
-
Вуглеводні
Механізм розвитку
-
Неадекватне надходження та накопичення продуктів метаболізму, які надходять з кров’яного або лімфатичного русла(інфільтрація)
-
Дезорганізація основної речовини та волокон сполучної тканин (декомпозиція(фанероз))
-
Поява та накопичення аномальних речовин(спотворений синтез)
Дистрофії. Білкові стромально-судинні дистрофії. Визначення, причини, класифікація. Механізм розвитку
Диспротеїнози – структурні прояви порушення обміну білків в сполучній тканині, що виявляються в стромі органів, стінках судин
До стромально-судинних диспротеїнозів відносять мукоїдне, фібрино’їдне набухання, гіаліноз, амілоїдоз.(класифікація)
Досить часто мукоїдне і фібриноїдне набухання та гіаліноз є послідовними стадіями дезорганізації сполучної тканини.
Механізм розвитку:
- накопичення продуктів плазми крові в основній речовині в результаті підвищення тканинної-судинної проникності (плазморагія) (інфільтрація)
- деструкція елементів сполучної тканини і утворення білкових (білково-полісахаридних) комплексів (декомпозиція)
Амілоїдоз утворення аномального фібрилярного білку, що синтезується клітинами амілоїдобластами(спотворений синтез)
Причини: мукоїдне, фібріноідне набухання і гіаліноз: інфекційно-алергі-
чні захворювання, гіпоксія, імунопатологічні процеси, ангіо-
невротичні реакції, ендокринопатії, порушення харчування, генетичні фактори.
Морфогенез стромально-судинних диспротеїнозів представлений на малюнку

Причини амілоїдозу:
Системні амілоїдози:1)Плазмоклітинні дискразії(первинний амілоїдоз. (AL-амілоїд) наприклад, у хворих на мієлому. Також коли причина не з’ясована кажуть про ідіопатичний амілоїдоз), 2)як ускладнення первинного захворювання(хронічні запальні захворювання – наприклад, туберкульоз. Це вторинний або набутий амілоїдоз(АА-амілоїд)), 3)внаслідок тривалого гемодіалізу( амілоїдоз, пов’язаний з гемодіалізом)(Аβ2m-амілоїд), 4)внаслідок тривалого накопичення амілоїдогенних білків(ATTR-амілоїд), які накопичуються у людей старечого віку(Системний старечий амілоїдоз), 5)наявність мутантних генів, які кодують амілоїдогенні білки(Спадковий(сімейнний) амілоїдоз. Наприклад, сімейна середземноморська лихорадка, сімейні нейропатії)
Локальні амілоїдози:1)доброякісні скупчення моноклональних В-клітин або плазматичних клітин, які виробляють легкі ланцюги імуноглобулінів(відкладання AL-амілоїда у органах дихання, шкірі, сечополовій системі),2) ендокринні пухлини(надмірне вироблення білків ендокринними залозами)(ендокринний амілоїдоз),3) накопичення амілоїда(Аβ-білка) у мозку з білків-попередників(старечий церебральний амілоїдоз, хвороба Альцгеймера)
Дистрофія. Білкові стромально-судинні дистрофії. Мукоїдне набухання. Визначення. Механізм розвитку. Морфологічна характеристика. Наслідки.
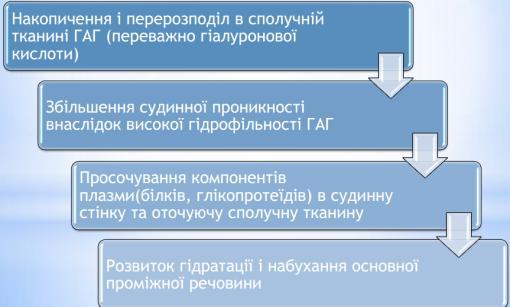
Мукоїдне набухання — поверхнева й оборотна дезорганізація
сполучної тканини.
Механім розвитку:
-
в основній речовині накопичуються і перерозподіляються глікозаміноглікани за рахунок збільшення вмісту гіалуронової кислоти.
-
Глікозаміноглікани мають гідрофільні властивості, і накопичення їх обумовлює підвищення тканинної та судинної проникності.
(ГАГ-глікозамінглікани)
Морфологічна характеристика
При мікроскопічному дослідженні
-
основна речовина базофільна
-
при офарбленні толуїдиновим синім — бузкового або червоного кольору
-
При фарбуванні пікрофуксином колагенові волокна виглядають жовто-помаранчевими, а не цегляно-червоними
-
Виникає феномен метахромазії, в основі якого лежить зміна стану основної проміжної речовини з накопиченням хромотропних речовин.
-
Колагенові волокна зазвичай зберігають пучкову будову, але набухають і піддаються фібрилярному разволокненню. Вони стають малостійкими до впливу колагенази..
-
Мукоїдне набухання частіше в стінках артерій, клапанах серця, ендо- і перикарді, тобто
там, де хромотропні речовини зустрічаються і в нормі;
-
Зовнішній вигляд тканини або органу при мукоїдному набуханні не змінюється(макроскопічно не змінюється); характерні зміни виявляються за допомогою гістохімічних реакцій при мікроскопічному дослідженні.
Наслідки мукоїдного набухання можуть бути різними: повне відновлення тканини або перехід в фібриноїдне набухання. Функція органів при цьому порушується (наприклад, порушення функції
серця при розвитку ревматичного ендокардита — вальвуліта).

Дистрофія. Білкові стромально-судинні дистрофії. Фібриноїдне набухання. Визначення. Механізм розвитку. Морфологічна характеристика. Наслідки.
Фібриноїдне набухання — глибока і необоротна дезорганізація сполучної тканини, в основі якої лежить деструкція її основної речовини і волокон, яка супроводжується різким підвищенням судинної проникності та утворенням фібриноїду.
Механізм розвитку:
-
виражений процес деполімеризації глікозаміногліканів, глибоке порушення судинної проникності, просочування стінки судин не тільки альбумінами і глобулінами, а й фибриногеном плазми (відсюди термін фибриноїдное набухання, фібриноїд).
-
Фібриноїд являє собою складну речовину,
-
входять в фібриноїд білки і полісахариди з колагенових волокон, які розпадаються, основної речовини і плазми крові, нуклеопротеїди. обов’язковим його компонентом є фібрин


Морфологічна характеристика
При мікроскопічному дослідженні :
-
пучки колагенових волокон, які просочені білками крові гомогенні, вони утворюють з фібрином нерозчинні міцні сполуки;
-
стають еозинофільними; пікрофуксином
-
офарблюються в жовтий колір, різко РАS-позитивні та піронінофільні при реакції Браше, а також, аргірофільні при імпрегнації солями срібла.
-
Метахромазія сполучної тканини при цьому не виявляється, або мало виражена як результат деполімеризації глікозаміногліканів основної речовини.
Зовнішній вигляд різних органів і тканин мало змінений
Наслідки:
-
Наслідком фібриноїдних змін бувають некроз, склероз або гіаліноз.
Фібриноїдне набухання приводить до порушення або повного припинення функції органу (гостра ниркова недостатність при злоякісній гіпертонії, при якій буває фібриноїдний некроз і зміни артеріол клубочків).

Дистрофія. Білкові стромально-судинні дистрофії. Гіаліноз.
Визначення. Механізм розвитку. Морфологічна характеристика.
Наслідки.
Гіаліноз - патологічний стан, різновид білкової стромально-судинної дистрофії, який характеризується відкладенням в сполучної тканини і стінки судин щільного гомогенного склоподібного речовини (гіаліну)(нагадує гіаліновий хрящ).
Гіалін - це фібрилярний білок, в якому є не тільки білки плазми, фібрин, а й компоненти імунних комплексів, а також ліпіди.
-
Гіалін стійкий по відношенню до кислот, лугів, ферментам, ШИК-позитивний, пікрофуксином забарвлюється в жовтий або червоний колір, еозином і кислим фуксином - в рожевий.
Класифікація гіалінозу. Розрізняють гіаліноз судин і гіаліноз сполучної тканини; кожен з них може бути загальним і місцевим.
Механізм розвитку:
-
1) деструція волокнистих структур і підвищення тканинно-судинної проник ності (плазморагія) в зв’язку з ангіоневротичними (дисциркуляторними), метаболічними та імунопатологічними процесами.
2)насичування тканин білками плазми і адсорбція їх на змінених волокнистих структурах з послідовною
3)преципітатацією і утворенням білка — гіаліну.
-
Гіаліноз буває наслідком різних процесів: плазматичного просочування, фібриноїдного набухання (фібриноїду), запалення, некрозу, склерозу.
-
Гіаліноз судин розвивається в дрібних артеріях і артеріолах; йому передує пошкодження ендотелію, мембран і гладком’язових клітин стінки і просочування її плазмою крові.
Виділяють 3 види судинного гіаліну:
1) простий, який виникає внаслідок інсудації незмінених або малозмінених компонентів плазми крові (часто зустрічається при гіпертонічній хворобі доброякісного характеру, атеросклерозі та у здорових людей);
2) ліпогіалін, в якому містяться ліпіди і β-ліпопротеїди (виявляється частіше всього при цукровому діабеті);
3) складний гіалін, який побудований з імунних комплексів, фібрину і зруйнованих структур судинної стінки (характерний для хвороб з імунопатологічними порушеннями, наприклад, при ревматичних хворобах).


Гіаліноз сполучної тканини — розвивається внаслідок фібриноїдного набухання, яке призводить до деструкції колагену і насиченню тканини білками плазми і полісахаридами.

Морфологічна характеристика
Зовнішній вигляд органів при гіалінозі змінюється;
-
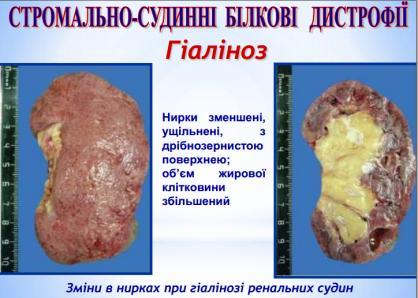
гіаліноз дрібних артерій і артеріол призводить до атрофії, деформації та зменшення органів (артеріолосклеротичний нефроцироз).
-
При гіалінозі сполучної тканини вона стає ущільненою, білуватою, напівпрозорою (наприклад, гіаліноз клапанів серця при ревматичному пороку).
Гіаліноз судин
При мікроскопічному дослідженні
-
гіалін виявляється в субендотеліальному просторі; він відтискує назовні та руйнує еластичну пластину, середня оболонка стає тонкою;
-
в фіналі артеріоли перетворюються на склоподібні трубочки з різко звуженим або повністю закритим просвітом.
-
Гіаліноз дрібних артерій і артеріол носить системний характер. Особливо він характерний длягіпертонічної хвороби і гіпертонічних станів (гіпертонічний артеріологіаліноз), діабетичної мікроангіопатії (діабетичний артеріологіаліноз) і захворювань з порушенням імунітету.
-
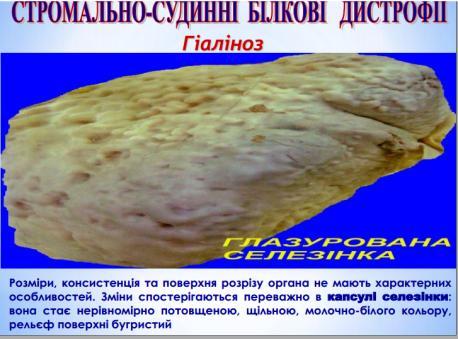
Як фізіологічне явище, місцевий гіаліноз артерій спостерігається в селезінці дорослих і людей похилого віку, відображує функціонально-морфологічні особливості селезінки як органу депонування крові.
Гіаліноз сполучної тканини
При мікроскопічному дослідженні
-
набухання сполучнотканинних пучків; вони втрачають фібрилярність і зливаються в однорідну щільну хрящеподібну масу; клітини здавлюються і атрофуються. (при захворюваннях з імунними порушеннями (ревматичні хвороби)).
-
розвивається, як наслідок склерозу, і як наслідок місцевих хронічних запалень(місцевий гіаліноз)
Наслідок гіалінозу, в основному, несприятливий, але можливе розсмоктування гіалінових мас. Так, гіалін у шрамах — так званих келоїдах — може розсмоктуватися.
-
Гіаліноз молочної залози розсмоктується в умовах її гіперфункції.
-
Функціональне значення гіалінозу різне в залежності від локалізації, ступеню і розповсюдженості.
-
Розповсюджений гіаліноз артеріол призводить до функціональної недостатності органу (ниркова недостатність при артеріолосклеротичному нефроцирозі).
-
Місцевий гіаліноз (наприклад, клапанів серця при його пороках) також може бути причиною функціональної недостатності органу, але в шрамах він не спричиняє особливих розладів.
Дистрофія. Білкові стромально-судинні дистрофії. Амілоїдоз.
Визначення. Механізм розвитку. Морфологічна характеристика.
Наслідки.
Амілоїдоз (від лат. amylum — крохмаль), або амілоїдна дистрофія, — стромально-судинний диспротеїноз, що супроводжується глибоким порушенням білкового обміну, появою аномального фібрилярного білка і утворенням в сполучній тканині та стінках судин складної речовини — амілоїду.
-
Амілоїд - це загальна назва для дуже різнорідної групи
білків, які можуть накопичуватися в стромі(в міжклітинному просторі) внутрішніх органів у вигляді фібрил β-складчастого білка при широкому спектрі захворювань.
-
В основі утворення амілоїду лежить порушення процесу формування вторинної структури білка у позаклітинному просторі.
-
Амілоїд є нерозчинний і стійкий до протеолізу білковий агрегат, що відкладається в тканини.
-
Амілоїд складається з F-компонента(фібрили) і Р-компонента(глікопротеїн – обумовлює стійкість до протеолізу)
Амілоїд утворюється амілоїдобластами

Класифікація амілоїдоза
-
В залежності від причини: первинний(ідіопатичний)(часто через плазматичні дискразії), вторинний(реактивний), спадковий, амілоїдоз похилого віку.