- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с. Предисловие редакторов перевода
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с. Предисловие автора к русскому изданию
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с. Предисловие
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с. Часть I. Как происходит развитие Глава 1. Введение в изучение развития животных
- •Введение
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •12___________________ Глава 1________________________________________________________________________________________________
- •Основные особенности развития
- •Наше эукариотическое наследие
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •16_______________ Глава 1________________________________________________________________________________
- •Развитие одноклеточных эукариот
- •Регуляция морфогенеза при развитии ацетабулярии
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дифференцировка у амебофлагеллятыNaegleria
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Происхождение полового размножения
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Колониальные эукариоты: эволюция дифференцировки
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Пол и смерть уVolvocales
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Слизевик Dictyostelium
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •30________________ Глава 1_______________________________________________________________________________
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Особенности развития разных многоклеточных
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •32________________ Глава 1________________________________________________________________________________
- •Первичноротые и вторичноротые
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Цитированная литература
- •Строение гамет
- •Спермий
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •36________________ Глава 2________________________________________________________________________
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •38________________ Глава 2___________________________
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •40________________ Глава 2______________________________________________________________________________
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Узнавание спермия и яйца: воздействие на расстоянии
- •Привлечение спермиев
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Акросомная реакция
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Узнавание спермия и яйца: контакт между гаметами Видоспецифическое узнавание у морских ежей
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •46 Глава 2
- •Соединение гамет у млекопитающих
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •50________________ Глава 2______________________________________________________________________________
- •Слияние гамет и предотвращение полиспермии Слияние плазматических мембран спермия и ооцита
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Предотвращение полиспермии
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •56________________ Глава 2______________________________________________________________________________
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Слияние генетического материала
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Неравнозначность пронуклеусов у млекопитающих
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Активация метаболизма яйца
- •Ранние реакции
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Поздние реакции
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Биохимия активации яйца
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Преобразования цитоплазмы яйца
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Цитированная литература
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Пространственные закономерности дробления зародыша
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Радиальное голобластическое дробление Морской огурецSynapta
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Морские ежи
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Амфибии
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Спиральное голобластическое дробление
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Адаптация путем изменения процесса дробления зародыша
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Билатеральное голобластическое дробление
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Чередующееся (rotational) голобластическое дробление
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Компактизация
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •90 Глава 3
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Клеточная поверхность и механизм компактизации
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Образование внутренней клеточной массы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Освобождение от прозрачной оболочки
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Близнецы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Меробластические типы дробления
- •Дискоидальное дробление
- •Поверхностное дробление
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Механизмы дробления Инициация дробления
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •102 Глава 3
- •Цитоскелетный механизм митоза
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Образование новых мембран
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Цитированная литература
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гаструляция у морского ежа
- •Выселение первичной мезенхимы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Первая фаза инвагинации
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Вторая фаза инвагинации
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гаструляция у амфибий
- •Движения клеток в период гаструляции у амфибий: обзор
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Детерминация положения бластопора
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Клеточные движения и образование архентерона
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Миграция инволюирующей мезодермы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •128 Глава 4
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Эпиболия эктодермы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •130 Глава 4
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гаструляция у птиц Основные черты гаструляции у птиц
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Механизмы гаструляции у птиц
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •136 Глава 4
- •Гаструляция у млекопитающих
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •138________________ Глава 4
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •140 Глава 4
- •Дополнительные сведения и гипотезы: Функция хориона
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •142 Глава 4
- •Цитированная литература
- •Основные черты развития позвоночных
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Нейруляция
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Нервная трубка и происхождение центральной нервной системы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Механизм формирования нервной трубки
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дифференцировка нервной трубки
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Эволюция развития головного мозга
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Развитие глаза
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дифференцировка хрусталика и роговицы.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Нервный гребень и его производные
- •Пути миграции клеток нервного гребня
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Полипотентность клеток нервного гребня
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Эпидермис и его производные
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •178_______________ Глава 5_______________________________________________________________________________
- •Дополнительные сведения и гипотезы: Тератология
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Цитированная литература
- •Дорсальная мезодерма: дифференцировка сомитов
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Миогенез: дифференцировка скелетной мышцы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Остеогенез: развитие кости
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Мезодерма боковых пластинок
- •Дополнительные сведения и гипотезы: Изоформы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Формирование внезародышевых оболочек
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Сердце и системы кровообращения
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Формирование кровеносных сосудов
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Изменение направления потока крови у новорожденного млекопитающего
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Ангиогенез, индуцированный опухолью
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Развитие клеток крови Полипотентные стволовые клетки и их микроокружение
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Локализация гемопоэза (кроветворения)
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Энтодерма
- •Пищеварительная трубка и ее производные
- •Печень, поджелудочная железа и желчный пузырь
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дыхательная трубка
- •Дополнительные сведения и гипотезы: Тератокарцинома
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с. Оглавление
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Глава 6. Раннее развитие позвоночных.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Часть I. Как происходит развитие 11
- •Глава 1. Введение в изучение развития животных 11
- •Глава 2 Оплодотворение: возникновение нового организма 35
- •Глава 3 Дробление: создание многоклеточности 74
- •Глава 4 Гаструляция: перераспределение клеток 110
- •Глава 5 Раннее развитие позвоночных. Производные эктодермы, их органо- и гистогенез 145
- •Глава 6 Раннее развитие позвоночных. Производные мезодермы и энтодермы, их органо- и гистогенез 186
Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
100
|
|
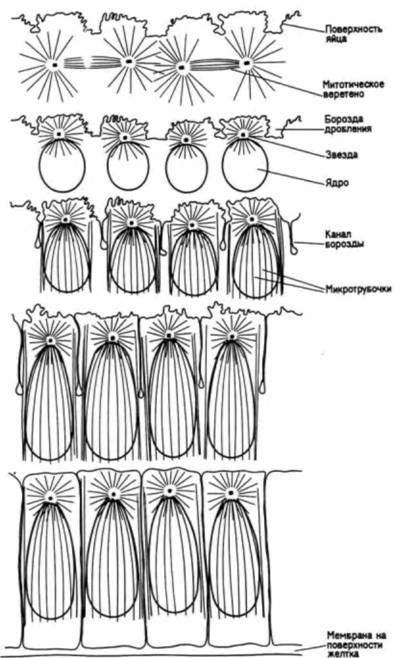
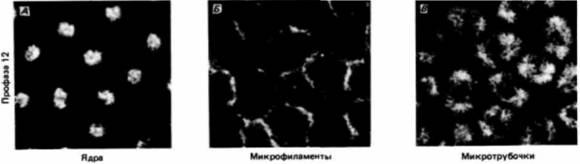
Рис. 3.37. Схематический рисунок, на котором показано удлинение ядер и обособление клеток в бластодерме дрозофилы. (По Fullilove, Jacobson. 1971.) Рис. 3.38. Локализация цитоскелета вокруг ядер в синцитиальной бластодерме дрозофилы. Срезы зародыша дрозофилы, вступающего в профазу двенадцатого деления, были окрашены тремя способами. А. Ядра окрашены красителем, который связывается с ДНК. Б. Микрофиламенты идентифицированы с помощью флуоресцирующих антител к актину. В. Микротрубочки выявлены с помощью флуоресцирующих антител к тубулину. Можно видеть, что вокруг каждого ядра имеется область, включающая цитоскелетные структуры. (Из Karr. Alberts. 1986; фотографии с любезного разрешения Т. L. Karr.) |
|
|
Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
______ ДРОБЛЕНИЕ: СОЗДАНИЕ МНОГОКЛЕТОЧНОСТИ 101
крипции (начинающейся приблизительно на одиннадцатом цикле) сильно возрастает. Замедление ядерных делений и ускорение синтеза РНК у дрозофилы напоминают ситуацию, наблюдающуюся у зародышей лягушки и морского ежа. Контроль за замедлением делений (у зародышей Xenopus, морского ежа и дрозофилы), по-видимому, осуществляется через соотношение между ядром и цитоплазмой (Newport, Kirschner. I982a; Edgar et al., 1986). Эдгар и его соавторы в цитированной работе сравнили раннее развитие зародышей дрозофилы дикого типа с развитием гаплоидных мутантов. Гаплоидные зародыши дрозофилы при каждом клеточном делении содержат вдвое меньше хроматина, чем зародыши дикого типа. Следовательно, гаплоидный зародыш на восьмом клеточном цикле имеет такое же количество хроматина, что и зародыш дикого типа на седьмом цикле. Эти исследователи установили, что тогда как зародыши дикого типа формировали клеточную бластодерму во время 14-го цикла, гаплоидные зародыши для достижения того же результата должны были осуществить еще одно, дополнительное 15-е деление. Более того, продолжительность 11 —14 циклов у зародышей дикого типа соответствовала продолжительности 12—15 циклов у гаплоидных зародышей. Таким образом, ход развития гаплоидных зародышей сходен с ходом развития зародышей дикого типа, отличаясь лишь отставанием на одно клеточное деление.
Если это отставание обусловлено тем, что ядерно-плазменное отношение у гаплоидных мутантов на каждом данном цикле вдвое меньше, чем у зародышей дикого типа, то можно было бы ускорить образование клеточной бластодермы, отшнуровывая (наложением лигатуры) часть цитоплазмы, чтобы гаплоидные ядра делились в меньшем ее объеме. Когда такой опыт был проведен, образование клеточной бластодермы у гаплоидных зародышей ускорилось. Завершающее деление клеток бластодермы, свидетельствующее об окончании периода дробления, у дрозофилы происходит тогда, когда на одно ядро приходится 61 мкм2 цитоплазмы У Xenopus сходное замедление митотических делений наблюдается после 12-го деления. И здесь деления также впоследствии становятся асинхронными. Момент перехода к средней бластуле тоже связан с ядерно-плазменным отношением. Гаплоидные зародыши Xenopus laevis осуществляют этот переход после 13-го митотического цикла, тогда как тетраплоидные зародыши (содержащие вдвое больше хроматина на клетку, чем зародыши дикого типа) приступают к переходу после 11-го деления (Newport, Kirschner, 1982a, b).
Как у дрозофилы, так и у Xenopus laevis транскрипция и подвижность клеток могут быть инициированы преждевременно путем искусственного удлинения клеточного цикла. При задержке клеточных делений циклогексимидом (ингибитор белкового синтеза) переход к средней бластуле у Xenopus laevis индуцируется рано, а у дрозофилы происходит вспышка транскрипции (Edgar et al.. 1986; Kimelman et al.. 1987).