- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с. Предисловие редакторов перевода
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с. Предисловие автора к русскому изданию
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с. Предисловие
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с. Часть I. Как происходит развитие Глава 1. Введение в изучение развития животных
- •Введение
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •12___________________ Глава 1________________________________________________________________________________________________
- •Основные особенности развития
- •Наше эукариотическое наследие
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •16_______________ Глава 1________________________________________________________________________________
- •Развитие одноклеточных эукариот
- •Регуляция морфогенеза при развитии ацетабулярии
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дифференцировка у амебофлагеллятыNaegleria
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Происхождение полового размножения
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Колониальные эукариоты: эволюция дифференцировки
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Пол и смерть уVolvocales
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Слизевик Dictyostelium
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •30________________ Глава 1_______________________________________________________________________________
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Особенности развития разных многоклеточных
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •32________________ Глава 1________________________________________________________________________________
- •Первичноротые и вторичноротые
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Цитированная литература
- •Строение гамет
- •Спермий
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •36________________ Глава 2________________________________________________________________________
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •38________________ Глава 2___________________________
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •40________________ Глава 2______________________________________________________________________________
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Узнавание спермия и яйца: воздействие на расстоянии
- •Привлечение спермиев
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Акросомная реакция
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Узнавание спермия и яйца: контакт между гаметами Видоспецифическое узнавание у морских ежей
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •46 Глава 2
- •Соединение гамет у млекопитающих
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •50________________ Глава 2______________________________________________________________________________
- •Слияние гамет и предотвращение полиспермии Слияние плазматических мембран спермия и ооцита
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Предотвращение полиспермии
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •56________________ Глава 2______________________________________________________________________________
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Слияние генетического материала
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Неравнозначность пронуклеусов у млекопитающих
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Активация метаболизма яйца
- •Ранние реакции
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Поздние реакции
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Биохимия активации яйца
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Преобразования цитоплазмы яйца
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Цитированная литература
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Пространственные закономерности дробления зародыша
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Радиальное голобластическое дробление Морской огурецSynapta
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Морские ежи
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Амфибии
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Спиральное голобластическое дробление
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Адаптация путем изменения процесса дробления зародыша
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Билатеральное голобластическое дробление
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Чередующееся (rotational) голобластическое дробление
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Компактизация
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •90 Глава 3
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Клеточная поверхность и механизм компактизации
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Образование внутренней клеточной массы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Освобождение от прозрачной оболочки
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Близнецы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Меробластические типы дробления
- •Дискоидальное дробление
- •Поверхностное дробление
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Механизмы дробления Инициация дробления
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •102 Глава 3
- •Цитоскелетный механизм митоза
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Образование новых мембран
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Цитированная литература
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гаструляция у морского ежа
- •Выселение первичной мезенхимы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Первая фаза инвагинации
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Вторая фаза инвагинации
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гаструляция у амфибий
- •Движения клеток в период гаструляции у амфибий: обзор
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Детерминация положения бластопора
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Клеточные движения и образование архентерона
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Миграция инволюирующей мезодермы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •128 Глава 4
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Эпиболия эктодермы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •130 Глава 4
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гаструляция у птиц Основные черты гаструляции у птиц
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Механизмы гаструляции у птиц
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •136 Глава 4
- •Гаструляция у млекопитающих
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •138________________ Глава 4
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •140 Глава 4
- •Дополнительные сведения и гипотезы: Функция хориона
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •142 Глава 4
- •Цитированная литература
- •Основные черты развития позвоночных
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Нейруляция
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Нервная трубка и происхождение центральной нервной системы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Механизм формирования нервной трубки
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дифференцировка нервной трубки
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Эволюция развития головного мозга
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Развитие глаза
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дифференцировка хрусталика и роговицы.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Нервный гребень и его производные
- •Пути миграции клеток нервного гребня
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Полипотентность клеток нервного гребня
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Эпидермис и его производные
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •178_______________ Глава 5_______________________________________________________________________________
- •Дополнительные сведения и гипотезы: Тератология
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Цитированная литература
- •Дорсальная мезодерма: дифференцировка сомитов
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Миогенез: дифференцировка скелетной мышцы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Остеогенез: развитие кости
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Мезодерма боковых пластинок
- •Дополнительные сведения и гипотезы: Изоформы
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Формирование внезародышевых оболочек
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Сердце и системы кровообращения
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Формирование кровеносных сосудов
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Изменение направления потока крови у новорожденного млекопитающего
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дополнительные сведения и гипотезы: Ангиогенез, индуцированный опухолью
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Развитие клеток крови Полипотентные стволовые клетки и их микроокружение
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Локализация гемопоэза (кроветворения)
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Энтодерма
- •Пищеварительная трубка и ее производные
- •Печень, поджелудочная железа и желчный пузырь
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Дыхательная трубка
- •Дополнительные сведения и гипотезы: Тератокарцинома
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с. Оглавление
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Глава 6. Раннее развитие позвоночных.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
- •Часть I. Как происходит развитие 11
- •Глава 1. Введение в изучение развития животных 11
- •Глава 2 Оплодотворение: возникновение нового организма 35
- •Глава 3 Дробление: создание многоклеточности 74
- •Глава 4 Гаструляция: перераспределение клеток 110
- •Глава 5 Раннее развитие позвоночных. Производные эктодермы, их органо- и гистогенез 145
- •Глава 6 Раннее развитие позвоночных. Производные мезодермы и энтодермы, их органо- и гистогенез 186
Механизмы дробления Инициация дробления
Клеточный цикл соматических клеток по функциональному признаку делится на четыре стадии (или фазы). За митозом (М) следует пресинтетический период (G1), после которого происходит синтез ДНК (S). Затем наступает премитотический цикл (G2), за которым следует митоз (рис. 3.39.А). Наступление этих фаз регулируется факторами роста, которые будут подробно рассмотрены в гл. 20. Клеточный цикл бластомеров на ранних стадиях дробления может быть, однако, гораздо более простым. Бластомеры у морского ежа на этих стадиях не имеют фазы G1; репликация ДНК осуществляется в телофазе предыдущего митоза (Hinegardner et al., 1964). На тех же стадиях у Xenopus laevis и дрозофилы отсутствуют две фазы, G1 и G2. (У Xenopus laevis эти фазы появляются в клеточном цикле при переходе к средней бластуле после 12-го деления, а у дрозофилы — после 14-го. В обоих случаях это изменение цикла сочетается с увеличением клеточной подвижности и транскрипции РНК.) В течение первых 12 делений клетки Xenopus делятся синхронно и клеточный цикл бывает двухфазным: S-фаза сменяется М-фазой и M фаза —S-фазой (рис. 3.39, Б. Laskey et al., 1977; Newport, Kirschner, 1982a).
Факторы, регулирующие этот двухфазный цикл, локализованы в цитоплазме. В норме преобразования растущих ооцитов Xenopus laevis останавливаются на стадии профазы первого деления мейоза. Такие ооциты неспособны к делению. Когда в них пересаживают ядра делящихся клеток, эти ядра перестают делиться. Нормальные ооциты, подвергнутые стимулирующему воздействию прогестерона, возоб-
|
|
|
Рис. 3.39. Клеточные циклы соматических клеток и бластомеров на ранних стадиях дробления. А. Клеточный цикл типичной соматической клетки. За митозом (М) следует «интерфазное» состояние. Период между митозами подразделяется на фазы G1, S (синтез) и G2. Б. Более простой двухфазный цикл бластомеров амфибий на ранних стадиях дробления, имеющий только две фазы S и M. |
Гилберт с.Биология развития: в 3-х т. Т. I: Пер. С англ. — м.: Мир, 1993. — 228 с.
102 Глава 3
новляют мейотические преобразования, которые идут до стадии метафазы второго деления мейоза и на этой стадии останавливаются. Если в цитоплазму обработанных прогестероном ооцитов помещают ядра неделящихся клеток (например, нейронов), то такие ядра тоже инициируют деление (Gurdon. 1968). В цитоплазме происходят периодические сокращения кортикального слоя (характерные для деления) даже при отсутствии ядер или центриолей. Если в энуклеированные зародыши инъецируют клонированные фрагменты ДНК, то их репликация происходит под контролем этих циклов (Нага et al.. 1980; Harland. Laskey. 1980: Karsenti et al.. 1984). Таким образом, способность клетки к делению регулируется цитоплазмой.
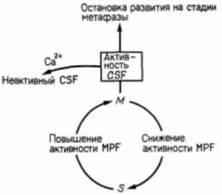
Недавно были выявлены факторы, осуществляющие эту регуляцию. Фактор, индуцируемый прогестероном, который позволяет ооциту возобновить мейоз, представляет собой белок с молекулярной массой 100 000 дальтон: его называют фактором, стимулирующим созревание (maturation promoting factor, MPF). После первого деления мейоза повышается концентрация другого белка цитостатического фактора (cytostatic factor, CSF). что приводит к остановке преобразований ооцита на метафазе второго деления мейоза. Ионы кальция, высвобождающиеся при оплодотворении из эндоплазматического ретикулума. по-видимому, инактивируют CSF, что делает возможным завершение мейоза и слияние пронуклеусов (Meyerhof, Masui. 1977).
Те же самые факторы— MPF, CSF и ионы кальция — важны и после оплодотворения, поскольку они регулируют двухфазный клеточный цикл на ранних стадиях дробления Xenopus. Показано (Gerhart et al.. 1984), что в делящихся клетках уровень активности MPF претерпевает циклические изменения. Активность MPF в бластомерах лягушки на ранних стадиях дробления наивысшая в М-фазе и не выявляется в S-фазе. Такая же цикличность обнаруживается и в энуклеированных бластомерах. Установлено (Newport. Kirschner, 1984), что даже при отсутствии белкового синтеза наступление репликации ДНК (Sфаза) и вступление в митоз (М-фаза) определяются исключительно увеличением и утратой активности MPF. Дробящиеся клетки могут быть блокированы в S-фазе путем инкубации их с ингибитором белкового синтеза. Когда в такие клетки инъецируют MPF, они вступают в М-фазу. Ядерная оболочка этих клеток разрушается, и происходит конденсация хроматина с образованием видимых хромосом. Через 1 ч активность MPF снижается и хромосомы возвращаются к состоянию, характерному для S-фазы. MPF действует, вероятно, путем изменения структуры ядерной оболочки. Через 15 мин после его введения наблюдается гиперфосфорилирование трех ос
|
|
Рис. 3.40. Модель регуляции клеточного цикла бластомеров на ранних стадиях дробления у амфибий В присутствии MPF S-фаза клеточного цикла переходит в М-фазу. Когда активность ΜPF прекращается (в результате его разрушения или функциональной инактивации), совершается переход от М-фазы к S-фазе. CSF стабилизирует MPF, задерживая клетку в М-фазе. Ионы кальция противодействуют эффекту CSF, т.е. они возвращают клетку в фазу S. (По Newport, Kirschner, 1984.) |
новных белков ядерной оболочки. В течение следующих 15 мин оболочка деполимеризуется и разрушается (Miake-Lye, Kirschner, 1985).
Модель регуляции двухфазного клеточного цикла представлена на рис. 3.40. В цитоплазме продолжается образование MPF (либо путем трансляции мРНК для MPF, уже запасенной в клетке, либо путем активации предшественника MPF). MPF побуждает клетку к переходу от S-фазы к M-фазе. Когда MPF инактивируется, клетка возвращается в S-фазу. Таким образом. MPF управляет клеточным циклом. CSF и ионы кальция регулируют работу регулятора, контролируя содержание MPF в клетке. CSF, по-видимому, стабилизирует MPF, удерживая клетку в состоянии митоза. Ионы кальция, инактивируя CSF, тем самым создают возможность инактивации MPF. При добавлении CSF прекращаются также циклические сокращения кортикального слоя цитоплазмы, а последующая инъекция ионов кальция снова их стимулирует. Таким образом, на ранних стадиях развития цитоплазма определяет скорость клеточных делений и продолжительность S- и М-фаз цикла.