
- •Глава 1. Загальні положення. Класифікація гравіметричних методів
- •Метод виділення
- •Метод відгонки
- •Методи осадження
- •Вимоги до осадженої форми
- •Вимоги до гравіметричної форми
- •Вимоги до осаджувача
- •Умови осадження кристалічних осадів
- •Умови осадження аморфних осадів
- •Послідовність аналітичних операцій в гравіметричному методі осадження
- •Практична робота розрахунок величини наважки в гравіметричному аналізі
- •Приклади розв'язування задач
- •Задачі для самостійної роботи
- •Практична робота розрахунок кількості осаджувача
- •Приклад розв'язування задач
- •Задачі до самостійної роботи
- •Практична робота розрахунок результатів аналізу в гравіметрії
- •Приклади розв'язування задач
- •Задачі до самостійної роботи
- •Лабораторна робота визначення масової частки кристалізаційної води в кристалогідраті
- •План експерименту:
- •Лабораторна робота визначення масової частки сульфат-іонів у магній сульфаті гравіметричним методом осадження
- •План експерименту:
- •Лабораторна робота визначення масової частки феруму в кристалогідраті ферум(іі) сульфату
- •План експерименту:
- •Контрольні питання:
- •Глава 2. Основні положення титриметричного аналізу
- •Вимоги до реакцій у титриметричному аналізі
- •Класифікація методів титриметрії в залежності від типу реакції
- •Класифікація методів титриметрії за способом титрування
- •Способи приготування стандартних розчинів
- •1. Приготування первинних стандартних розчинів
- •2. Приготування вторинних стандартних розчинів
- •3. Приготування стандартних розчинів із фіксаналів
- •Глава 3. Розрахунки в титриметричному аналізі
- •3.1. Способи виразу вмісту речовин у розчинах
- •3.2. Розрахункові формули титриметрії
- •Глава 4. Метод кислотно–основного титрування
- •4.1. Теоретичні основи методу
- •Індикатори методу кислотно-основного титрування
- •Показник індикаторів рК, показник титрування рН
- •Класифікація індикаторів
- •Криві титрування
- •1. Титрування сильних кислот сильними основами (Рис 1.)
- •2.Титрування слабких основ сильними кислотами. (Рис 2.)
- •3. Титрування слабких кислот сильними основами. (Рис 3.)
- •4. Титрування слабких кислот слабкими основами.
- •5. Титрування багатоосновних кислот (Рис 4.)
- •Кислотно-основне титрування в неводних середовищах
- •Робочі розчини у методах неводного титрування
- •Практичне використання методів кислотно-основного титрування в аналізі фармацевтичних препаратів
- •Практична робота способи виразу вмісту речовин у розчинах
- •Приклади розв’язання задач
- •Задачі для самостійної роботи
- •Рішення:
- •І Метод окремих наважок
- •Використаний прийом – метод окремих наважок.
- •Розв’язання задачі
- •Задачі для аудиторної роботи
- •Індивідуальні завдання для самостійної роботи студентів з теми «Метод кислотно-основного титрування»
- •Лабораторна робота калібрування мірного посуду. Визначення вмісту піпетки
- •План експерименту
- •Розрахунок маси наважки натрій гідроксиду
- •Взяття наважки лугу
- •Приготування розчину лугу
- •Приготування робочого розчину лугу
- •Висновок лабораторна робота аналіз мінеральної кислоти
- •Хімізм процесу
- •План експерименту
- •Зважувати концентровані кислоти треба в скляному бюксі із закритою кришкою і дуже обережно!!!
- •Лабораторна робота приготування і стандартизація розчину хлоридної кислоти
- •Хімізм процесу
- •План експерименту
- •II. Приготування розчину первинного стандарту натрій тетраборату
- •III. Стандартизація розчину хлоридної кислоти
- •IV. Висновок.
- •Визначення масової частки натрій карбонату у препараті проводять за II-ю точкою еквівалентності План експерименту
- •Лабораторна робота визначення вмісту аніліну в досліджуваному зразку
- •Хімізм процесу
- •План експерименту
- •Глава 5. Методи окисно-відновного титрування
- •5.1. Теоретичні основи методу
- •Окисно-відновні індикатори
- •5.2. Перманганатометрія
- •Приготування розчину kMnO4
- •Стандартизація розчину kMnO4
- •Задачі для самостійної роботи
- •Лабораторна робота приготування та стандартизація розчину калій перманганату
- •Хімізм процесу
- •План експерименту
- •IV. Висновок.
- •Лабораторна робота
- •Визначення вмісту гідроген пероксиду
- •В лікарському препараті
- •Хімізм процесу
- •План експерименту
- •Лабораторна робота
- •Гептагідраті методом перманганатометрії
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •5.3. Хроматометрія
- •Лабораторна робота аналіз солі Fе(II) методом хроматометрії
- •Хімізм процесу
- •План експерименту
- •5.4. Цериметрія
- •5.5. Йодометрія
- •Приготування розчину Na2s2o3
- •Приготування розчину і2
- •Використання методу
- •Лабораторна робота приготування та стандартизація робочого розчину натрій тіосульфату
- •Хімізм процесу
- •План експерименту
- •IV. Висновок. Лабораторна робота приготування та стандартизація розчину йоду
- •Хімізм процесу
- •План експерименту
- •IV. Висновок
- •План експерименту
- •V. Висновок.
- •План експерименту
- •Лабораторна робота аналіз аскорбінової кислоти методом йодометрії
- •Аскорбінова кислота
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Завдання для самостійної роботи
- •5.6. Броматометрія
- •Лабораторна робота визначення вмісту стрептоциду в препараті методом броматометрії
- •Хімізм процесу
- •Принцип методу заміщення
- •План експерименту
- •Контрольні питання
- •Завдання для самостійної роботи
- •5.7. Нітритометрія
- •Умови проведення реакції діазотування
- •Визначення точки еквівалентності
- •Лабораторна робота приготування та стандартизація робочого розчину натрій нітриту
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Завдання до самостійної роботи
- •Глава 7. Методи осаджувального титрування
- •7.1. Теоретичні основи методу
- •Класифікація методів осадження
- •Вимоги до реакцій, що використовуються в методах осадження
- •Індикатори методів осадження
- •5.2. Аргентометрія
- •Метод Мора
- •Умови титрування за методом Фаянса–Ходакова
- •6.3. Тіоціанатометрія Метод Фольгарда
- •Умови титрування за методом Фольгарда
- •6.4. Меркурометрія
- •Приготування та стандартизація розчину титранту
- •Переваги та недоліки меркурометрії перед іншими методами осадження
- •Завдання для самостійної роботи
- •План експерименту
- •Лабораторна робота визначення масової частки калій йодиду методом фольгарда
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Глава 7. Методи комплексоутворення
- •7.1. Теоретичні основи методу
- •7.2. Комплексонометрія (трилонометрія)
- •Принцип дії металохромних індикаторів
- •7.3. Меркуриметрія
- •Задачі для самостійної роботи
- •Лабораторна робота приготування і стандартизація розчину комплексону ііі (трилону б, едта)
- •Хімізм процесу
- •План експерименту
- •III. Стандартизація титранту комплексону ііі.
- •Висновок.
- •Лабораторна робота
- •Аналіз кальцій хлориду гексагідрату
- •Комплексонометричним методом
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Глава 8. Оптичні методи аналізу
- •8.1. Абсорбційні методи аналізу
- •8.1.1. Теоретичні основи
- •Основний закон світлопоглинання (закон Бугера - Ламберта-Бера)
- •Апаратура молекулярно-абсорбційних методів
- •Характеристика та функціональне призначення основних вузлів фотоколориметра
- •Методика вимірювання оптичної густини на фотоколориметрі
- •Основні прийоми обробки аналітичного сигналу при фотометричних визначеннях
- •Контрольні питання
- •Задачі для самостійної роботи
- •Лабораторна робота визначення молярної концентрації іонів феруму (ііі) у розчині методом градуювального графіку
- •План експерименту
- •8.2. Рефрактометричний метод аналізу
- •8.2.1. Теоретичні основи методу
- •Апаратура рефрактометрії
- •Контрольні питання до теми:
- •8.3. Поляриметричний метод аналізу
- •8.3.1.Теоретичні основи методу
- •Основне рівняння поляриметричного методу аналізу
- •Апаратурне оснащення поляриметричного методу
- •Застосування поляриметричного методу аналізу
- •Лабораторна робота ідентифікація речовини за величиною питомого обертання
- •План експерименту
- •Контрольні питання
- •Глава 9. Хроматографічні методи аналізу
- •9.1. Теоретичні основи методу
- •Класифікація хроматографічних методів
- •9.2. Хроматографія в тонкому шарі сорбенту (тонкошарова хроматографія)
- •Етапи проведення аналізу методом тшх
- •6 . Проведення кількісного аналізу
- •Якісний аналіз барвників у суміші методом тонкошарової хроматографії
- •План експерименту
- •9.3. Іонообмінна хроматографія
- •Лабораторна робота визначення концентрації натрій хлориду методом іонообмінної хроматографії
- •План експерименту
- •Додатки
- •Класифікація методів кількісного аналізу
- •Класифікація титриметричних методів аналізу за типом хімічної реакції, яка лежить в основі методу
- •Класифікація титриметричних методів аналізу за способом титрування
- •Кислотно-основне титрування
- •Методи окисно-відновного титрування
- •Перманганатометричне титрування
- •Йодометричне титрування
- •Нітритометричне титрування
- •Броматометричне титрування
- •Цериметричне титрування
- •Хроматометричне титрування
- •Аргентометричне титрування
- •Тіоціанатометричне титрування (за методом Фольгарда)
- •Меркурометричне титрування
- •Комплексонометричне титрування
- •Меркуриметричне титрування
- •Список цитованої літератури
- •Глава 1. Загальні положення. Класифікація гравіметричних методів ….…4
- •Глава 2. Основні положення титриметричного аналізу …………………...…30
- •Глава 3. Розрахунки в титриметричному аналізі
- •Глава 4. Метод кислотно – основного титрування
- •Глава 5. Методи окисно-відновного титрування
- •Глава 6. Методи осаджувального титрування
- •Глава 7. Методи комплексоноутворення
- •7.1. Теоретичні основи методу……………………………………………..…173
- •Глава 8. Оптичні методи аналізу
- •Глава 9. Хроматографічні методи аналізу
Принцип дії металохромних індикаторів
Схематично індикатор можна представити: H2Ind- F 2H+ + Ind2-.
1. При внесенні індикатору в досліджуваний розчин утворюється забарвлена комплексна сполука між Me2+ та Ind2-, менш стійка, ніж комплекс Me2+ з трилоном Б. Забарвлення комплексу MeInd відрізняється від забарвлення вільного індикатору. Наприклад, при використанні індикатору еріохрому чорного Т:
Me2+ + Н2Ind F [MeInd] + 2Н+
синій винно-червоний
2. В процесі титрування вільні катіони металу утворюють комплексну сполуку з титрантом MeR2-
Me2+ + H2R2- F [MeR]2- + 2H+
3. Поблизу точки еквівалентності починає руйнуватися забарвлений комплекс катіонів металу та індикатору, тому що вільних катіонів металу вже немає в розчині:
[MeInd] + H2R2- F [MeR]2- + Н2Ind
винно-червоний синій
При досягненні точки еквівалентності розчин набуває забарвлення вільного індикатору.
Зміна кольору найбільш чітко спостерігається при рН = 810, тому титрують в присутності буферної суміші (NH3·H2O + NH4Cl), який зв’язує Гідроген-іони, що утворюються в результаті реакції (Н+ + NH3 F NH4+).
Метод комплексонометрії широко застосовується при визначенні багатьох катіонів у залежності від стійкості координаційних сполук з титрантом та індикатором, а також від інших особливостей системи, що реагує. Використовують пряме, зворотне та замісникове титрування.
Методом прямого титрування з різними індикаторами визначають Mg2+, Ca2+, Zn2+, Cd2+, Pb2+, Co2+, Ni2+, Cu2+, Fe3+ та інші при певному значенні рН розчину.
Методом зворотного титрування визначають Hg2+, Al3+, Cr3+ та інші катіони, які за завичайних умов повільно реагують з ЕДТА. У таких випадках до розчину, що аналізують, додають надлишок розчину ЕДТА, залишок якого відтитровують розчином солі магнію або цинку у присутності індикатору еріохрому чорного Т.
Замісникове титрування застосовують при визначенні катіонів, які утворюють стійкі комплекси з еріохромом чорним Т, при цьому блокується індикатор. Це такі іони, як Hg2+, Cu2+ та інші. При аналізі цих іонів до досліджуваного розчину додають розчин магній едетату у надлишку. Магній, який виділився в результаті реакції, титрують стандартним розчином ЕДТА.
7.3. Меркуриметрія
Метод заснований на утворенні стійких комплексних сполук при взаємодії розчину Hg2+ з Cl-, Br-, I-, CN-, NCS-- іонами:
Hg2+ + 2Cl- F [HgCl2]
Титрант методу – 0,1 М розчин меркурій(ІІ) нітрату, який готують як вторинний стандартний розчин з подальшою стандартизацією за NaCl (х.ч.) або КCl (х.ч.).
Індикаторами методу меркуриметрії є:
а) розчин натрій нітропрусиду, який утворює з Hg2+-іонами осад білого кольору:
Hg2+
+ [Fe(CN)5NO]2-
F
Hg[Fe(CN)5NO]↓ К![]() = 1,0·10-9
= 1,0·10-9
Суттєвою перевагою цього індикатору є можливість прямого визначення хлоридів у сильнокислому середовищі.
б) розчин дифенілкарбазиду (1) та продукт його окиснення –дифенілкарбазон (2):
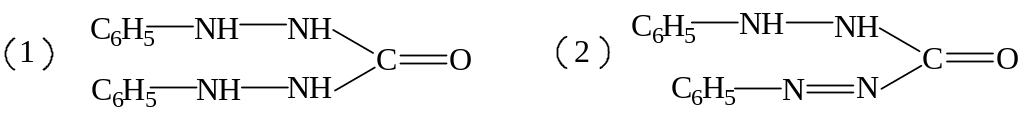
Ці речовини є слабкими кислотами і поводять себе в розчині як кислотно-основні індикатори. Наприклад, у розчині дифенілкарбазону існує рівновага:
 або
схематично:
або
схематично:
НДФК F ДФК- + Н+,
де ДФК – аніон дифенілкарбазиду.
Іони Hg2+ у нейтральному або слабокислому середовищі утворюють з цим індикатором сполуку, синє-фіолетового кольору:
Hg2+ + 2НДФК F Hg(ДФК)2 + 2Н+
Приблизно такі ж рівноваги існують і в розчині дифенілкарбазону. Титрування з цим індикатором виконують при рН = 1,5 – 2,0.
в) при визначенні І--іонів використовується безіндикаторне титрування до появи каламуті рожевого кольору в кінцевій точці титрування.
![]() F
F![]()
![]() F
F![]()

![]()
Надлишкова
крапля меркурій (ІІ) нітрату реагує з
комплексним іоном
з виділенням осаду
![]() рожево-оранжевого кольору:
рожево-оранжевого кольору:
![]()
Меркуриметричний метод аналізу частіше за все застосовують при визначенні хлорид-іонів. Також цим методом визначають броміди, йодиди, ціаніди, тіоціанати, іони Hg2+; можливо розтитрувати суміш галогенідів в одній пробі. На результати аналізу не впливає присутність інших іонів, крім того, сполуки Hg2+-іона легко регенеруються. Але необхідно пам’ятати, що титрант методу – це токсична, отруйна речовина.
ПРАКТИЧНА РОБОТА
РОЗРАХУНКИ ЗА РЕЗУЛЬТАТАМИ
КОМПЛЕКСОНОМЕТРИЧНОГО МЕТОДУ АНАЛІЗУ
Мета: навчитись проводити розрахунки, які використовуються при проведенні аналізу методом комплексонометрії.
Приклади розв’язання задач
Приклад 1. Розчин, що містить солі Кальцію та Магнію розбавили в мірній колбі водою до 200,0 см3. На титрування 10,00 см3 одержаного розчину з еріохромом чорним Т витратили 9,23 см3 розчину ЕДТА з молярною концентрацією еквіваленту 0,1018 моль/дм3, а на титрування 10,00 см3 цього ж розчину з мурексидом витратили 4,15 см3 розчину ЕДТА. Обчислити маси Са2+ і Мg2+, що містилися у вихідному розчині.
Дано: Vм.к. = 200 см3 Vр-ну = 10,00 см3 V1(ЕДТА) = 9,23 см3 V2 (ЕДТА) = 4,15 см3 с(ЕДТА)=0,1018 моль/дм3 |
Рішення: При титруванні з еріохромом чорним Т до реакції з ЕДТА вступають Са2+ і Мg2+, а при титруванні з мурексидом тільки Са2+. Тому можна обчислити об’єм ЕДТА, витрачений на титрування Мg2+ (V3): V3(ЕДТА) = V1(ЕДТА) – V2(ЕДТА) V3(ЕДТА) = 9,23 – 4,15 = 5,08 (см3)
Відповідь: m(Ca2+) = 0,3387 г; m(Мg2+) = 0,2514 г |
m(Ca) – ? m(Мg) – ?
|
Приклад 2. При аналізі каоліну його наважку масою 0,5108 г сплавили з Na2CO3 та Na2B4O7. Сплав розчинили у розведеній хлоридній кислоті та довели об'єм розчину до 250,0 см3. Аліквотну частину цього розчину об'ємом 100,0 см3 нейтралізували, додали уротропін, відфільтрували силікатну кислоту, що випала до осаду, промили теплим розчином уротропіну; фільтрат і промивні води відтитрували розчином ЕДТА з молярною концентрацією еквіваленту 0,005040 моль/дм3 у присутності індигокарміну та 20 % КОН. Об'єм, що витратили на титрування, дорівнює 10,16 см3. Обчислити масову частку (%) СаО у каоліні.
Дано: mн.(каоліну) = 0,5108 г Vм.к. = 250,0 см3 Vр-ну = 100,0 см3 V(ЕДТА) = 10,16 см3 с(ЕДТА)=0,005040 моль/дм3 W(CaО) – ? |
Рішення:
|


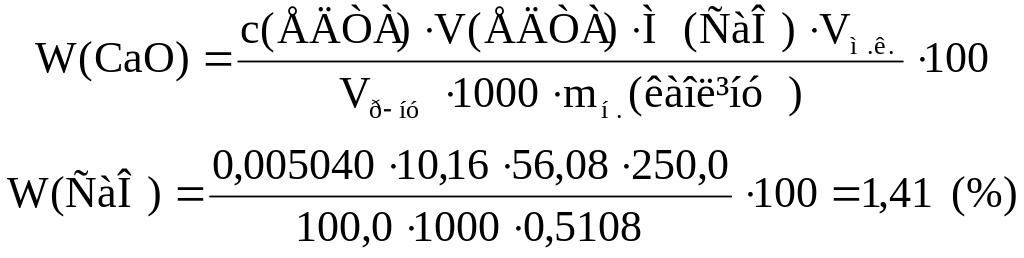 Відповідь:
W(CaО)
= 1,41 %
Відповідь:
W(CaО)
= 1,41 %