
- •Глава 1. Загальні положення. Класифікація гравіметричних методів
- •Метод виділення
- •Метод відгонки
- •Методи осадження
- •Вимоги до осадженої форми
- •Вимоги до гравіметричної форми
- •Вимоги до осаджувача
- •Умови осадження кристалічних осадів
- •Умови осадження аморфних осадів
- •Послідовність аналітичних операцій в гравіметричному методі осадження
- •Практична робота розрахунок величини наважки в гравіметричному аналізі
- •Приклади розв'язування задач
- •Задачі для самостійної роботи
- •Практична робота розрахунок кількості осаджувача
- •Приклад розв'язування задач
- •Задачі до самостійної роботи
- •Практична робота розрахунок результатів аналізу в гравіметрії
- •Приклади розв'язування задач
- •Задачі до самостійної роботи
- •Лабораторна робота визначення масової частки кристалізаційної води в кристалогідраті
- •План експерименту:
- •Лабораторна робота визначення масової частки сульфат-іонів у магній сульфаті гравіметричним методом осадження
- •План експерименту:
- •Лабораторна робота визначення масової частки феруму в кристалогідраті ферум(іі) сульфату
- •План експерименту:
- •Контрольні питання:
- •Глава 2. Основні положення титриметричного аналізу
- •Вимоги до реакцій у титриметричному аналізі
- •Класифікація методів титриметрії в залежності від типу реакції
- •Класифікація методів титриметрії за способом титрування
- •Способи приготування стандартних розчинів
- •1. Приготування первинних стандартних розчинів
- •2. Приготування вторинних стандартних розчинів
- •3. Приготування стандартних розчинів із фіксаналів
- •Глава 3. Розрахунки в титриметричному аналізі
- •3.1. Способи виразу вмісту речовин у розчинах
- •3.2. Розрахункові формули титриметрії
- •Глава 4. Метод кислотно–основного титрування
- •4.1. Теоретичні основи методу
- •Індикатори методу кислотно-основного титрування
- •Показник індикаторів рК, показник титрування рН
- •Класифікація індикаторів
- •Криві титрування
- •1. Титрування сильних кислот сильними основами (Рис 1.)
- •2.Титрування слабких основ сильними кислотами. (Рис 2.)
- •3. Титрування слабких кислот сильними основами. (Рис 3.)
- •4. Титрування слабких кислот слабкими основами.
- •5. Титрування багатоосновних кислот (Рис 4.)
- •Кислотно-основне титрування в неводних середовищах
- •Робочі розчини у методах неводного титрування
- •Практичне використання методів кислотно-основного титрування в аналізі фармацевтичних препаратів
- •Практична робота способи виразу вмісту речовин у розчинах
- •Приклади розв’язання задач
- •Задачі для самостійної роботи
- •Рішення:
- •І Метод окремих наважок
- •Використаний прийом – метод окремих наважок.
- •Розв’язання задачі
- •Задачі для аудиторної роботи
- •Індивідуальні завдання для самостійної роботи студентів з теми «Метод кислотно-основного титрування»
- •Лабораторна робота калібрування мірного посуду. Визначення вмісту піпетки
- •План експерименту
- •Розрахунок маси наважки натрій гідроксиду
- •Взяття наважки лугу
- •Приготування розчину лугу
- •Приготування робочого розчину лугу
- •Висновок лабораторна робота аналіз мінеральної кислоти
- •Хімізм процесу
- •План експерименту
- •Зважувати концентровані кислоти треба в скляному бюксі із закритою кришкою і дуже обережно!!!
- •Лабораторна робота приготування і стандартизація розчину хлоридної кислоти
- •Хімізм процесу
- •План експерименту
- •II. Приготування розчину первинного стандарту натрій тетраборату
- •III. Стандартизація розчину хлоридної кислоти
- •IV. Висновок.
- •Визначення масової частки натрій карбонату у препараті проводять за II-ю точкою еквівалентності План експерименту
- •Лабораторна робота визначення вмісту аніліну в досліджуваному зразку
- •Хімізм процесу
- •План експерименту
- •Глава 5. Методи окисно-відновного титрування
- •5.1. Теоретичні основи методу
- •Окисно-відновні індикатори
- •5.2. Перманганатометрія
- •Приготування розчину kMnO4
- •Стандартизація розчину kMnO4
- •Задачі для самостійної роботи
- •Лабораторна робота приготування та стандартизація розчину калій перманганату
- •Хімізм процесу
- •План експерименту
- •IV. Висновок.
- •Лабораторна робота
- •Визначення вмісту гідроген пероксиду
- •В лікарському препараті
- •Хімізм процесу
- •План експерименту
- •Лабораторна робота
- •Гептагідраті методом перманганатометрії
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •5.3. Хроматометрія
- •Лабораторна робота аналіз солі Fе(II) методом хроматометрії
- •Хімізм процесу
- •План експерименту
- •5.4. Цериметрія
- •5.5. Йодометрія
- •Приготування розчину Na2s2o3
- •Приготування розчину і2
- •Використання методу
- •Лабораторна робота приготування та стандартизація робочого розчину натрій тіосульфату
- •Хімізм процесу
- •План експерименту
- •IV. Висновок. Лабораторна робота приготування та стандартизація розчину йоду
- •Хімізм процесу
- •План експерименту
- •IV. Висновок
- •План експерименту
- •V. Висновок.
- •План експерименту
- •Лабораторна робота аналіз аскорбінової кислоти методом йодометрії
- •Аскорбінова кислота
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Завдання для самостійної роботи
- •5.6. Броматометрія
- •Лабораторна робота визначення вмісту стрептоциду в препараті методом броматометрії
- •Хімізм процесу
- •Принцип методу заміщення
- •План експерименту
- •Контрольні питання
- •Завдання для самостійної роботи
- •5.7. Нітритометрія
- •Умови проведення реакції діазотування
- •Визначення точки еквівалентності
- •Лабораторна робота приготування та стандартизація робочого розчину натрій нітриту
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Завдання до самостійної роботи
- •Глава 7. Методи осаджувального титрування
- •7.1. Теоретичні основи методу
- •Класифікація методів осадження
- •Вимоги до реакцій, що використовуються в методах осадження
- •Індикатори методів осадження
- •5.2. Аргентометрія
- •Метод Мора
- •Умови титрування за методом Фаянса–Ходакова
- •6.3. Тіоціанатометрія Метод Фольгарда
- •Умови титрування за методом Фольгарда
- •6.4. Меркурометрія
- •Приготування та стандартизація розчину титранту
- •Переваги та недоліки меркурометрії перед іншими методами осадження
- •Завдання для самостійної роботи
- •План експерименту
- •Лабораторна робота визначення масової частки калій йодиду методом фольгарда
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Глава 7. Методи комплексоутворення
- •7.1. Теоретичні основи методу
- •7.2. Комплексонометрія (трилонометрія)
- •Принцип дії металохромних індикаторів
- •7.3. Меркуриметрія
- •Задачі для самостійної роботи
- •Лабораторна робота приготування і стандартизація розчину комплексону ііі (трилону б, едта)
- •Хімізм процесу
- •План експерименту
- •III. Стандартизація титранту комплексону ііі.
- •Висновок.
- •Лабораторна робота
- •Аналіз кальцій хлориду гексагідрату
- •Комплексонометричним методом
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Глава 8. Оптичні методи аналізу
- •8.1. Абсорбційні методи аналізу
- •8.1.1. Теоретичні основи
- •Основний закон світлопоглинання (закон Бугера - Ламберта-Бера)
- •Апаратура молекулярно-абсорбційних методів
- •Характеристика та функціональне призначення основних вузлів фотоколориметра
- •Методика вимірювання оптичної густини на фотоколориметрі
- •Основні прийоми обробки аналітичного сигналу при фотометричних визначеннях
- •Контрольні питання
- •Задачі для самостійної роботи
- •Лабораторна робота визначення молярної концентрації іонів феруму (ііі) у розчині методом градуювального графіку
- •План експерименту
- •8.2. Рефрактометричний метод аналізу
- •8.2.1. Теоретичні основи методу
- •Апаратура рефрактометрії
- •Контрольні питання до теми:
- •8.3. Поляриметричний метод аналізу
- •8.3.1.Теоретичні основи методу
- •Основне рівняння поляриметричного методу аналізу
- •Апаратурне оснащення поляриметричного методу
- •Застосування поляриметричного методу аналізу
- •Лабораторна робота ідентифікація речовини за величиною питомого обертання
- •План експерименту
- •Контрольні питання
- •Глава 9. Хроматографічні методи аналізу
- •9.1. Теоретичні основи методу
- •Класифікація хроматографічних методів
- •9.2. Хроматографія в тонкому шарі сорбенту (тонкошарова хроматографія)
- •Етапи проведення аналізу методом тшх
- •6 . Проведення кількісного аналізу
- •Якісний аналіз барвників у суміші методом тонкошарової хроматографії
- •План експерименту
- •9.3. Іонообмінна хроматографія
- •Лабораторна робота визначення концентрації натрій хлориду методом іонообмінної хроматографії
- •План експерименту
- •Додатки
- •Класифікація методів кількісного аналізу
- •Класифікація титриметричних методів аналізу за типом хімічної реакції, яка лежить в основі методу
- •Класифікація титриметричних методів аналізу за способом титрування
- •Кислотно-основне титрування
- •Методи окисно-відновного титрування
- •Перманганатометричне титрування
- •Йодометричне титрування
- •Нітритометричне титрування
- •Броматометричне титрування
- •Цериметричне титрування
- •Хроматометричне титрування
- •Аргентометричне титрування
- •Тіоціанатометричне титрування (за методом Фольгарда)
- •Меркурометричне титрування
- •Комплексонометричне титрування
- •Меркуриметричне титрування
- •Список цитованої літератури
- •Глава 1. Загальні положення. Класифікація гравіметричних методів ….…4
- •Глава 2. Основні положення титриметричного аналізу …………………...…30
- •Глава 3. Розрахунки в титриметричному аналізі
- •Глава 4. Метод кислотно – основного титрування
- •Глава 5. Методи окисно-відновного титрування
- •Глава 6. Методи осаджувального титрування
- •Глава 7. Методи комплексоноутворення
- •7.1. Теоретичні основи методу……………………………………………..…173
- •Глава 8. Оптичні методи аналізу
- •Глава 9. Хроматографічні методи аналізу
Лабораторна робота
Аналіз кальцій хлориду гексагідрату
Комплексонометричним методом
Мета: закріпити навички використання методу комплексонометрії в аналізі речовин.
Сутність методу: точну наважку кальцій хлориду кристалогідрату розчиняють у дистильованій воді та відтитровують стандартним розчином ЕДТА у присутності металохромного індикатору кислотного хром темно-синього та амоніачного буферного розчину.
Аналітичні прийоми: метод прямого титрування, метод окремих наважок.
Хімізм процесу
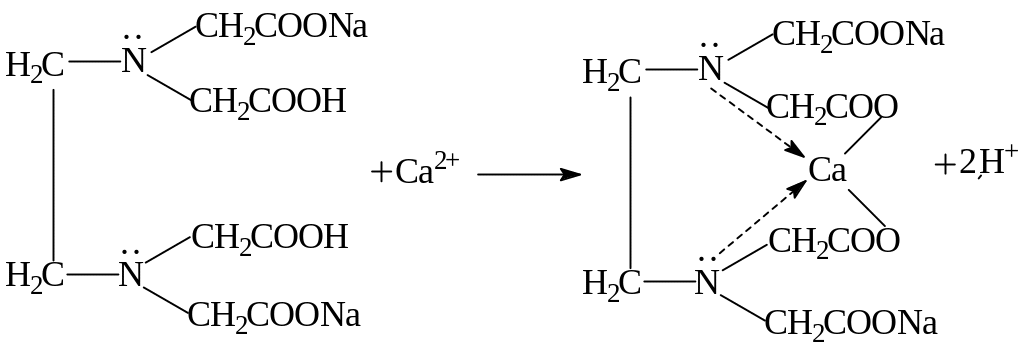
.2H+ + 2NH3 = 2NH pH = 11,9
М(CaCl2·6H2O) = 219,08 г/моль; fекв=1
План експерименту
Розрахунок маси наважки кальцій хлориду гексагідрату.
![]() ,
г.
,
г.
Вихідні дані: с(ЕДТА)=0,05 моль/дм³; Vmin(ЕДТА)~15 см³
![]() (г)
(г)
Зважування наважки 0,2 г солі в бюксі на аналітичних терезах
Результати зважування занести в лабораторний журнал:
1) mб з н = 2) mб з н = 3) mб з н =
mб = mб = mб =
mн. = mн. = mн. =
Розчинення наважки та підготовка до титрування:
Наважку солі розчинити у довільному об’ємі води дистильованої в конічній колбі, додати 10-15 см³ амоніачного буферного розчину, розвести дистильованою водою до ~ 100 см³. Додати індикатор кислотний хром темно-синій.
Процес титрування.
Дослідний розчин титрувати стандартним розчином ЕДТА до переходу забарвлення від червоного до синього.
Результати титрування занести у таблицю:
-
1
2
3
mн.(CaCl2·6H2O), г
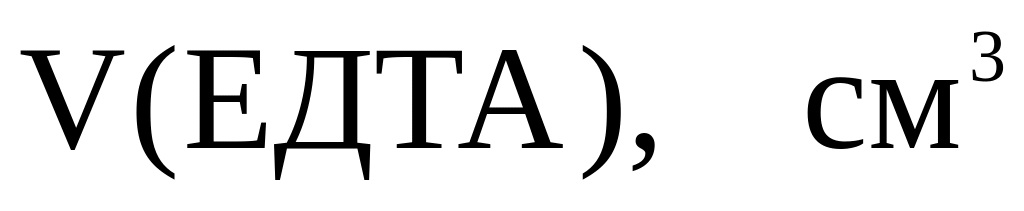
Розрахунок результатів аналізу.
5.1. Розрахунок титру відповідності:
![]() ,
г/см³
,
г/см³
5.2. Розрахунок масової частки кальцій хлориду кристалогідрату в досліджуваній речовині:
![]() ,
%
,
%
5.3. Розрахунок середнього результату:
, %
Висновок.
Контрольні питання
Надати визначення метода комплексонометрії.
Пояснити, чому визначення більшості катіонів металів методом комплексонометрії проводять у присутності амоніачного буферного розчину.
Вказати титрант метода комплексонометрії.
Надати способи приготування розчину ЕДТА.
Вказати, які речовини використовують для стандартизації розчину ЕДТА.
Охарактеризувати загальні вимоги до первинних стандартів.
Обґрунтувати Сутність та умови стандартизації розчину ЕДТА за MgSO4·7H2O.
Надати визначення металохромних індикаторів.
Обґрунтувати механізм дії металохромних індикаторів.
Навести приклади металохромних індикаторів (робота з довідником).
Записати хімічні реакції взаємодії розчину ЕДТА з катіонами металів:
а) Zn2+ ; б) Fe3+ .
12. Підтвердити хімічними реакціями положення: ЕДТА утворює з катіонами металів комплексні сполуки в співвідношенні 1:1, незалежно від валентності іона металу.
І
Розділ
ІІІ.
МЕТОДИ АНАЛІЗУ
Всі методи аналітичної хімії основані на отриманні та вимірюванні аналітичного сигналу. Аналітичний сигнал – це та фізико-хімічна величина, яка залежить від природи речовини та її вмісту в досліджуваній пробі.
У випадку інструментальних методів аналізу таким аналітичним сигналом є фізичний параметр, який можна виміряти за допомогою приладів, і який є функцією якісного чи кількісного складу речовини або розчину.
Сучасність диктує особливі вимоги до способів проведення аналізів. Інструментальні методи мають значні переваги порівняно з класичними хімічними методами:
висока чутливість,
точність,
експресність (швидкість),
селективність (специфічність, вибірковість),
об'єктивність,
недеструктивність (без руйнування зразку),
можливість дистанційного виконання операцій (аналіз на відстані),
можливість автоматизації та комп'ютеризації.
В той же час, застосування інструментальних методів ускладнює необхідність використання:
складного апаратурного устаткування;
еталонів – зразків, склад яких точно відомий;
стандартних розчинів – розчинів з точно відомою концентрацією дослідного компоненту;
холостих проб – проб, які містять всі компоненти, окрім досліджуваного.
Інструментальні методи аналітичної хімії можна умовно поділити на дві групи:
інструментальні
фізичні
фізико-хімічні


Класифікація фізико-хімічних методів аналізу
ОПТИЧНІ |
ЕЛЕКТРОХІМІЧНІ |
ХРОМАТОГРАФІЧНІ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
