
- •Глава 1. Загальні положення. Класифікація гравіметричних методів
- •Метод виділення
- •Метод відгонки
- •Методи осадження
- •Вимоги до осадженої форми
- •Вимоги до гравіметричної форми
- •Вимоги до осаджувача
- •Умови осадження кристалічних осадів
- •Умови осадження аморфних осадів
- •Послідовність аналітичних операцій в гравіметричному методі осадження
- •Практична робота розрахунок величини наважки в гравіметричному аналізі
- •Приклади розв'язування задач
- •Задачі для самостійної роботи
- •Практична робота розрахунок кількості осаджувача
- •Приклад розв'язування задач
- •Задачі до самостійної роботи
- •Практична робота розрахунок результатів аналізу в гравіметрії
- •Приклади розв'язування задач
- •Задачі до самостійної роботи
- •Лабораторна робота визначення масової частки кристалізаційної води в кристалогідраті
- •План експерименту:
- •Лабораторна робота визначення масової частки сульфат-іонів у магній сульфаті гравіметричним методом осадження
- •План експерименту:
- •Лабораторна робота визначення масової частки феруму в кристалогідраті ферум(іі) сульфату
- •План експерименту:
- •Контрольні питання:
- •Глава 2. Основні положення титриметричного аналізу
- •Вимоги до реакцій у титриметричному аналізі
- •Класифікація методів титриметрії в залежності від типу реакції
- •Класифікація методів титриметрії за способом титрування
- •Способи приготування стандартних розчинів
- •1. Приготування первинних стандартних розчинів
- •2. Приготування вторинних стандартних розчинів
- •3. Приготування стандартних розчинів із фіксаналів
- •Глава 3. Розрахунки в титриметричному аналізі
- •3.1. Способи виразу вмісту речовин у розчинах
- •3.2. Розрахункові формули титриметрії
- •Глава 4. Метод кислотно–основного титрування
- •4.1. Теоретичні основи методу
- •Індикатори методу кислотно-основного титрування
- •Показник індикаторів рК, показник титрування рН
- •Класифікація індикаторів
- •Криві титрування
- •1. Титрування сильних кислот сильними основами (Рис 1.)
- •2.Титрування слабких основ сильними кислотами. (Рис 2.)
- •3. Титрування слабких кислот сильними основами. (Рис 3.)
- •4. Титрування слабких кислот слабкими основами.
- •5. Титрування багатоосновних кислот (Рис 4.)
- •Кислотно-основне титрування в неводних середовищах
- •Робочі розчини у методах неводного титрування
- •Практичне використання методів кислотно-основного титрування в аналізі фармацевтичних препаратів
- •Практична робота способи виразу вмісту речовин у розчинах
- •Приклади розв’язання задач
- •Задачі для самостійної роботи
- •Рішення:
- •І Метод окремих наважок
- •Використаний прийом – метод окремих наважок.
- •Розв’язання задачі
- •Задачі для аудиторної роботи
- •Індивідуальні завдання для самостійної роботи студентів з теми «Метод кислотно-основного титрування»
- •Лабораторна робота калібрування мірного посуду. Визначення вмісту піпетки
- •План експерименту
- •Розрахунок маси наважки натрій гідроксиду
- •Взяття наважки лугу
- •Приготування розчину лугу
- •Приготування робочого розчину лугу
- •Висновок лабораторна робота аналіз мінеральної кислоти
- •Хімізм процесу
- •План експерименту
- •Зважувати концентровані кислоти треба в скляному бюксі із закритою кришкою і дуже обережно!!!
- •Лабораторна робота приготування і стандартизація розчину хлоридної кислоти
- •Хімізм процесу
- •План експерименту
- •II. Приготування розчину первинного стандарту натрій тетраборату
- •III. Стандартизація розчину хлоридної кислоти
- •IV. Висновок.
- •Визначення масової частки натрій карбонату у препараті проводять за II-ю точкою еквівалентності План експерименту
- •Лабораторна робота визначення вмісту аніліну в досліджуваному зразку
- •Хімізм процесу
- •План експерименту
- •Глава 5. Методи окисно-відновного титрування
- •5.1. Теоретичні основи методу
- •Окисно-відновні індикатори
- •5.2. Перманганатометрія
- •Приготування розчину kMnO4
- •Стандартизація розчину kMnO4
- •Задачі для самостійної роботи
- •Лабораторна робота приготування та стандартизація розчину калій перманганату
- •Хімізм процесу
- •План експерименту
- •IV. Висновок.
- •Лабораторна робота
- •Визначення вмісту гідроген пероксиду
- •В лікарському препараті
- •Хімізм процесу
- •План експерименту
- •Лабораторна робота
- •Гептагідраті методом перманганатометрії
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •5.3. Хроматометрія
- •Лабораторна робота аналіз солі Fе(II) методом хроматометрії
- •Хімізм процесу
- •План експерименту
- •5.4. Цериметрія
- •5.5. Йодометрія
- •Приготування розчину Na2s2o3
- •Приготування розчину і2
- •Використання методу
- •Лабораторна робота приготування та стандартизація робочого розчину натрій тіосульфату
- •Хімізм процесу
- •План експерименту
- •IV. Висновок. Лабораторна робота приготування та стандартизація розчину йоду
- •Хімізм процесу
- •План експерименту
- •IV. Висновок
- •План експерименту
- •V. Висновок.
- •План експерименту
- •Лабораторна робота аналіз аскорбінової кислоти методом йодометрії
- •Аскорбінова кислота
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Завдання для самостійної роботи
- •5.6. Броматометрія
- •Лабораторна робота визначення вмісту стрептоциду в препараті методом броматометрії
- •Хімізм процесу
- •Принцип методу заміщення
- •План експерименту
- •Контрольні питання
- •Завдання для самостійної роботи
- •5.7. Нітритометрія
- •Умови проведення реакції діазотування
- •Визначення точки еквівалентності
- •Лабораторна робота приготування та стандартизація робочого розчину натрій нітриту
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Завдання до самостійної роботи
- •Глава 7. Методи осаджувального титрування
- •7.1. Теоретичні основи методу
- •Класифікація методів осадження
- •Вимоги до реакцій, що використовуються в методах осадження
- •Індикатори методів осадження
- •5.2. Аргентометрія
- •Метод Мора
- •Умови титрування за методом Фаянса–Ходакова
- •6.3. Тіоціанатометрія Метод Фольгарда
- •Умови титрування за методом Фольгарда
- •6.4. Меркурометрія
- •Приготування та стандартизація розчину титранту
- •Переваги та недоліки меркурометрії перед іншими методами осадження
- •Завдання для самостійної роботи
- •План експерименту
- •Лабораторна робота визначення масової частки калій йодиду методом фольгарда
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Глава 7. Методи комплексоутворення
- •7.1. Теоретичні основи методу
- •7.2. Комплексонометрія (трилонометрія)
- •Принцип дії металохромних індикаторів
- •7.3. Меркуриметрія
- •Задачі для самостійної роботи
- •Лабораторна робота приготування і стандартизація розчину комплексону ііі (трилону б, едта)
- •Хімізм процесу
- •План експерименту
- •III. Стандартизація титранту комплексону ііі.
- •Висновок.
- •Лабораторна робота
- •Аналіз кальцій хлориду гексагідрату
- •Комплексонометричним методом
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Глава 8. Оптичні методи аналізу
- •8.1. Абсорбційні методи аналізу
- •8.1.1. Теоретичні основи
- •Основний закон світлопоглинання (закон Бугера - Ламберта-Бера)
- •Апаратура молекулярно-абсорбційних методів
- •Характеристика та функціональне призначення основних вузлів фотоколориметра
- •Методика вимірювання оптичної густини на фотоколориметрі
- •Основні прийоми обробки аналітичного сигналу при фотометричних визначеннях
- •Контрольні питання
- •Задачі для самостійної роботи
- •Лабораторна робота визначення молярної концентрації іонів феруму (ііі) у розчині методом градуювального графіку
- •План експерименту
- •8.2. Рефрактометричний метод аналізу
- •8.2.1. Теоретичні основи методу
- •Апаратура рефрактометрії
- •Контрольні питання до теми:
- •8.3. Поляриметричний метод аналізу
- •8.3.1.Теоретичні основи методу
- •Основне рівняння поляриметричного методу аналізу
- •Апаратурне оснащення поляриметричного методу
- •Застосування поляриметричного методу аналізу
- •Лабораторна робота ідентифікація речовини за величиною питомого обертання
- •План експерименту
- •Контрольні питання
- •Глава 9. Хроматографічні методи аналізу
- •9.1. Теоретичні основи методу
- •Класифікація хроматографічних методів
- •9.2. Хроматографія в тонкому шарі сорбенту (тонкошарова хроматографія)
- •Етапи проведення аналізу методом тшх
- •6 . Проведення кількісного аналізу
- •Якісний аналіз барвників у суміші методом тонкошарової хроматографії
- •План експерименту
- •9.3. Іонообмінна хроматографія
- •Лабораторна робота визначення концентрації натрій хлориду методом іонообмінної хроматографії
- •План експерименту
- •Додатки
- •Класифікація методів кількісного аналізу
- •Класифікація титриметричних методів аналізу за типом хімічної реакції, яка лежить в основі методу
- •Класифікація титриметричних методів аналізу за способом титрування
- •Кислотно-основне титрування
- •Методи окисно-відновного титрування
- •Перманганатометричне титрування
- •Йодометричне титрування
- •Нітритометричне титрування
- •Броматометричне титрування
- •Цериметричне титрування
- •Хроматометричне титрування
- •Аргентометричне титрування
- •Тіоціанатометричне титрування (за методом Фольгарда)
- •Меркурометричне титрування
- •Комплексонометричне титрування
- •Меркуриметричне титрування
- •Список цитованої літератури
- •Глава 1. Загальні положення. Класифікація гравіметричних методів ….…4
- •Глава 2. Основні положення титриметричного аналізу …………………...…30
- •Глава 3. Розрахунки в титриметричному аналізі
- •Глава 4. Метод кислотно – основного титрування
- •Глава 5. Методи окисно-відновного титрування
- •Глава 6. Методи осаджувального титрування
- •Глава 7. Методи комплексоноутворення
- •7.1. Теоретичні основи методу……………………………………………..…173
- •Глава 8. Оптичні методи аналізу
- •Глава 9. Хроматографічні методи аналізу
5.5. Йодометрія
Й одометричний
метод кількісного об’ємного аналізу
заснований на використанні окисно-відновних
реакцій, які супроводжуються переходом
дийоду в іони І-
або навпаки:
одометричний
метод кількісного об’ємного аналізу
заснований на використанні окисно-відновних
реакцій, які супроводжуються переходом
дийоду в іони І-
або навпаки:
І2 + 2ē F 2І- |
|
Порівняно невелика величина стандартного потенціалу системи І2/2І- показує, що І2 є середньої сили окисник, іони І- – є середньої сили відновники. Тому вільним йодом окислюються тільки сильні відновники (наприклад станум (ІІ) хлорид). З іншого боку, сильні окисники окислюють йодид-іони до вільного йоду. Наприклад, калій перманганат, калій дихромат, солі Феруму(ІІІ) тощо виділяють вільний йод з йодидів:
2Fe3+ +2I– F 2Fe2+ + I2
Ця реакція лежить в основі йодометричного визначення Феруму(ІІІ). В якості робочого розчину при титруванні використовують натрій тіосульфат, який реагує з йодом, що виділився, за рівнянням:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
У
водних розчинах І2
знаходиться у вигляді комплексу з
йодид-іонами
![]() :
:
[І3]- + 2ē F 3І- |
|
Цим методом можна визначити як окисники, так і відновники. Крім того, йод здатний вступати в реакції приєднання, які використовують в аналітичний хімії для визначення подвійних зв'язків у ненасичених органічних сполуках. Ступінь ненасиченості органічних сполук визначають йодним числом, тобто кількістю йоду у відсотках, яку приєднує речовина.
Йодометричне титрування проводять в нейтральному середовищі, тому що в кислому середовищі КІ утворює нестійку йодидну кислоту НІ.
В сильнолужному середовищі І2 взаємодіє з лугами, в результаті чого утворюються гіпойодиди:
[І3]- + 2ОН- F ІО- + 2І- + Н2О
Титранти методу:
розчин натрій тіосульфату Na2S2O3 (при визначенні окисників);
розчин йоду (
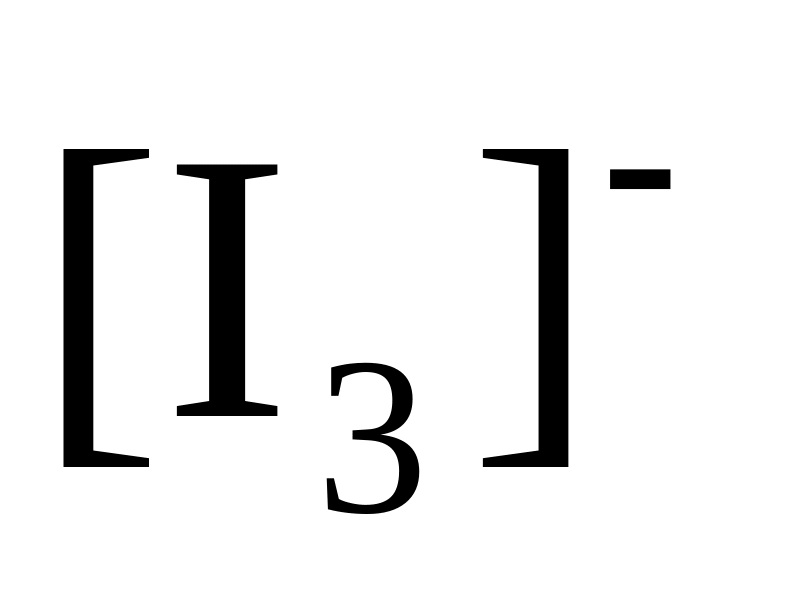 )
(при визначені відновників).
)
(при визначені відновників).
Приготування розчину Na2s2o3
Розчин натрій тіосульфату готують як вторинний стандартний розчин. Це пов'язано з тим, що він нестійкій і змінює концентрацію під впливом вуглекислого газу, кисню, який знаходиться у повітрі та під впливом тіобактерій, які розкладають натрій тіосульфат.
-
S2O32- + CO2 + H2O F HSO3– + S↓ + HCO3–
2S2O32- + O2 F 2SO42– + 2S↓
Спочатку розчин натрій тіосульфату готують приблизної концентрації, дають постояти, через 710 діб після виготовлення розчин стандартизують і потім періодично перевіряють концентрацію.
Стандартизувати розчин натрій тіосульфату можна за стандартними розчинами – калій дихроматом, калій броматом, калій йодатом. Встановлення титру робочого розчину натрій тіосульфату за калій дихроматом відбувається за рівняннями:
K2Cr2O7 + 6KI + 7H2SO4 = 4K2SO4 + Cr2(SO4)3 +3I2 + 7H2O
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Зберігати виготовлений розчин титранту треба у склянках з темного скла, без доступу кисню.
Приготування розчину і2
Розчин йоду можна приготувати двома шляхами, як:
первинний стандартний розчин з приготовленим титром;
вторинний стандартний розчин з встановленим титром .
Первинний стандартний розчин йоду готують по точній наважці хімічного чистого йоду, одержаного сублімацією.
Другий спосіб приготування розчину йоду: за грубою наважкою з подальшою стандартизацією за стандартним розчином натрій тіосульфату.
Йод леткий, пари його отруйні, викликають корозію металів і тому всі операції, а, особливо зважування, треба проводити у скляному закритому бюксі.
Йод – малорозчинна у воді речовина. Його розчинність зростає в присутності калій йодиду, з яким він утворює розчинні комплексні іони червоно-бурого кольору.
І2 + І- F [I3]-
Тому наважку йоду розчиняють у насиченому розчині калій йодиду.
Приготовлений розчин йоду зберігають у склянках з темного скла з притертою пробкою у захищеному від світла місці.
