
- •Глава 1. Загальні положення. Класифікація гравіметричних методів
- •Метод виділення
- •Метод відгонки
- •Методи осадження
- •Вимоги до осадженої форми
- •Вимоги до гравіметричної форми
- •Вимоги до осаджувача
- •Умови осадження кристалічних осадів
- •Умови осадження аморфних осадів
- •Послідовність аналітичних операцій в гравіметричному методі осадження
- •Практична робота розрахунок величини наважки в гравіметричному аналізі
- •Приклади розв'язування задач
- •Задачі для самостійної роботи
- •Практична робота розрахунок кількості осаджувача
- •Приклад розв'язування задач
- •Задачі до самостійної роботи
- •Практична робота розрахунок результатів аналізу в гравіметрії
- •Приклади розв'язування задач
- •Задачі до самостійної роботи
- •Лабораторна робота визначення масової частки кристалізаційної води в кристалогідраті
- •План експерименту:
- •Лабораторна робота визначення масової частки сульфат-іонів у магній сульфаті гравіметричним методом осадження
- •План експерименту:
- •Лабораторна робота визначення масової частки феруму в кристалогідраті ферум(іі) сульфату
- •План експерименту:
- •Контрольні питання:
- •Глава 2. Основні положення титриметричного аналізу
- •Вимоги до реакцій у титриметричному аналізі
- •Класифікація методів титриметрії в залежності від типу реакції
- •Класифікація методів титриметрії за способом титрування
- •Способи приготування стандартних розчинів
- •1. Приготування первинних стандартних розчинів
- •2. Приготування вторинних стандартних розчинів
- •3. Приготування стандартних розчинів із фіксаналів
- •Глава 3. Розрахунки в титриметричному аналізі
- •3.1. Способи виразу вмісту речовин у розчинах
- •3.2. Розрахункові формули титриметрії
- •Глава 4. Метод кислотно–основного титрування
- •4.1. Теоретичні основи методу
- •Індикатори методу кислотно-основного титрування
- •Показник індикаторів рК, показник титрування рН
- •Класифікація індикаторів
- •Криві титрування
- •1. Титрування сильних кислот сильними основами (Рис 1.)
- •2.Титрування слабких основ сильними кислотами. (Рис 2.)
- •3. Титрування слабких кислот сильними основами. (Рис 3.)
- •4. Титрування слабких кислот слабкими основами.
- •5. Титрування багатоосновних кислот (Рис 4.)
- •Кислотно-основне титрування в неводних середовищах
- •Робочі розчини у методах неводного титрування
- •Практичне використання методів кислотно-основного титрування в аналізі фармацевтичних препаратів
- •Практична робота способи виразу вмісту речовин у розчинах
- •Приклади розв’язання задач
- •Задачі для самостійної роботи
- •Рішення:
- •І Метод окремих наважок
- •Використаний прийом – метод окремих наважок.
- •Розв’язання задачі
- •Задачі для аудиторної роботи
- •Індивідуальні завдання для самостійної роботи студентів з теми «Метод кислотно-основного титрування»
- •Лабораторна робота калібрування мірного посуду. Визначення вмісту піпетки
- •План експерименту
- •Розрахунок маси наважки натрій гідроксиду
- •Взяття наважки лугу
- •Приготування розчину лугу
- •Приготування робочого розчину лугу
- •Висновок лабораторна робота аналіз мінеральної кислоти
- •Хімізм процесу
- •План експерименту
- •Зважувати концентровані кислоти треба в скляному бюксі із закритою кришкою і дуже обережно!!!
- •Лабораторна робота приготування і стандартизація розчину хлоридної кислоти
- •Хімізм процесу
- •План експерименту
- •II. Приготування розчину первинного стандарту натрій тетраборату
- •III. Стандартизація розчину хлоридної кислоти
- •IV. Висновок.
- •Визначення масової частки натрій карбонату у препараті проводять за II-ю точкою еквівалентності План експерименту
- •Лабораторна робота визначення вмісту аніліну в досліджуваному зразку
- •Хімізм процесу
- •План експерименту
- •Глава 5. Методи окисно-відновного титрування
- •5.1. Теоретичні основи методу
- •Окисно-відновні індикатори
- •5.2. Перманганатометрія
- •Приготування розчину kMnO4
- •Стандартизація розчину kMnO4
- •Задачі для самостійної роботи
- •Лабораторна робота приготування та стандартизація розчину калій перманганату
- •Хімізм процесу
- •План експерименту
- •IV. Висновок.
- •Лабораторна робота
- •Визначення вмісту гідроген пероксиду
- •В лікарському препараті
- •Хімізм процесу
- •План експерименту
- •Лабораторна робота
- •Гептагідраті методом перманганатометрії
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •5.3. Хроматометрія
- •Лабораторна робота аналіз солі Fе(II) методом хроматометрії
- •Хімізм процесу
- •План експерименту
- •5.4. Цериметрія
- •5.5. Йодометрія
- •Приготування розчину Na2s2o3
- •Приготування розчину і2
- •Використання методу
- •Лабораторна робота приготування та стандартизація робочого розчину натрій тіосульфату
- •Хімізм процесу
- •План експерименту
- •IV. Висновок. Лабораторна робота приготування та стандартизація розчину йоду
- •Хімізм процесу
- •План експерименту
- •IV. Висновок
- •План експерименту
- •V. Висновок.
- •План експерименту
- •Лабораторна робота аналіз аскорбінової кислоти методом йодометрії
- •Аскорбінова кислота
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Завдання для самостійної роботи
- •5.6. Броматометрія
- •Лабораторна робота визначення вмісту стрептоциду в препараті методом броматометрії
- •Хімізм процесу
- •Принцип методу заміщення
- •План експерименту
- •Контрольні питання
- •Завдання для самостійної роботи
- •5.7. Нітритометрія
- •Умови проведення реакції діазотування
- •Визначення точки еквівалентності
- •Лабораторна робота приготування та стандартизація робочого розчину натрій нітриту
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Завдання до самостійної роботи
- •Глава 7. Методи осаджувального титрування
- •7.1. Теоретичні основи методу
- •Класифікація методів осадження
- •Вимоги до реакцій, що використовуються в методах осадження
- •Індикатори методів осадження
- •5.2. Аргентометрія
- •Метод Мора
- •Умови титрування за методом Фаянса–Ходакова
- •6.3. Тіоціанатометрія Метод Фольгарда
- •Умови титрування за методом Фольгарда
- •6.4. Меркурометрія
- •Приготування та стандартизація розчину титранту
- •Переваги та недоліки меркурометрії перед іншими методами осадження
- •Завдання для самостійної роботи
- •План експерименту
- •Лабораторна робота визначення масової частки калій йодиду методом фольгарда
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Глава 7. Методи комплексоутворення
- •7.1. Теоретичні основи методу
- •7.2. Комплексонометрія (трилонометрія)
- •Принцип дії металохромних індикаторів
- •7.3. Меркуриметрія
- •Задачі для самостійної роботи
- •Лабораторна робота приготування і стандартизація розчину комплексону ііі (трилону б, едта)
- •Хімізм процесу
- •План експерименту
- •III. Стандартизація титранту комплексону ііі.
- •Висновок.
- •Лабораторна робота
- •Аналіз кальцій хлориду гексагідрату
- •Комплексонометричним методом
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Глава 8. Оптичні методи аналізу
- •8.1. Абсорбційні методи аналізу
- •8.1.1. Теоретичні основи
- •Основний закон світлопоглинання (закон Бугера - Ламберта-Бера)
- •Апаратура молекулярно-абсорбційних методів
- •Характеристика та функціональне призначення основних вузлів фотоколориметра
- •Методика вимірювання оптичної густини на фотоколориметрі
- •Основні прийоми обробки аналітичного сигналу при фотометричних визначеннях
- •Контрольні питання
- •Задачі для самостійної роботи
- •Лабораторна робота визначення молярної концентрації іонів феруму (ііі) у розчині методом градуювального графіку
- •План експерименту
- •8.2. Рефрактометричний метод аналізу
- •8.2.1. Теоретичні основи методу
- •Апаратура рефрактометрії
- •Контрольні питання до теми:
- •8.3. Поляриметричний метод аналізу
- •8.3.1.Теоретичні основи методу
- •Основне рівняння поляриметричного методу аналізу
- •Апаратурне оснащення поляриметричного методу
- •Застосування поляриметричного методу аналізу
- •Лабораторна робота ідентифікація речовини за величиною питомого обертання
- •План експерименту
- •Контрольні питання
- •Глава 9. Хроматографічні методи аналізу
- •9.1. Теоретичні основи методу
- •Класифікація хроматографічних методів
- •9.2. Хроматографія в тонкому шарі сорбенту (тонкошарова хроматографія)
- •Етапи проведення аналізу методом тшх
- •6 . Проведення кількісного аналізу
- •Якісний аналіз барвників у суміші методом тонкошарової хроматографії
- •План експерименту
- •9.3. Іонообмінна хроматографія
- •Лабораторна робота визначення концентрації натрій хлориду методом іонообмінної хроматографії
- •План експерименту
- •Додатки
- •Класифікація методів кількісного аналізу
- •Класифікація титриметричних методів аналізу за типом хімічної реакції, яка лежить в основі методу
- •Класифікація титриметричних методів аналізу за способом титрування
- •Кислотно-основне титрування
- •Методи окисно-відновного титрування
- •Перманганатометричне титрування
- •Йодометричне титрування
- •Нітритометричне титрування
- •Броматометричне титрування
- •Цериметричне титрування
- •Хроматометричне титрування
- •Аргентометричне титрування
- •Тіоціанатометричне титрування (за методом Фольгарда)
- •Меркурометричне титрування
- •Комплексонометричне титрування
- •Меркуриметричне титрування
- •Список цитованої літератури
- •Глава 1. Загальні положення. Класифікація гравіметричних методів ….…4
- •Глава 2. Основні положення титриметричного аналізу …………………...…30
- •Глава 3. Розрахунки в титриметричному аналізі
- •Глава 4. Метод кислотно – основного титрування
- •Глава 5. Методи окисно-відновного титрування
- •Глава 6. Методи осаджувального титрування
- •Глава 7. Методи комплексоноутворення
- •7.1. Теоретичні основи методу……………………………………………..…173
- •Глава 8. Оптичні методи аналізу
- •Глава 9. Хроматографічні методи аналізу
Контрольні питання
Надати схему аналізу стрептоциду методом броматометрії. Які фармакологічні властивості має стрептоцид?
Визначення метода броматометрії. Область використання метода.
Закінчити реакцію : Cl2 + KBr →. Записати рівняння напівреакцій. Визначити окисник і відновник.
Одержати бром при взаємодії бромат-бромідної суміші. У якому середовищі проходить реакція?
Записати реакцію бромування стрептоциду. Визначити молярну масу еквіваленту стрептоциду.
Завдання для самостійної роботи
с( KBrO3) = 0,1000 моль/дм3. Розрахувати
 ,
m(KBrO3)
в 1 дм3
розчину. (Відповідь:
0,002783 г/см3;
0,01722 г/см3;
2,783 г)
,
m(KBrO3)
в 1 дм3
розчину. (Відповідь:
0,002783 г/см3;
0,01722 г/см3;
2,783 г)На титрування 20,00 см3 Br2 (після обробки розчином калій йодиду) витрачено 21,00 см3 стандартного розчину Na2S2O3. c(Na2S2O3) = 0,1100 моль/дм3. Розрахувати масу брому в 1 дм3 розчину. Записати хімічні реакції. (Відповідь:9,228 г).
В основі методу броматометрії лежить напівреакція:
BrO-3 + 6Н+ + 6ē → Br- + 3Н2О
Розрахувати масу KBrO3 для приготування 500 см3 розчину, з молярною концентрацією еквіваленту 0,1 моль/дм3. (Відповідь:1,4 г)
На титрування розчину брому після обробки розчином калій йодиду витрачено 10,0 см3 розчину натрій тіосульфату.
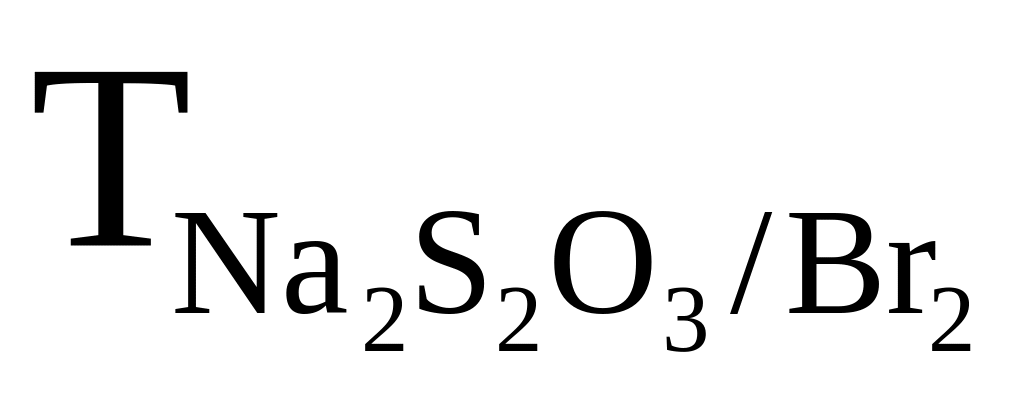 =
0,008120 г/см3.
Розрахувати масу брому в розчині.
(Відповідь:0,08120
г)
=
0,008120 г/см3.
Розрахувати масу брому в розчині.
(Відповідь:0,08120
г)Розрахувати масу наважки Na2S2O3·5Н2О для приготування 2 дм3 розчину, де молярна маса еквіваленту Na2S2O3·5Н2О становить 0,05 моль/дм3. (Відповідь:24,8 г)
5.7. Нітритометрія
М етод
нітритометрії – метод кількісного
аналізу, оснований на використанні
окисно-відновних і діазотуючих
властивостей нітритної кислоти.
етод
нітритометрії – метод кількісного
аналізу, оснований на використанні
окисно-відновних і діазотуючих
властивостей нітритної кислоти.
Нітритна кислота HNO2 є нестійкою, тому титрантом методу є стандартний розчин натрій нітриту NaNO2.
Метод нітритометрії застосовують для аналізу відновників (солей Fe2+, As3+, Sn2+ тощо). Найбільше поширення цей метод здобув для аналізу первинних та вторинних ароматичних амінів.
Сутність методу полягає в здатності первинних ароматичних амінів та їх похідних кількісно реагувати з нітритною кислотою з утворенням солей діазонію.
В основі методу лежить реакція діазотування:
![]()
де: Ar – ароматичний радикал.
Нітритометричний метод аналізу (метод діазотування) широко використовують для визначення багатьох фармацевтичних препаратів, що містять ароматичну аміногрупу: новокаїну, п-амінобензенової кислоти та її похідних – сульфаніламідних препаратів.
Титрантом в методі нітритометрії є стандартний розчин NaNO2. Натрій нітрит є гігроскопічним, тому його розчин готують як вторинний стандартний розчин.
Титр розчину NaNO2 установлюють за хімічно чистою сульфаніловою кислотою, висушеною попередньо до сталої маси. При цьому відбувається наступна реакція:
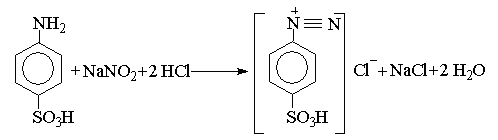
Наважку сульфанілової кислоти розчиняють у воді в присутності NaHCO3 (утворюється водорозчинна сіль сульфанілової кислоти), додають НС1, КВr і титрують робочим розчином NaNO2.
Для визначення точної концентрації робочого розчину NaNO2 можна також використовувати титрований розчин КМnО4:
5NaNO2 + 2KMnO4 +ЗН2SO4 = 5NaNO3 + 2MnSO4 + K2SO4+ ЗН2О
