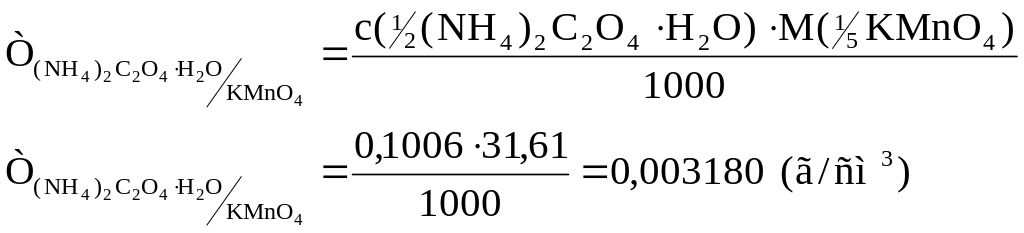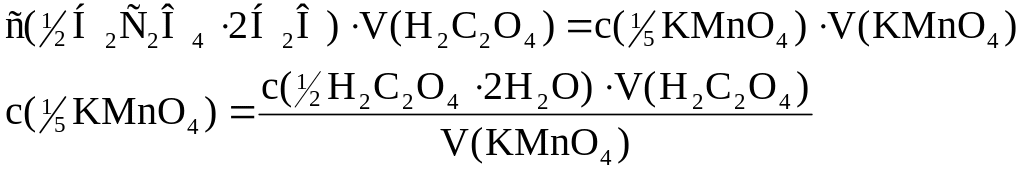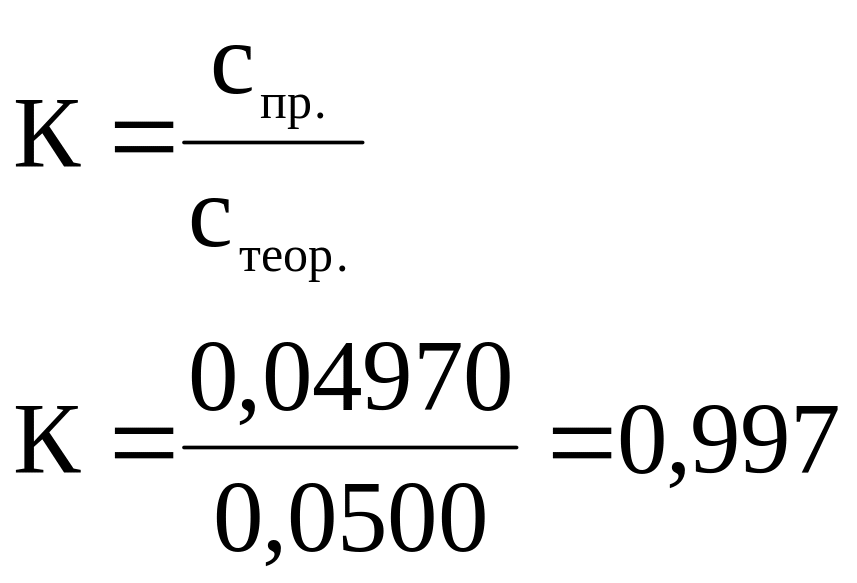- •Глава 1. Загальні положення. Класифікація гравіметричних методів
- •Метод виділення
- •Метод відгонки
- •Методи осадження
- •Вимоги до осадженої форми
- •Вимоги до гравіметричної форми
- •Вимоги до осаджувача
- •Умови осадження кристалічних осадів
- •Умови осадження аморфних осадів
- •Послідовність аналітичних операцій в гравіметричному методі осадження
- •Практична робота розрахунок величини наважки в гравіметричному аналізі
- •Приклади розв'язування задач
- •Задачі для самостійної роботи
- •Практична робота розрахунок кількості осаджувача
- •Приклад розв'язування задач
- •Задачі до самостійної роботи
- •Практична робота розрахунок результатів аналізу в гравіметрії
- •Приклади розв'язування задач
- •Задачі до самостійної роботи
- •Лабораторна робота визначення масової частки кристалізаційної води в кристалогідраті
- •План експерименту:
- •Лабораторна робота визначення масової частки сульфат-іонів у магній сульфаті гравіметричним методом осадження
- •План експерименту:
- •Лабораторна робота визначення масової частки феруму в кристалогідраті ферум(іі) сульфату
- •План експерименту:
- •Контрольні питання:
- •Глава 2. Основні положення титриметричного аналізу
- •Вимоги до реакцій у титриметричному аналізі
- •Класифікація методів титриметрії в залежності від типу реакції
- •Класифікація методів титриметрії за способом титрування
- •Способи приготування стандартних розчинів
- •1. Приготування первинних стандартних розчинів
- •2. Приготування вторинних стандартних розчинів
- •3. Приготування стандартних розчинів із фіксаналів
- •Глава 3. Розрахунки в титриметричному аналізі
- •3.1. Способи виразу вмісту речовин у розчинах
- •3.2. Розрахункові формули титриметрії
- •Глава 4. Метод кислотно–основного титрування
- •4.1. Теоретичні основи методу
- •Індикатори методу кислотно-основного титрування
- •Показник індикаторів рК, показник титрування рН
- •Класифікація індикаторів
- •Криві титрування
- •1. Титрування сильних кислот сильними основами (Рис 1.)
- •2.Титрування слабких основ сильними кислотами. (Рис 2.)
- •3. Титрування слабких кислот сильними основами. (Рис 3.)
- •4. Титрування слабких кислот слабкими основами.
- •5. Титрування багатоосновних кислот (Рис 4.)
- •Кислотно-основне титрування в неводних середовищах
- •Робочі розчини у методах неводного титрування
- •Практичне використання методів кислотно-основного титрування в аналізі фармацевтичних препаратів
- •Практична робота способи виразу вмісту речовин у розчинах
- •Приклади розв’язання задач
- •Задачі для самостійної роботи
- •Рішення:
- •І Метод окремих наважок
- •Використаний прийом – метод окремих наважок.
- •Розв’язання задачі
- •Задачі для аудиторної роботи
- •Індивідуальні завдання для самостійної роботи студентів з теми «Метод кислотно-основного титрування»
- •Лабораторна робота калібрування мірного посуду. Визначення вмісту піпетки
- •План експерименту
- •Розрахунок маси наважки натрій гідроксиду
- •Взяття наважки лугу
- •Приготування розчину лугу
- •Приготування робочого розчину лугу
- •Висновок лабораторна робота аналіз мінеральної кислоти
- •Хімізм процесу
- •План експерименту
- •Зважувати концентровані кислоти треба в скляному бюксі із закритою кришкою і дуже обережно!!!
- •Лабораторна робота приготування і стандартизація розчину хлоридної кислоти
- •Хімізм процесу
- •План експерименту
- •II. Приготування розчину первинного стандарту натрій тетраборату
- •III. Стандартизація розчину хлоридної кислоти
- •IV. Висновок.
- •Визначення масової частки натрій карбонату у препараті проводять за II-ю точкою еквівалентності План експерименту
- •Лабораторна робота визначення вмісту аніліну в досліджуваному зразку
- •Хімізм процесу
- •План експерименту
- •Глава 5. Методи окисно-відновного титрування
- •5.1. Теоретичні основи методу
- •Окисно-відновні індикатори
- •5.2. Перманганатометрія
- •Приготування розчину kMnO4
- •Стандартизація розчину kMnO4
- •Задачі для самостійної роботи
- •Лабораторна робота приготування та стандартизація розчину калій перманганату
- •Хімізм процесу
- •План експерименту
- •IV. Висновок.
- •Лабораторна робота
- •Визначення вмісту гідроген пероксиду
- •В лікарському препараті
- •Хімізм процесу
- •План експерименту
- •Лабораторна робота
- •Гептагідраті методом перманганатометрії
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •5.3. Хроматометрія
- •Лабораторна робота аналіз солі Fе(II) методом хроматометрії
- •Хімізм процесу
- •План експерименту
- •5.4. Цериметрія
- •5.5. Йодометрія
- •Приготування розчину Na2s2o3
- •Приготування розчину і2
- •Використання методу
- •Лабораторна робота приготування та стандартизація робочого розчину натрій тіосульфату
- •Хімізм процесу
- •План експерименту
- •IV. Висновок. Лабораторна робота приготування та стандартизація розчину йоду
- •Хімізм процесу
- •План експерименту
- •IV. Висновок
- •План експерименту
- •V. Висновок.
- •План експерименту
- •Лабораторна робота аналіз аскорбінової кислоти методом йодометрії
- •Аскорбінова кислота
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Завдання для самостійної роботи
- •5.6. Броматометрія
- •Лабораторна робота визначення вмісту стрептоциду в препараті методом броматометрії
- •Хімізм процесу
- •Принцип методу заміщення
- •План експерименту
- •Контрольні питання
- •Завдання для самостійної роботи
- •5.7. Нітритометрія
- •Умови проведення реакції діазотування
- •Визначення точки еквівалентності
- •Лабораторна робота приготування та стандартизація робочого розчину натрій нітриту
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Завдання до самостійної роботи
- •Глава 7. Методи осаджувального титрування
- •7.1. Теоретичні основи методу
- •Класифікація методів осадження
- •Вимоги до реакцій, що використовуються в методах осадження
- •Індикатори методів осадження
- •5.2. Аргентометрія
- •Метод Мора
- •Умови титрування за методом Фаянса–Ходакова
- •6.3. Тіоціанатометрія Метод Фольгарда
- •Умови титрування за методом Фольгарда
- •6.4. Меркурометрія
- •Приготування та стандартизація розчину титранту
- •Переваги та недоліки меркурометрії перед іншими методами осадження
- •Завдання для самостійної роботи
- •План експерименту
- •Лабораторна робота визначення масової частки калій йодиду методом фольгарда
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Глава 7. Методи комплексоутворення
- •7.1. Теоретичні основи методу
- •7.2. Комплексонометрія (трилонометрія)
- •Принцип дії металохромних індикаторів
- •7.3. Меркуриметрія
- •Задачі для самостійної роботи
- •Лабораторна робота приготування і стандартизація розчину комплексону ііі (трилону б, едта)
- •Хімізм процесу
- •План експерименту
- •III. Стандартизація титранту комплексону ііі.
- •Висновок.
- •Лабораторна робота
- •Аналіз кальцій хлориду гексагідрату
- •Комплексонометричним методом
- •Хімізм процесу
- •План експерименту
- •Контрольні питання
- •Глава 8. Оптичні методи аналізу
- •8.1. Абсорбційні методи аналізу
- •8.1.1. Теоретичні основи
- •Основний закон світлопоглинання (закон Бугера - Ламберта-Бера)
- •Апаратура молекулярно-абсорбційних методів
- •Характеристика та функціональне призначення основних вузлів фотоколориметра
- •Методика вимірювання оптичної густини на фотоколориметрі
- •Основні прийоми обробки аналітичного сигналу при фотометричних визначеннях
- •Контрольні питання
- •Задачі для самостійної роботи
- •Лабораторна робота визначення молярної концентрації іонів феруму (ііі) у розчині методом градуювального графіку
- •План експерименту
- •8.2. Рефрактометричний метод аналізу
- •8.2.1. Теоретичні основи методу
- •Апаратура рефрактометрії
- •Контрольні питання до теми:
- •8.3. Поляриметричний метод аналізу
- •8.3.1.Теоретичні основи методу
- •Основне рівняння поляриметричного методу аналізу
- •Апаратурне оснащення поляриметричного методу
- •Застосування поляриметричного методу аналізу
- •Лабораторна робота ідентифікація речовини за величиною питомого обертання
- •План експерименту
- •Контрольні питання
- •Глава 9. Хроматографічні методи аналізу
- •9.1. Теоретичні основи методу
- •Класифікація хроматографічних методів
- •9.2. Хроматографія в тонкому шарі сорбенту (тонкошарова хроматографія)
- •Етапи проведення аналізу методом тшх
- •6 . Проведення кількісного аналізу
- •Якісний аналіз барвників у суміші методом тонкошарової хроматографії
- •План експерименту
- •9.3. Іонообмінна хроматографія
- •Лабораторна робота визначення концентрації натрій хлориду методом іонообмінної хроматографії
- •План експерименту
- •Додатки
- •Класифікація методів кількісного аналізу
- •Класифікація титриметричних методів аналізу за типом хімічної реакції, яка лежить в основі методу
- •Класифікація титриметричних методів аналізу за способом титрування
- •Кислотно-основне титрування
- •Методи окисно-відновного титрування
- •Перманганатометричне титрування
- •Йодометричне титрування
- •Нітритометричне титрування
- •Броматометричне титрування
- •Цериметричне титрування
- •Хроматометричне титрування
- •Аргентометричне титрування
- •Тіоціанатометричне титрування (за методом Фольгарда)
- •Меркурометричне титрування
- •Комплексонометричне титрування
- •Меркуриметричне титрування
- •Список цитованої літератури
- •Глава 1. Загальні положення. Класифікація гравіметричних методів ….…4
- •Глава 2. Основні положення титриметричного аналізу …………………...…30
- •Глава 3. Розрахунки в титриметричному аналізі
- •Глава 4. Метод кислотно – основного титрування
- •Глава 5. Методи окисно-відновного титрування
- •Глава 6. Методи осаджувального титрування
- •Глава 7. Методи комплексоноутворення
- •7.1. Теоретичні основи методу……………………………………………..…173
- •Глава 8. Оптичні методи аналізу
- •Глава 9. Хроматографічні методи аналізу
Приготування розчину kMnO4
Розчин калій перманганату готують зазвичай як вторинний стандартний розчин з c( KMnO4) = 0,1 моль/дм3. Для приготування 1 дм3 беруть наважку більш, ніж 3,16 г на техно-хімічних терезах. KMnO4 є дуже сильним окисником і змінює свою концентрацію в присутності багатьох різних відновників органічного та неорганічного походження: окиснює коркові пробки, фільтрувальний папір, гуму, амоніак. При приготуванні розчину KMnO4, його витримують декілька діб в темному місці для того, щоб пройшли всі окисно-відновні процеси з домішками, які містяться у воді. Тільки після 7-10 діб цей розчин фільтрують через скляний фільтр, а потім стандартизують.
Розчин KMnO4 слід зберігати в темному місці, тому що світло прискорює реакцію розкладання калій перманганату.
4KMnO4 + 2H2O → 4MnО2↓ + 4KOH + 3O2↑
Стандартизація розчину kMnO4
Розчин KMnO4 стандартизують за стандартними речовинами: оксалатною кислотою, натрій оксалатом, сіллю Мора, тощо.
В сульфатнокислому середовищі оксалатна кислота реагує з калій перманганатом згідно з рівнянням:
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O
MnO + 8H+ + 5ē F Mn2+ + 4H2O |
2 |
C2O – 2ē F 2CO2↑ |
5 |
2MnO + 16H+ + C2O → 2Mn2+ + 10CO2↑ + 8H2O |
|
Індикатором методу служить сам титрант KMnO4, надлишкова крапля титранта забарвлює розчин у рожевий колір. Титрування слід проводити, використовуючи бюретки зі скляним краном. Використання бюреток з гумовими трубками недоречно, тому що гума окиснюється і розчини KMnO4 змінюють свою концентрацію. Залишати на довгий час розчин KMnO4 у бюретці не радять, тому що на поверхні бюреток з'являється наліт MnO2 (відмивається HCl або H2C2O4). Концентрацію розчину KMnO4 слід регулярно перевіряти.
Перманганатометричним методом можна кількісно визначати відновники, такі як Н2О2, Fe2+, Са2+, NaNO2 тощо.
ПРАКТИЧНА РОБОТА
РОЗРАХУНОК МАСИ НАВАЖКИ ДОСЛІДЖУВАНОЇ
РЕЧОВИНИ В МЕТОДАХ ОКИСНО-ВІДНОВНОГО ТИТРУВАННЯ
Мета: закріпити навички розрахунків мас наважок досліджуваних речовин.
Приклади розв’язання задач
Приклад 1. Розрахувати масу наважки солі Феруму(ІІ) для аналізу на вміст Fe2+ - катіонів методом перманганатометрії. Вміст Феруму(ІІ) в солі становить близько 20%.
Аналіз проводять методом окремих наважок. Вихідні дані:
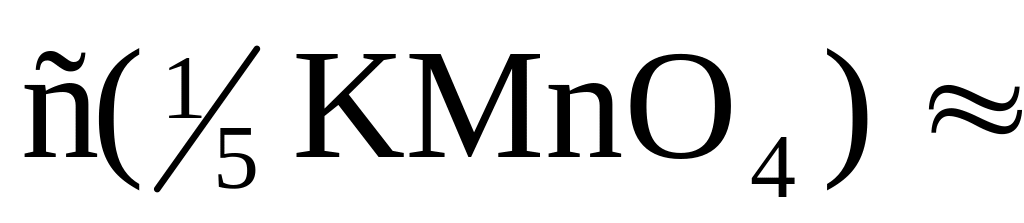 0,1
моль/дм³, місткість бюретки 25 см³.
0,1
моль/дм³, місткість бюретки 25 см³.Аналіз проводять методом піпетування. Вихідні дані:
 0,1
моль/дм³, місткість мірної колби 250,0
см³.
0,1
моль/дм³, місткість мірної колби 250,0
см³.
Рішення:
Хімізм:
![]()
 5
5
![]()
 1
1
![]()
M(Fe)=56 г/моль
![]() 31,6
г/моль
31,6
г/моль
І Метод окремих наважок
Д ано:
ано:
![]() 1.
За законом еквівалентів:
1.
За законом еквівалентів:
![]()
![]()
![]()

![]() ,
моль
,
моль
![]() де
де
![]()
![]()
3.
![]()
Загальна формула
![]() (1)
(1)
або
![]() (2)
(2)
Підставимо числові значення в загальну формулу (1) :
![]()
ІІ Метод піпетування
Д ано:
ано:
1.![]()
![]() см³
см³
![]()
![]() 2.
2.
![]()
![]()

![]()
Загальна формула
![]() (3)
(3)
або
![]() (4)
(4)
або
![]() (5)
(5)
Підставимо числові значення в загальну формулу (3):
![]()
ПРАКТИЧНА РОБОТА
РОЗРАХУНКИ ЗА РЕЗУЛЬТАТАМИ
ПЕРМАНГАНАТОМЕТРИЧНОГО АНАЛІЗУ
Мета: закріпити навички розрахунків, які використовуються при проведенні аналізу перманганатометричним методом.
Приклади розв’язання задач
Приклад 1. Наважка амоній оксалату (NH4)2C2O4·H2O (х.ч.) масою 3,5740 г розчинена в мірній колбі об’ємом 500 см3. Обчислити молярну концентрацію еквіваленту амоній оксалату, коефіцієнт поправки, титр і титр амоній оксалату за калій перманганатом.
Дано: mн.((NH4)2C2O4·H2O) = 3,5740 г Vм.к. = 500 см3 |
Рішення:
Відповідь: с( (NH4)2C2O4·H2O) = 0,1006 моль/дм3;
К
= 1,006;
|
с( (NH4)2C2O4·H2O) –? К – ?
|
Приклад 2. Наважка оксалатної кислоти H2C2O4·2H2O (х.ч.) масою 1,5020 г розчинена в мірній колбі об'ємом 250 см3. На титрування 25,00 см3 цього розчину витрачено 23,68 см3 титранту калій перманганату. Обчислити молярну концентрацію еквіваленту калій перманганату, коефіцієнт поправки, титр титранта.
Дано: mн.(H2C2O4·2H2O) = = 1,5020 г Vм.к. = 250 см3 V(H2C2O4) = 25,00 см3 V(KMnO4) = 24,68 см3
|
Рішення: Хімізм: 2KMnO4 + 5H2C2O4 + 3H2SO4 2MnSO4 + 10CO2 + K2SO4 + 8H2O
З рівняння реакції вибігає, що: М( H2C2O4·2H2O) = М(H2C2O4·2H2O) = 63,04 г/моль М( KMnO4) = М( KMnO4) = 31,61 г/моль
З основного рівняння титриметрії:
Відповідь: с( KMnO4) = 0,09654 моль/дм3; К = 0,9654; ТKMnO4 = 0,003052 г/см3 |
||||||
с( KMnO4) – ? К – ?
Т
|
|||||||
Приклад 3. Наважка безводної оксалатної кислоти Н2С2О4 (х.ч.) масою 0,6895 г розчинена у вільному об'ємі води та відтитрована розчином калій перманганату. Об'єм, що витратили на титрування, дорівнює 30,82 см3. Обчислити молярну концентрацію еквіваленту калій перманганату, коефіцієнт поправки, титр.
Дано: mнав.(H2C2O4) = 0,6895 г V(KMnO4) = 30,82 см3 с( KMnO4) – ? К – ?
|
Рішення:
Відповідь: с( KMnO4) = 0,04970 моль/дм3; К = 0,997; = 0,001571 г/см3 |
|
Приклад 4. На титрування розчину амоній оксалату (NH4)2C2O4·H2O витрачено 25,80 см3 стандартного розчину калій перманганату. Титр відповідності калій перманганату за амоній оксалатом 0,007106 г/см3. Обчислити масу амоній оксалату в розчині, що титрували.
Дано:
V(KMnO4) = 25,80 см3
= 0,007106 г/см3 |
Рішення:
Відповідь: m((NH4)2C2O4·H2O) = 0,1833 г |
m((NH4)2C2O4·H2O) – ? |
Приклад 5. Наважка амоній оксалату масою 1,9710 г розчинена в мірній колбі об'ємом 500 см3. На титрування 25,00 см3 цього розчину витрачено 28,25 см3 стандартного розчину калій перманганату (с(1/5KMnO4) = 0,05 моль/дм3; К = 0,9530). Обчислити масову частку (NH4)2C2O4·H2O у зразку.
Дано: mн.((NH4)2C2O4·H2O) = = 1,9710 г Vм.к.= 500 см3 V((NH4)2C2O4) = 25,00 см3 V(KMnO4) = 28,25 см3 с( KMnO4)= =0,05 моль/дм3 К = 0,9530 |
Рішення:
Відповідь: W((NH4)2C2O4·H2O) = 97,06 % |
W((NH4)2C2O4·H2O) – ? |
Приклад 6.
Наважка технічного залізного купоросу
масою 0,7220 г розчинена у воді та
відтитрована стандартним розчином
калій перманганату (Т![]() = 0,003161 г/см3) Об'єм розчину калій
перманганату, що витратили на титрування
дорівнює 23,20 см3. Обчислити
масову частку FeSO4·7H2O у
зразку.
= 0,003161 г/см3) Об'єм розчину калій
перманганату, що витратили на титрування
дорівнює 23,20 см3. Обчислити
масову частку FeSO4·7H2O у
зразку.
Дано: mн.(FeSO4·7H2O) = = 0,7220 г = = 0,003161 г/см3 V(KMnO4) = 23,20 см3 W(FeSO4·7H2O) – ?
|
Рішення: Хімізм: 10FeSO4 + 2КМnО4 + 8H2SO4 → 5Fe2(SO4)3 +2MnSO4 + K2SO4 + 8H2O
З рівняння реакції вибігає, що: M(FeSO4·7Н2О) = 278,01 г/моль; М( KMnO4) = 31,61 г/моль
Відповідь: W(FeSO4·7H2O) = 89,34 % |
||||||