
- •Государственное образовательное учреждение высшего профессионального образования «Башкирский государственный медицинский университет
- •Руководство
- •060108 - Фармация
- •Оглавление
- •Введение
- •Правила работы с тестами
- •Модуль 1. Строение и функции белков. Биологические мембраны. Занятие 1. Введение в биохимический практикум. Методы качественного и количественного анализа белков.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний Задание 1. Выберите один наиболее правильный ответ:
- •1.2. Какие аминокислоты придают белкам основный характер?
- •3.1. Какие агенты позволяют определить n-концевую аминокислоту?
- •3.2. Какие агенты позволяют определить с-концевую аминокислоту?
- •3.3. Какие аминокислоты появляются в белках только в результате постсинтетической модификации?
- •4.1. При установлении аминокислотной последовательности проводится кислотный, а не основный гидролиз белка, так как в щелочной среде происходит разрушение некоторых аминокислот.
- •5.1. Установите последовательность операций при определении первичной структуры белка.
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Задача 3.
- •Работа 1. Разделение смеси аминокислот методом восходящей хроматографии на бумаге.
- •Работа 2. Количественное определение белка сыворотки крови биуретовым методом.
- •Фотоэлектроколориметр
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Методические указания к подготовке
- •Примеры тестов контроля исходного уровня знаний
- •2.2. Уровень организации белковой молекулы – ее структурный элемент.
- •4.1. Сернокислый аммоний вызывает денатурацию белка, потому что сернокислый аммоний обладает водоотнимающим действием с одновременной нейтрализацией электрического заряда.
- •4.2. Белки наиболее подвижны в электрическом поле в изоэлектрическом состоянии, потому что при этом белки имеют положительный заряд.
- •Работа 2. Осаждение белков при кипячении.
- •Работа 3. Осаждение белков солями тяжелых металлов.
- •Осаждение белков медным купоросом.
- •Осаждение белков уксуснокислым свинцом.
- •Работа 4. Осаждение белков органическими кислотами.
- •Работа 5. Осаждение белков концентрированной азотной кислотой (проба Геллера).
- •Работа 6. Количественное определение белка в моче по методу Робертса-Стольникова-Брандберга.
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Задача 3.
- •Занятие 3. Методы выделения и очистки белков.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •3.2. Какой метод разделения белков основан на различии размера белковых молекул?
- •3.3. Какие из электрофоретических процедур не зависят от заряда белка?
- •4.1. Очистить раствор белка от низкомолекулярных примесей можно методом гель-фильтрации на сефадексе, потому что с помощью этого метода можно разделить вещества с разной молекулярной массой.
- •4.2. По степени дисперсности растворы белков являются истинными растворами, а по свойствам – коллоидными, так как белки являются высокомолекулярными соединениями.
- •Порядок выполнения работы
- •Работа 2. Диск-электрофорез в полиакриламидном геле.
- •Работа 3. Очистка белков от низкомолекулярных примесей методом диализа.
- •Работа 4. Очистка от низкомолекулярных примесей методом гельфильтрации на сефадексе (молселекте).
- •Эталоны ответов к тестовым заданиям
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Как связывается гемоглобин с углекислым газом?
- •1.2. Какие гормоны по структуре являются гликопротеинами?
- •1.3. Избирательная проницаемость мембран достигается путем активного транспорта. Активный транспорт отличается от пассивного тем, что
- •3.1. Во многих гликопротеинах углеводный компонент соединяется к белку посредством гликозидной связи через
- •3.2. Протеогликановые комплексы (мукополисахариды) характеризуются
- •4.2. ТРнк участвует в синтезе белка, потому что она транспортирует иРнк.
- •Работа 2. Выделение муцина слюны и определение в нем углеводного компонента.
- •Работа 3. Выделение казеина из молока.
- •Работа 4. Определение липопротеинов низкой плотности (лпнп) в сыворотке крови турбидиметрическим методом.
- •Занятие 5. Зачетное занятие по модулю «Строение и функции белков. Биологические мембраны.»
- •Методические указания к самоподготовке
- •Контрольные вопросы по модулю «Строение и функции белков. Биологические мембраны.»
- •Модуль 2. Ферменты. Занятие 6. Общие свойства ферментов.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •3.1. Укажите, что отличает фермент от неорганического катализатора.
- •3.2.Для количественного определения глюкозы в сыворотке крови применяют ферменты:
- •3.3. Влияние рН на ход реакции, катализируемой ферментом, заключается в том, что
- •4.2. По химической структуре все ферменты без исключения являются белками, потому что рибозимы – класс биокатализаторов, являющихся по структуре рнк.
- •Работа 2. Специфичность ферментов.
- •Качественная реакция на крахмал
- •Реакция Фелинга
- •Работа 3. Термолабильность ферментов.
- •Порядок выполнения работы
- •Работа 4. Влияние реакции среды (оптимум рН) на действие ферментов слюны.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •2.2. Определите тип ингибирования
- •2.3. Типы ингибирования ферментов – определение понятия:
- •3.1. Лекарственные вещества-антиметаболиты являются
- •3.2. Как в фармации используются иммобилизованные ферменты?
- •3.3. В чем преимущества ферментного анализа перед химическим в фармпроизводстве?
- •4.1 При действии фосфакола уменьшается количество ацетилхолина в синаптической щели, потому что происходит фосфорилирование фосфаколом он –группы серина в активном центре холинэстеразы.
- •Задача 2.
- •Задача 3.
- •Методы количественного определения активности
- •Работа 3. Разделение изоферментов лактатдегидрогеназы сыворотки крови методом электрофореза в полиакриламидном геле (по Дитцу и Лубрано).
- •Работа 4. Определение активности щелочной фосфатазы в сыворотке крови по гидролизу n-нитрофенилфосфата.
- •Работа 5. Влияние активаторов и ингибиторов на активность амилазы слюны.
- •Работа 6. Конкурентное торможение сукцинатдегидрогеназной активности.
- •Модуль 3. Витамины. Биоэнергетика гетеротрофных и фотосинтезирующих организмов. Занятие 8. Витамины - незаменимые компоненты пищи. Качественные реакции на витамины.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •2.2. Сопоставьте химическое название витамина и название по проявлению недостаточности
- •3.1. Метаболизм витамина д заключается
- •3.2. Какие утверждения относительно витамина а являются верными?
- •3.3. Какие антивитамины используются с лечебной целью?
- •4.1. Витамин к участвует в постсинтетической модификации белков свертывания крови, потому что служит коферментом карбоксилирования остатков глутаминовой кислоты в составе этих белков.
- •4.2. Красномякотные овощи и фрукты богаты каротинами, потому что каротины являются провитаминами е.
- •4.3. При недостатке холина наблюдается накопление в печени нейтральных липидов, поскольку холин необходим для синтеза фосфолипидов. Примеры ситуационных задач
- •Работа 7. Качественная реакция на витамин в6.
- •Работа 8. Определение тиамина в поливитаминных препаратах.
- •Работа 9. Определение рибофлавина в поливитаминных препаратах.
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Задача 3.
- •Занятие 9. Коферментные формы витаминов и их роль в процессах метаболизма.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Какой витамин наиболее токсичен при гипервитаминозе?
- •1.2. Какое утверждение относительно витамина в12 является верным?
- •2.2. Витамин – антивитамин.
- •. Витамин-проявление недостаточности или авитаминоза.
- •2.4. Кофермент – класс фермента
- •3.1.Кофермент витамина в6 пиридоксальфосфат участвует
- •3.2. Какие утверждения относительно пернециозной анемии являются верными?
- •4.1.Отсутствие в пище незаменимой аминокислоты триптофан способствует развитию гиповитаминоза рр, потому что небольшая часть витамина рр в организме синтезируется из триптофана.
- •Задача 2.
- •Задача 3.
- •Самостоятельная работа студентов
- •Работа 1. Количественное определение аскорбиновой кислоты в лекарственных растениях по Тильмансу.
- •Работа 2. Количественное определение витамина р в чае по Левенталю.
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Задача 3.
- •Занятие 10. Энергетический обмен. Ферменты биологического окисления. Общие пути катаболизма.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний Задание 1. Выберите один наиболее правильный ответ.
- •3.1. Какие коферменты входят в состав пируватдегидрогеназного комплекса?
- •3.2. Примерами субстратного фосфорилирования являются реакции
- •3.3. Какие из перечисленных условий уменьшают скорость окисления ацетата в цтк?
- •4.1 В ходе цикла лимонной кислоты происходит окислительное декарбоксилирование пирувата, потому что цтк протекает в матриксе митохондрий.
- •Работа 2. Качественное определение активности сукцинатдегидрогеназы мышц.
- •Работа 3. Определение активности пероксидазы в растительном материале по методу а. Н. Бояркина.
- •Работа 4. Восстановление цитохрома с.
- •Работа 5. Обнаружение активности цитохромоксидазы.
- •Задача 3.
- •Занятие 11. Тканевое дыхание. Окислительное фосфорилирование. Свободное окисление – микросомальное, пероксисомальное (семинар).
- •Методические указания к самоподготовке
- •Примеры тестовых заданий Задание 1. Выберите один наиболее верный ответ.
- •Задание 2. Установите соответствие.
- •2.2 Тип реакции – уравнение реакции
- •2.3. Фермент – катализируемая реакция
- •3.2. Какие из перечисленных соединений обладают разобщающим действием?
- •Задача 2.
- •Задача 2.
- •Задача 3.
- •Занятие 12. Фотосинтез. Качественные реакции на пигменты растений.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •5. Переносчиками электронов в фс1 при нециклическом транспорте являются:
- •6. Указать процесс, который не относится к реакции световой фазы:
- •7. Компонентов акцепторной системы реакционного центра фс1:
- •8. Циклического потока электронов в фс1:
- •Самостоятельная работа студентов Работа 1. Качественные реакции на пигменты растений.
- •Модуль 4. Обмен и функции углеводов. Занятие 14. Обмен углеводов. Сахар крови. Регуляция сахара крови.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •2. 2. Установить соответствие:
- •Примеры ситуационных задач Задача 1.
- •Задача 3.
- •Самостоятельная работа студентов
- •Глюкозооксидазным методом.
- •Работа 2. Определение глюкозы в крови по цветной реакции с орто-толуидином.
- •Работа 3. Определение активности альфа-амилазы в сыворотке крови и моче.
- •Работа 4. Влияние адреналина на содержание глюкозы в крови.
- •Работа 5. Влияние инсулина на содержание глюкозы в крови.
- •Эталоны ответов к тестам
- •Эталоны ответов к ситуационным задачам Задача 1.
- •Задача 2.
- •Задача 3.
- •Занятие 15. Тканевый обмен углеводов. Регуляция обмена углеводов. (Семинар).
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Задача 2.
- •Задача 3.
- •Занятие 16. Зачётное занятие по модулю «Обмен и функции углеводов».
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Модуль 5. Обмен и функция липидов. Занятие 18. Обмен триацилглицеринов.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. К какому классу относятся ферменты, участвующие в расщеплении жиров в желудочно-кишечном тракте?
- •1.2. Высшие жирные кислоты образуются из всех перечисленных соединений, кроме:
- •Установить соответствие:
- •Самостоятельная работа студентов Работа 1. Количественное определение активности липазы в панкреатическом соке.
- •Работа 2. Количественное определение триацилглицеринов в сыворотке крови.
- •Работа 3. Реакция на кетоновые тела (ацетон).
- •Работа 4. Количественное определение суммарных липидов в сыворотке крови.
- •Эталоны ответов к тестам
- •Эталоны ответов к ситуационным задачам
- •Задача 2.
- •Задача 3.
- •Занятие 19. Обмен холестерина и фосфоглицеридов. Регуляция обмена липидов. Нарушения обмена липидов.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Донором метильных групп для синтеза фосфатидилхолина из фосфатидилэтанол-амина является:
- •1.2. В результате какой реакции образуется фосфатидная кислота:
- •2.1. Установить соответствие:
- •2.4. Установить соответствие:
- •Самостоятельная работа студентов Работа 1. Количественное определение содержания лецитина в сыворотке крови.
- •Работа 2. Количественное определение холестерина в сыворотке крови по методу Илька.
- •Эталоны ответов к тестам
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Задача 3.
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Модуль 6. Обмен аминокислот и белков. Занятие 21. Переваривание и всасывание белков. Протеолитические ферменты желудочно-кишечного тракта.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1 Трипсин гидролизует пептидные связи, образованные:
- •1.2. Пепсин – фермент, относящийся к классу:
- •2.1. Установить соответствие:
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов Работа 1. Проба на сычужное действие пепсина.
- •Работа 2. Определение активности пепсина и уропепсина.
- •Работа 3. Количественное определение активности уропепсина в моче по видоизмененному методу Веста.
- •Работа 4. Количественное определение протеолитической активности желудочного сока по Ансону.
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 22. Обмен и функции аминокислот.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Какой витамин входит в состав коферментов аминотрансфераз?
- •3.1. Какие метаболиты образуются при катаболизме указанных аминокислот?
- •3.2. Установите соответствие:
- •Незаменимые аминокислоты могут синтезироваться в организме, потому что их синтезирует флора кишечника.
- •При шизофрении нарушен обмен серотонина, потому что снижена активность дофа-декарбоксилазы. Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов Работа 1. Колориметрический метод определения активности аспартат- и аланин-аминотрансфераз в сыворотке крови.
- •Работа 2. Количественное определение остаточного азота в крови
- •Работа 3. Количественное определение мочевины в моче по Рашковану.
- •Работа 4. Определение содержания мочевины в сыворотке крови ферментативным методом.
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 23. Матричные синтезы: биосинтез нуклеиновых кислот и белка. (Семинар).
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1. Как соединяются между собой нуклеотиды?
- •2. Укажите название фермента, катализирующего синтез рнк-затравки:
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Занятие 24. Обмен нуклеопротеинов и нуклеотидов. Количественное определение мочевой кислоты в сыворотке крови.
- •Методические указания
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Примеры тестов контроля исходного уровня знаний
- •Самостоятельная работа студентов Работа 1. Определение содержания мочевой кислоты в сыворотке крови фосфорновольфрамовым методом.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны ответов ситуационных задач Задача 1.
- •Задача 2.
- •Занятие 25. Обмен хромопротеинов.
- •План занятия
- •Методические указания для самоподготовки
- •1. Превращение биливердина в билирубин катализирует фермент:
- •2. Обезвреживание билирубина в печени происходит при участии фермента:
- •3. Установить соответствие:
- •Самостоятельная работа студентов
- •По методу Йендрашека.
- •Работа 2. Проба на желчные пигменты в моче с реактивом Фуше.
- •Работа 5. Проба Флоренкса на уробилин (стеркобилин) в моче.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны ответов к ситуационным задачам Задача 1.
- •Занятие 26. Зачётное занятие по модулю «Обмен белков и аминокислот».
- •Методические указания к самоподготовке
- •Контрольные вопросы к коллоквиуму
- •Модуль 7. Интеграция и регуляция обмена веществ. Гормоны. Занятие 27. Взаимосвязь обмена веществ и его регуляция. Гормоны белковой природы. Качественные реакции на гормоны.
- •Методические указания к самоподготовке
- •Примеры ситуационных задач
- •Работа 4. Количественное определение адреналина в биологических жидкостях.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны ответов ситуационных задач Задача 1.
- •Задача 2.
- •Занятие 28. Стероидные гормоны. Тканевые гормоны. Простагландины.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний.
- •Примеры ситуационных задач
- •Работа 2. Качественное определение 17-кетостерондов в моче.
- •Работа 3. Количественное определение 17-кетостероидов в моче.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны ответов ситуационных задач Задача 1.
- •Задача 2.
- •Занятие 29. Зачетное занятие по модулю «Интеграция и регуляция обмена веществ. Гормоны».
- •Методические указания к самоподготовке
- •Контрольные вопросы к коллоквиуму
- •Модуль 8. Функциональная биохимия специализированных тканей и органов. Занятие 30. Биохимия крови.
- •Методические указания для самоподготовки
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Задача 3.
- •Примеры тестов контроля исходного уровня знаний.
- •Выберите наиболее часто встречающиеся причины возникновения железодефицитных анемий:
- •Какие ферменты участвуют в реакциях инактивации активных форм кислорода?
- •Креатинкиназа сыворотки крови относится к секреторным ферментам крови, потому что креатинкиназа секретируется в кровь из печени.
- •Самостоятельная работа студентов
- •Работа 1. Определение содержания гемоглобина в крови
- •Цианметгемоглобиновым методом.
- •Работа 2. Определение активности альфа-амилазы в сыворотке крови амилокластическим методом.
- •Работа 3. Определение щелочного резерва крови титриметрическим методом.
- •Работа 4. Метод определения кальция по цветной реакции с мурексидом в присутствии глицерина.
- •Работа 5. Определение времени свертывания крови (метод Мас и Магро).
- •Работа 6. Определение времени рекальцификации плазмы.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны тветов ситуационных задач
- •Задача 3.
- •Занятие 31. Биохимия специалированных тканей и органов.
- •Методические указания для самоподготовки
- •Примеры тестов контроля усвоения исходного уровня знаний
- •1. При какой желтухе возрастает содержание в крови прямого билирубина и активность алт?
- •2. Выберите процессы, обеспечивающие энергией интенсивно работающую мышцу.
- •4. Установить соответствие:
- •5. Какие процессы лежат в основе детоксикации ядовитых веществ в печени?
- •6. Какие из перечисленных процессов происходят только в печени?
- •Ситуационные задачи Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов
- •Работа 1. Пробы коллоидоустойчивости.
- •Работа 2. Количественное определение альдолазы в сыворотке крови (метод Брунса в модификации е.Н. Валуйской и в.И. Товарницкого).
- •Работа 3. Определение активности альдолазы фруктозо-1-монофосфата.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 32. Биохимия почек.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Самостоятельная работа студентов Работа 1. Определение показателей физико-химических свойств мочи.
- •Работа 2. Определение химических компонентов нормальной мочи.
- •Работа 3. Патологические компоненты мочи.
- •1. Качественное определение белка.
- •2. Качественное определение сахара в моче с помощью реактива Фелинга.
- •3. Качественное обнаружение сахара в моче при помощи индикаторной бумаги «Глюкотест».
- •4. Количественное определение белка в моче по методу Робертса-Стольникова.
- •5. Качественное определение кетоновых тел.
- •6. Качественная реакция на кровяные пигменты.
- •7. Качественное определение желчных пигментов.
- •8. Проба Петенкофера на желчные кислоты.
- •9. Проба Яффе - реакция на уробилин.
- •10. Качественное определение индикана в моче.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •1. Липотропные фармакопрепараты метаболизируются преимущественно с участием ферментов:
- •2. Первая фаза биотрансформации включает все перечисленные реакции,
- •3. Установить соответствие:
- •4. Установить локализацию реакции биотрансформации:
- •Самостоятельная работа студентов Работа 1.Определение активности монооксигеназ эндоплазматической сети клеток печени по выделению метаболитов амидопирина с мочой.
- •Работа 2. Определение активности алкогольдегидрогеназы в сыворотке крови.
- •Эталоны ответы на тесты контроля исходного уровня знаний
- •Занятие 34. Биотрансформация лекарственных веществ. Реакции второй фазы биотрансформации.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Самостоятельная работа студентов Работа 1. Определение ацетилирующей способности организма по выделению с мочой свободной и ацетилированной форм сульфаниламидов.
- •Работа 2. Выявление ацетилирования (инактивации) гидразида изоникотиновой кислоты (гинк) в организме.
- •Работа 3. Проба Квика—Пытеля.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Занятие 35. Зачетное занятие по модулю «Фармацевтическая биохимия».
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Приложения
- •Рекомендуемая литература
- •Журналы по биохимии
- •Некоторые биохимические показатели жидких сред организма
- •Вопросы к зачету по биохимии для 2 курса фармацевтического факультета
- •Контрольные вопросы к коллоквиуму «Функциональная биохимия»
Эталоны ответов к тестовым заданиям
1.1.– в (продукт димеризации мочевины – биурет, также содержит фрагмент NH-CO, дающий хелатный комплекс с сульфатом меди);
1.2. – в;
1.3. –в (-углеродный атом карбонильный углеродамидный азот-углеродный атом);
2.1. – 1,9,10 – б; 2-д;3-в; 4,6 – г; 5,7,8 – а;
2.2. – 1,2,4 – а; 3 – б;
2.3. - 1-а; 2-в; 3-б, в, г, д;
3.1. – В; 3.2 – Б; 3.3 –В;
4.1. - А; 4.2-А;
5. - 2-3-1-4.
Эталоны ответов на ситуационные задачи Задача 1.
Ответ. Протеолитические ферменты действуют избирательно. Трипсин гидролизует связи, образованные карбоксильной группой аргинина и лизина, химотрипсин - карбоксильной группой ароматических аминокислот, карбоксипептидаза отщепляет С-концевую аминокислоту (о специфичности протеиназ см. также занятие №21). Следовательно, после обработки карбоксипептидазой образуются свободный аргинин и пептид состава Арг-Про-Про-Гли-Фен-Сер-Про-Фен;
обработка химотрипсином высвободит пептиды Арг-Про-Про-Гли-Фен и Сер-Про-Фен, а также свободный С-концевой аргинин;
обработка трипсином – свободный аргинин и пептид Про-Про-Гли-Фен-Сер-Про-Фен-Арг.
Динитрофторбензол отщепит N-концевой аргинин, после чего образуется пептид состава – Про-Про-Гли-Фен-Сер-Про-Фен-Арг
Задача 2.
Ответ. Нингидрин является специфичным реагентом для -аминокислот, тогда как пролин и оксипролин являются иминокислотами. С -аминокислотами нингидрин реагирует по следующей схеме:
нингидрин α - аминокислота
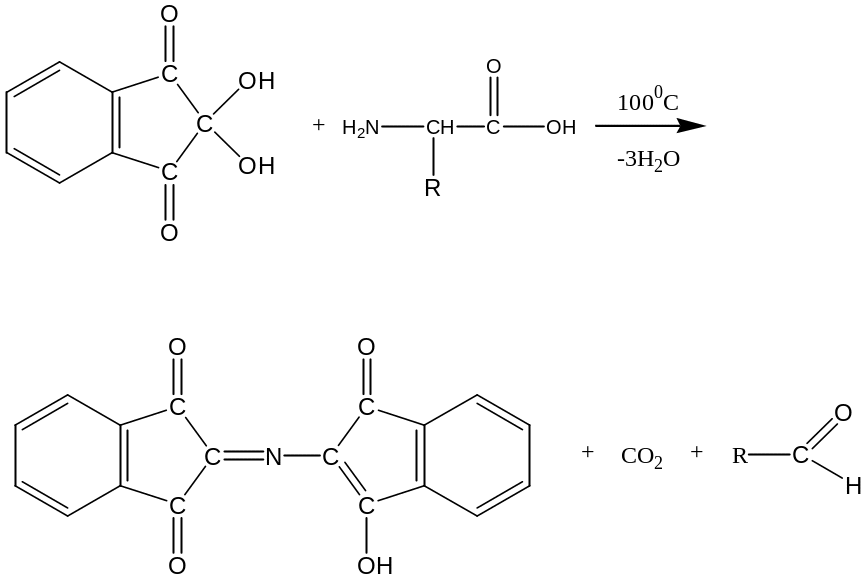
продукт реакции сине-фиолетового цвета альдегид
(светопоглощение в области 550-570 нм)
Задача 3.
Ответ (см. комментарии к задаче 1). Первичная структура β-эндорфина Тир-гли-гли-фен-мет-тре-сер-глу-лиз-сер-глн-тре-про-лей-вал-тре-лей-фен-лиз-асн-ала-илей-вал-лиз-асн-ала-гис-лиз-лиз-гли-глн.
Занятие 2. Физико-химические свойства белков.
Цель занятия. Изучить физико-химические свойства белков и овладеть некоторыми методами их анализа, используемыми в диагностических и препаративных целях. В результате освоения темы студент должен научиться разделять белки методом высаливания, количественно определять содержание белка в моче по Робертсу-Стольникову и интерпретировать результаты.
Содержание занятия. На этом занятии студентам предстоит ответить на вопросы тест-контроля и вопросы преподавателя, провести фракционирование белков сыворотки крови методом высаливания; осаждение белков под действием температуры, органических и минеральных кислот, солей тяжелых металлов и количественное определение содержание белка в моче по методу Робертса-Стольникова-Брандберга; проанализировать полученные данные и сделать соответствующие выводы.
УИРС. Решение ситуационных задач. Обсуждение реферативных сообщений по следующим темам:
Белки-шапероны и третичная структура белков. Прионовые болезни.
Современные методы технологии белков в производстве препаратов инсулина.
Методические указания к подготовке
При подготовке к занятию следует повторить структуры белка, вспомнить типы связей, стабилизирующие первичную, вторичную и третичную структуры белков. Необходимо изучить обратимые и необратимые методы осаждения белков, их амфотерные и электрические свойства. Знание физико-химических свойств белков имеет большое значение для изучения всего курса биохимии, а также фармакологии, фармацевтической химии, технологии и биотехнологии. Для успешного усвоения материала при подготовке к занятию, пользуясь учебником и лекциями и по биохимии, дополнительной литературой, выполните следующие задания.
Таблица 4
№ п/п |
Задание |
Методические указания к заданию |
1. |
Изучите биологическую роль белка. |
1. Выпишите основные биологические функции, которые выполняют белки в организме человека и животных. |
2. |
Вспомните современные представления о структуре белка. |
1. Напишите схематически типы химических и физических связей, участвующих в образовании белковой молекулы. 2.Охарактеризуйте, какие связи участвуют в образовании первичной, вторичной, третичной и четвертичной структуры белка. 3. Что такое фолдинг белка? Роль шаперонов, белков теплового шока в формировании и поддержании нативной конформации белков, прионовые болезни. |
3. |
Изучите растворимость и осаждаемость белков. |
1. Перечислите факторы, определяющие растворимость белков. 2. Приведите два основных фактора стабилизации белка в растворе. 3. В чем суть явления высаливания. 4. Приведите примеры практического использования высаливания. 5. Дайте определение явлению денатурации. Приведите классификацию видов денатурации. 6 .Объясните механизм денатурирующего действия температуры, солей тяжелых металлов, спирта. 7. Приведите примеры практического использования денатурации белков. |
4. |
Изучите электрические свойства белков. |
1.Докажите амфотерные свойства белков. 2.Напишите схему диссоциации карбоксильной группы и аминогруппы в составе белка. 3.Выпишите два основных фактора, определяющих заряд белковой молекулы. 4.Напишите, что называется изоэлектрической точкой. |
Выпишите кратко принцип метода и технику работ, выполняемых на лабораторном занятии. При этом не забывайте оставлять места для выводов и расчётов.
