
- •Государственное образовательное учреждение высшего профессионального образования «Башкирский государственный медицинский университет
- •Руководство
- •060108 - Фармация
- •Оглавление
- •Введение
- •Правила работы с тестами
- •Модуль 1. Строение и функции белков. Биологические мембраны. Занятие 1. Введение в биохимический практикум. Методы качественного и количественного анализа белков.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний Задание 1. Выберите один наиболее правильный ответ:
- •1.2. Какие аминокислоты придают белкам основный характер?
- •3.1. Какие агенты позволяют определить n-концевую аминокислоту?
- •3.2. Какие агенты позволяют определить с-концевую аминокислоту?
- •3.3. Какие аминокислоты появляются в белках только в результате постсинтетической модификации?
- •4.1. При установлении аминокислотной последовательности проводится кислотный, а не основный гидролиз белка, так как в щелочной среде происходит разрушение некоторых аминокислот.
- •5.1. Установите последовательность операций при определении первичной структуры белка.
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Задача 3.
- •Работа 1. Разделение смеси аминокислот методом восходящей хроматографии на бумаге.
- •Работа 2. Количественное определение белка сыворотки крови биуретовым методом.
- •Фотоэлектроколориметр
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Методические указания к подготовке
- •Примеры тестов контроля исходного уровня знаний
- •2.2. Уровень организации белковой молекулы – ее структурный элемент.
- •4.1. Сернокислый аммоний вызывает денатурацию белка, потому что сернокислый аммоний обладает водоотнимающим действием с одновременной нейтрализацией электрического заряда.
- •4.2. Белки наиболее подвижны в электрическом поле в изоэлектрическом состоянии, потому что при этом белки имеют положительный заряд.
- •Работа 2. Осаждение белков при кипячении.
- •Работа 3. Осаждение белков солями тяжелых металлов.
- •Осаждение белков медным купоросом.
- •Осаждение белков уксуснокислым свинцом.
- •Работа 4. Осаждение белков органическими кислотами.
- •Работа 5. Осаждение белков концентрированной азотной кислотой (проба Геллера).
- •Работа 6. Количественное определение белка в моче по методу Робертса-Стольникова-Брандберга.
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Задача 3.
- •Занятие 3. Методы выделения и очистки белков.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •3.2. Какой метод разделения белков основан на различии размера белковых молекул?
- •3.3. Какие из электрофоретических процедур не зависят от заряда белка?
- •4.1. Очистить раствор белка от низкомолекулярных примесей можно методом гель-фильтрации на сефадексе, потому что с помощью этого метода можно разделить вещества с разной молекулярной массой.
- •4.2. По степени дисперсности растворы белков являются истинными растворами, а по свойствам – коллоидными, так как белки являются высокомолекулярными соединениями.
- •Порядок выполнения работы
- •Работа 2. Диск-электрофорез в полиакриламидном геле.
- •Работа 3. Очистка белков от низкомолекулярных примесей методом диализа.
- •Работа 4. Очистка от низкомолекулярных примесей методом гельфильтрации на сефадексе (молселекте).
- •Эталоны ответов к тестовым заданиям
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Как связывается гемоглобин с углекислым газом?
- •1.2. Какие гормоны по структуре являются гликопротеинами?
- •1.3. Избирательная проницаемость мембран достигается путем активного транспорта. Активный транспорт отличается от пассивного тем, что
- •3.1. Во многих гликопротеинах углеводный компонент соединяется к белку посредством гликозидной связи через
- •3.2. Протеогликановые комплексы (мукополисахариды) характеризуются
- •4.2. ТРнк участвует в синтезе белка, потому что она транспортирует иРнк.
- •Работа 2. Выделение муцина слюны и определение в нем углеводного компонента.
- •Работа 3. Выделение казеина из молока.
- •Работа 4. Определение липопротеинов низкой плотности (лпнп) в сыворотке крови турбидиметрическим методом.
- •Занятие 5. Зачетное занятие по модулю «Строение и функции белков. Биологические мембраны.»
- •Методические указания к самоподготовке
- •Контрольные вопросы по модулю «Строение и функции белков. Биологические мембраны.»
- •Модуль 2. Ферменты. Занятие 6. Общие свойства ферментов.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •3.1. Укажите, что отличает фермент от неорганического катализатора.
- •3.2.Для количественного определения глюкозы в сыворотке крови применяют ферменты:
- •3.3. Влияние рН на ход реакции, катализируемой ферментом, заключается в том, что
- •4.2. По химической структуре все ферменты без исключения являются белками, потому что рибозимы – класс биокатализаторов, являющихся по структуре рнк.
- •Работа 2. Специфичность ферментов.
- •Качественная реакция на крахмал
- •Реакция Фелинга
- •Работа 3. Термолабильность ферментов.
- •Порядок выполнения работы
- •Работа 4. Влияние реакции среды (оптимум рН) на действие ферментов слюны.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •2.2. Определите тип ингибирования
- •2.3. Типы ингибирования ферментов – определение понятия:
- •3.1. Лекарственные вещества-антиметаболиты являются
- •3.2. Как в фармации используются иммобилизованные ферменты?
- •3.3. В чем преимущества ферментного анализа перед химическим в фармпроизводстве?
- •4.1 При действии фосфакола уменьшается количество ацетилхолина в синаптической щели, потому что происходит фосфорилирование фосфаколом он –группы серина в активном центре холинэстеразы.
- •Задача 2.
- •Задача 3.
- •Методы количественного определения активности
- •Работа 3. Разделение изоферментов лактатдегидрогеназы сыворотки крови методом электрофореза в полиакриламидном геле (по Дитцу и Лубрано).
- •Работа 4. Определение активности щелочной фосфатазы в сыворотке крови по гидролизу n-нитрофенилфосфата.
- •Работа 5. Влияние активаторов и ингибиторов на активность амилазы слюны.
- •Работа 6. Конкурентное торможение сукцинатдегидрогеназной активности.
- •Модуль 3. Витамины. Биоэнергетика гетеротрофных и фотосинтезирующих организмов. Занятие 8. Витамины - незаменимые компоненты пищи. Качественные реакции на витамины.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •2.2. Сопоставьте химическое название витамина и название по проявлению недостаточности
- •3.1. Метаболизм витамина д заключается
- •3.2. Какие утверждения относительно витамина а являются верными?
- •3.3. Какие антивитамины используются с лечебной целью?
- •4.1. Витамин к участвует в постсинтетической модификации белков свертывания крови, потому что служит коферментом карбоксилирования остатков глутаминовой кислоты в составе этих белков.
- •4.2. Красномякотные овощи и фрукты богаты каротинами, потому что каротины являются провитаминами е.
- •4.3. При недостатке холина наблюдается накопление в печени нейтральных липидов, поскольку холин необходим для синтеза фосфолипидов. Примеры ситуационных задач
- •Работа 7. Качественная реакция на витамин в6.
- •Работа 8. Определение тиамина в поливитаминных препаратах.
- •Работа 9. Определение рибофлавина в поливитаминных препаратах.
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Задача 3.
- •Занятие 9. Коферментные формы витаминов и их роль в процессах метаболизма.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Какой витамин наиболее токсичен при гипервитаминозе?
- •1.2. Какое утверждение относительно витамина в12 является верным?
- •2.2. Витамин – антивитамин.
- •. Витамин-проявление недостаточности или авитаминоза.
- •2.4. Кофермент – класс фермента
- •3.1.Кофермент витамина в6 пиридоксальфосфат участвует
- •3.2. Какие утверждения относительно пернециозной анемии являются верными?
- •4.1.Отсутствие в пище незаменимой аминокислоты триптофан способствует развитию гиповитаминоза рр, потому что небольшая часть витамина рр в организме синтезируется из триптофана.
- •Задача 2.
- •Задача 3.
- •Самостоятельная работа студентов
- •Работа 1. Количественное определение аскорбиновой кислоты в лекарственных растениях по Тильмансу.
- •Работа 2. Количественное определение витамина р в чае по Левенталю.
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Задача 3.
- •Занятие 10. Энергетический обмен. Ферменты биологического окисления. Общие пути катаболизма.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний Задание 1. Выберите один наиболее правильный ответ.
- •3.1. Какие коферменты входят в состав пируватдегидрогеназного комплекса?
- •3.2. Примерами субстратного фосфорилирования являются реакции
- •3.3. Какие из перечисленных условий уменьшают скорость окисления ацетата в цтк?
- •4.1 В ходе цикла лимонной кислоты происходит окислительное декарбоксилирование пирувата, потому что цтк протекает в матриксе митохондрий.
- •Работа 2. Качественное определение активности сукцинатдегидрогеназы мышц.
- •Работа 3. Определение активности пероксидазы в растительном материале по методу а. Н. Бояркина.
- •Работа 4. Восстановление цитохрома с.
- •Работа 5. Обнаружение активности цитохромоксидазы.
- •Задача 3.
- •Занятие 11. Тканевое дыхание. Окислительное фосфорилирование. Свободное окисление – микросомальное, пероксисомальное (семинар).
- •Методические указания к самоподготовке
- •Примеры тестовых заданий Задание 1. Выберите один наиболее верный ответ.
- •Задание 2. Установите соответствие.
- •2.2 Тип реакции – уравнение реакции
- •2.3. Фермент – катализируемая реакция
- •3.2. Какие из перечисленных соединений обладают разобщающим действием?
- •Задача 2.
- •Задача 2.
- •Задача 3.
- •Занятие 12. Фотосинтез. Качественные реакции на пигменты растений.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •5. Переносчиками электронов в фс1 при нециклическом транспорте являются:
- •6. Указать процесс, который не относится к реакции световой фазы:
- •7. Компонентов акцепторной системы реакционного центра фс1:
- •8. Циклического потока электронов в фс1:
- •Самостоятельная работа студентов Работа 1. Качественные реакции на пигменты растений.
- •Модуль 4. Обмен и функции углеводов. Занятие 14. Обмен углеводов. Сахар крови. Регуляция сахара крови.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •2. 2. Установить соответствие:
- •Примеры ситуационных задач Задача 1.
- •Задача 3.
- •Самостоятельная работа студентов
- •Глюкозооксидазным методом.
- •Работа 2. Определение глюкозы в крови по цветной реакции с орто-толуидином.
- •Работа 3. Определение активности альфа-амилазы в сыворотке крови и моче.
- •Работа 4. Влияние адреналина на содержание глюкозы в крови.
- •Работа 5. Влияние инсулина на содержание глюкозы в крови.
- •Эталоны ответов к тестам
- •Эталоны ответов к ситуационным задачам Задача 1.
- •Задача 2.
- •Задача 3.
- •Занятие 15. Тканевый обмен углеводов. Регуляция обмена углеводов. (Семинар).
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Задача 2.
- •Задача 3.
- •Занятие 16. Зачётное занятие по модулю «Обмен и функции углеводов».
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Модуль 5. Обмен и функция липидов. Занятие 18. Обмен триацилглицеринов.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. К какому классу относятся ферменты, участвующие в расщеплении жиров в желудочно-кишечном тракте?
- •1.2. Высшие жирные кислоты образуются из всех перечисленных соединений, кроме:
- •Установить соответствие:
- •Самостоятельная работа студентов Работа 1. Количественное определение активности липазы в панкреатическом соке.
- •Работа 2. Количественное определение триацилглицеринов в сыворотке крови.
- •Работа 3. Реакция на кетоновые тела (ацетон).
- •Работа 4. Количественное определение суммарных липидов в сыворотке крови.
- •Эталоны ответов к тестам
- •Эталоны ответов к ситуационным задачам
- •Задача 2.
- •Задача 3.
- •Занятие 19. Обмен холестерина и фосфоглицеридов. Регуляция обмена липидов. Нарушения обмена липидов.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Донором метильных групп для синтеза фосфатидилхолина из фосфатидилэтанол-амина является:
- •1.2. В результате какой реакции образуется фосфатидная кислота:
- •2.1. Установить соответствие:
- •2.4. Установить соответствие:
- •Самостоятельная работа студентов Работа 1. Количественное определение содержания лецитина в сыворотке крови.
- •Работа 2. Количественное определение холестерина в сыворотке крови по методу Илька.
- •Эталоны ответов к тестам
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Задача 3.
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Модуль 6. Обмен аминокислот и белков. Занятие 21. Переваривание и всасывание белков. Протеолитические ферменты желудочно-кишечного тракта.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1 Трипсин гидролизует пептидные связи, образованные:
- •1.2. Пепсин – фермент, относящийся к классу:
- •2.1. Установить соответствие:
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов Работа 1. Проба на сычужное действие пепсина.
- •Работа 2. Определение активности пепсина и уропепсина.
- •Работа 3. Количественное определение активности уропепсина в моче по видоизмененному методу Веста.
- •Работа 4. Количественное определение протеолитической активности желудочного сока по Ансону.
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 22. Обмен и функции аминокислот.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Какой витамин входит в состав коферментов аминотрансфераз?
- •3.1. Какие метаболиты образуются при катаболизме указанных аминокислот?
- •3.2. Установите соответствие:
- •Незаменимые аминокислоты могут синтезироваться в организме, потому что их синтезирует флора кишечника.
- •При шизофрении нарушен обмен серотонина, потому что снижена активность дофа-декарбоксилазы. Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов Работа 1. Колориметрический метод определения активности аспартат- и аланин-аминотрансфераз в сыворотке крови.
- •Работа 2. Количественное определение остаточного азота в крови
- •Работа 3. Количественное определение мочевины в моче по Рашковану.
- •Работа 4. Определение содержания мочевины в сыворотке крови ферментативным методом.
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 23. Матричные синтезы: биосинтез нуклеиновых кислот и белка. (Семинар).
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1. Как соединяются между собой нуклеотиды?
- •2. Укажите название фермента, катализирующего синтез рнк-затравки:
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Занятие 24. Обмен нуклеопротеинов и нуклеотидов. Количественное определение мочевой кислоты в сыворотке крови.
- •Методические указания
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Примеры тестов контроля исходного уровня знаний
- •Самостоятельная работа студентов Работа 1. Определение содержания мочевой кислоты в сыворотке крови фосфорновольфрамовым методом.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны ответов ситуационных задач Задача 1.
- •Задача 2.
- •Занятие 25. Обмен хромопротеинов.
- •План занятия
- •Методические указания для самоподготовки
- •1. Превращение биливердина в билирубин катализирует фермент:
- •2. Обезвреживание билирубина в печени происходит при участии фермента:
- •3. Установить соответствие:
- •Самостоятельная работа студентов
- •По методу Йендрашека.
- •Работа 2. Проба на желчные пигменты в моче с реактивом Фуше.
- •Работа 5. Проба Флоренкса на уробилин (стеркобилин) в моче.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны ответов к ситуационным задачам Задача 1.
- •Занятие 26. Зачётное занятие по модулю «Обмен белков и аминокислот».
- •Методические указания к самоподготовке
- •Контрольные вопросы к коллоквиуму
- •Модуль 7. Интеграция и регуляция обмена веществ. Гормоны. Занятие 27. Взаимосвязь обмена веществ и его регуляция. Гормоны белковой природы. Качественные реакции на гормоны.
- •Методические указания к самоподготовке
- •Примеры ситуационных задач
- •Работа 4. Количественное определение адреналина в биологических жидкостях.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны ответов ситуационных задач Задача 1.
- •Задача 2.
- •Занятие 28. Стероидные гормоны. Тканевые гормоны. Простагландины.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний.
- •Примеры ситуационных задач
- •Работа 2. Качественное определение 17-кетостерондов в моче.
- •Работа 3. Количественное определение 17-кетостероидов в моче.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны ответов ситуационных задач Задача 1.
- •Задача 2.
- •Занятие 29. Зачетное занятие по модулю «Интеграция и регуляция обмена веществ. Гормоны».
- •Методические указания к самоподготовке
- •Контрольные вопросы к коллоквиуму
- •Модуль 8. Функциональная биохимия специализированных тканей и органов. Занятие 30. Биохимия крови.
- •Методические указания для самоподготовки
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Задача 3.
- •Примеры тестов контроля исходного уровня знаний.
- •Выберите наиболее часто встречающиеся причины возникновения железодефицитных анемий:
- •Какие ферменты участвуют в реакциях инактивации активных форм кислорода?
- •Креатинкиназа сыворотки крови относится к секреторным ферментам крови, потому что креатинкиназа секретируется в кровь из печени.
- •Самостоятельная работа студентов
- •Работа 1. Определение содержания гемоглобина в крови
- •Цианметгемоглобиновым методом.
- •Работа 2. Определение активности альфа-амилазы в сыворотке крови амилокластическим методом.
- •Работа 3. Определение щелочного резерва крови титриметрическим методом.
- •Работа 4. Метод определения кальция по цветной реакции с мурексидом в присутствии глицерина.
- •Работа 5. Определение времени свертывания крови (метод Мас и Магро).
- •Работа 6. Определение времени рекальцификации плазмы.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны тветов ситуационных задач
- •Задача 3.
- •Занятие 31. Биохимия специалированных тканей и органов.
- •Методические указания для самоподготовки
- •Примеры тестов контроля усвоения исходного уровня знаний
- •1. При какой желтухе возрастает содержание в крови прямого билирубина и активность алт?
- •2. Выберите процессы, обеспечивающие энергией интенсивно работающую мышцу.
- •4. Установить соответствие:
- •5. Какие процессы лежат в основе детоксикации ядовитых веществ в печени?
- •6. Какие из перечисленных процессов происходят только в печени?
- •Ситуационные задачи Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов
- •Работа 1. Пробы коллоидоустойчивости.
- •Работа 2. Количественное определение альдолазы в сыворотке крови (метод Брунса в модификации е.Н. Валуйской и в.И. Товарницкого).
- •Работа 3. Определение активности альдолазы фруктозо-1-монофосфата.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 32. Биохимия почек.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Самостоятельная работа студентов Работа 1. Определение показателей физико-химических свойств мочи.
- •Работа 2. Определение химических компонентов нормальной мочи.
- •Работа 3. Патологические компоненты мочи.
- •1. Качественное определение белка.
- •2. Качественное определение сахара в моче с помощью реактива Фелинга.
- •3. Качественное обнаружение сахара в моче при помощи индикаторной бумаги «Глюкотест».
- •4. Количественное определение белка в моче по методу Робертса-Стольникова.
- •5. Качественное определение кетоновых тел.
- •6. Качественная реакция на кровяные пигменты.
- •7. Качественное определение желчных пигментов.
- •8. Проба Петенкофера на желчные кислоты.
- •9. Проба Яффе - реакция на уробилин.
- •10. Качественное определение индикана в моче.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •1. Липотропные фармакопрепараты метаболизируются преимущественно с участием ферментов:
- •2. Первая фаза биотрансформации включает все перечисленные реакции,
- •3. Установить соответствие:
- •4. Установить локализацию реакции биотрансформации:
- •Самостоятельная работа студентов Работа 1.Определение активности монооксигеназ эндоплазматической сети клеток печени по выделению метаболитов амидопирина с мочой.
- •Работа 2. Определение активности алкогольдегидрогеназы в сыворотке крови.
- •Эталоны ответы на тесты контроля исходного уровня знаний
- •Занятие 34. Биотрансформация лекарственных веществ. Реакции второй фазы биотрансформации.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Самостоятельная работа студентов Работа 1. Определение ацетилирующей способности организма по выделению с мочой свободной и ацетилированной форм сульфаниламидов.
- •Работа 2. Выявление ацетилирования (инактивации) гидразида изоникотиновой кислоты (гинк) в организме.
- •Работа 3. Проба Квика—Пытеля.
- •Эталоны ответов на тесты контроля исходного уровня знаний
- •Занятие 35. Зачетное занятие по модулю «Фармацевтическая биохимия».
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Приложения
- •Рекомендуемая литература
- •Журналы по биохимии
- •Некоторые биохимические показатели жидких сред организма
- •Вопросы к зачету по биохимии для 2 курса фармацевтического факультета
- •Контрольные вопросы к коллоквиуму «Функциональная биохимия»
3.2. Как в фармации используются иммобилизованные ферменты?
В автоматическом анализе биосубстратов и лекарственных веществ
В иммуноферментном анализе
В синтезе лекарств в химико-фармацевтической промышленности
В генно-инженерной биотехнологии лекарственных средств
В биотехнологии иммунопрепаратов
3.3. В чем преимущества ферментного анализа перед химическим в фармпроизводстве?
безвредность
высокая специфичность
применение небольшого количества реактивов
низкая специфичность
применение большого количества реактивов
Задание 4. Определите правильность утверждений в предложении и установите
наличие причинной связи между ними. Утверждения разделены союзом
«потому что».
Выберите А, если оба утверждения верны и логически взаимосвязаны
Б, если утверждения верны, но не взаимосвязаны
В, если верно только первое утверждение
Г, если верно только второе утверждение
Д, если оба утверждения не верны
4.1 При действии фосфакола уменьшается количество ацетилхолина в синаптической щели, потому что происходит фосфорилирование фосфаколом он –группы серина в активном центре холинэстеразы.
4.2 Активность ферментов в присутствии ингибиторов может быть снижена, потому что в присутствии конкурентных ингибиторов возникают конформационные изменения молекул ферментов.
Примеры ситуационных задач
Задача 1.
Проанализируйте данные экспериментов по определению скорости ферментативной реакции при различных концентрациях субстрата, а также в присутствии ингибитора. По имеющимся данным постройте график Лайнуивера–Берка, определите Кm фермента и тип ингибирования.
Таблица 15
Концентрация субстрата, М |
Скорость реакции, мкмоль/мин |
Скорость в присутствии ингибитора, мкмоль/мин |
610-6 110-5 210-5 610-5 1,810-4 |
20,8 29 45 67,6 87 |
4,2 5,8 9 13,6 16,2 |
Задача 2.
Фермент (10мкг) с молекулярной массой 500000 г/моль превращает 9,6 мкмоль субстрата в минуту при t 25С. Подсчитайте число оборотов.
Задача 3.
Сколько граммов субстрата с молекулярной массой 672 г/моль может преобразовать фермент, если его активность составляет 5нКат, а время инкубации – 20 сек.
Задача 4.
Проанализируте график Лайнувивера-Берка. Определите Кm, Vmax, и тип ингибирования.
|
|
Самостоятельная работа студентов
Методы количественного определения активности
некоторых ферментов
Работа 1. Количественное определение активности амилазы слюны
по Вольгемуту.
Амилаза (диастаза)- фермент, осуществляющий гидролитическое расщепление полисахаридов до декстринов и мальтозы (химизм реакции см. занятие№6). Конечные продукты действия амилазы не дают цветной реакции с йодом. Наиболее богаты амилазой слюнные и поджелудочная железы. Амилаза содержится также и в крови, куда попадает, главным образом, из поджелудочной железы.
Принцип метода. Метод основан на том, что слюну разводят в определенной последовательности, после чего приливают одно и тоже количество раствора крахмала и находят наименьшее содержание фермента, которое полностью расщепляет все количество добавленного крахмала. Затем производят перерасчет активности фермента на 1 мл слюны.
Амилазная активность слюны или амилокластичекая сила слюны выражается количеством 0,1% раствора крахмала в мл, которое может расщепляться 1 мл слюны при температуре 380 в течении 30 мин.
В норме амилазная активность слюны составляет 160-320 ед.
Ход работы. В 10 пронумерованных пробирок наливают по 1 мл воды. В 1 пробирку добавляют 1 мл слюны, разведенной в 10 раз. Содержимое пробирки перемешивают и 1 мл раствора переносят из 1 пробирки во 2, перемешивают и из второй – таким же образом в 3 и т.д. до 10 пробирки. Из 10 пробирки 1 мл смеси выливают. Таким образом, получается ряд разведенной слюны, в котором в каждой последующей пробирки содержится фермент вдвое меньше, чем в предыдущей.
Во все пробирки добавляют по 1 мл воды и по 2 мл 0,1% раствора крахмала, перемешивают и помещают пробирки в термостат на 30 мин при температуре 380.
Через 30 минут пробирки вынимают, охлаждают, добавляют по 1-2 капле 1% раствора йода и перемешивают. Жидкость в пробирках в зависимости от степени расщепления крахмала может окрашиваться в желтый, розовый, красный и фиолетовый цвет. Раствор желтого цвета свидетельствует о полном расщеплении крахмала, фиолетовый – о том, что крахмал в растворе еще сохранился.
Работу необходимо оформить в виде табл. 16.
Таблица 16
Разведение слюны Кол-во 0,1% крахмала Окрашивание йодом Амилокластическая активность слюны |
№ пробирки |
||||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
|||||||||
Расчет. Берется количество слюны в последней пробирке с желтой окраской. Если это четвертая пробирка, то разведение слюны в ней – 160 раз. Составляется пропорция: 1). 160 мл слюны расщепляет 2 мл 0,1% р-ра крахмала; 2) 1 мл слюны расщепляет Х мл 0,1% р-ра крахмала.
Работа 2. Фотоколориметрический метод исследования активности
лактатдегидрогеназы в сыворотке крови по Севелу и Товареку.
Принцип метода. Метод основан на определении скорости образования пирувата в ходе окисления лактата с участием лактатдегидрогеназы сыворотки крови. Пируват с 2,4- динитрофенилгидразином образует соответствующий гидразон, имеющий красно-бурое окрашивание в щелочной среде, интенсивность которого прямо пропорциональна содержанию кетокислоты:
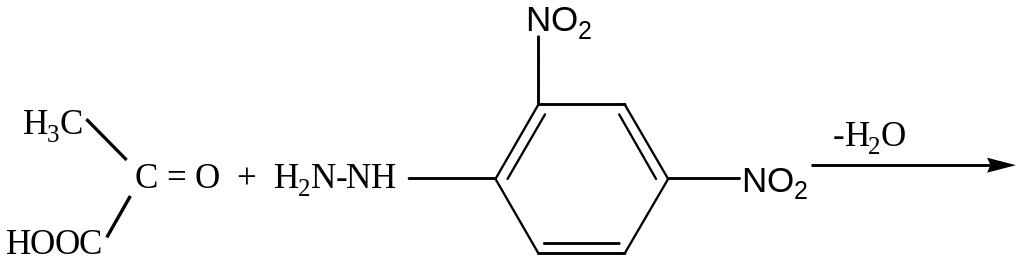
пвк 2,4-динитрофенолгидразин
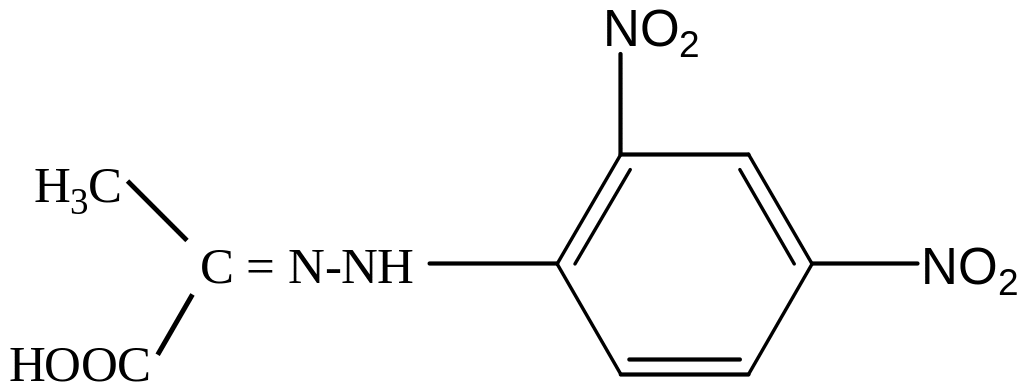 2,4-динитрофенолгидразон
ПВК
2,4-динитрофенолгидразон
ПВК
Ход определения. Сыворотку крови разводят в 3 раза дистиллированной водой. Вносят в пробирку 0,1 мл разведенной сыворотки, 0,3 мл раствора НАД + и ставят на 5 мин в водяную баню при 370С (для прогревания смеси).
Во вторую пробирку добавляют 0,8 мл раствора пирофосфата натрия и 0,2 мл раствора лактата натрия и нагревают на водяной бане при 370С.
Выливают содержимое второй пробирки в первую, быстро перемешивают стеклянной палочкой, не вынимая пробирки из бани, и отмечают время начала инкубации. Через 25 мин реакцию останавливают, прибавляя 0,5 мл раствора 2,4-ДНФГ, и оставляют пробирку на 20 мин при комнатной температуре (для образования гидразона).
К смеси приливают 5 мл раствора гидроксида натрия, содержимое перемешивают стеклянной палочкой и через 10 мин (после развития окраски) измеряют экстинкцию опытной пробы против контрольной на ФЭКе при длине волны 520-560 нм (светофильтр зеленый) в кювете с толщиной слоя 1см. Контрольную пробу готовят как опытную, но разведенную сыворотку добавляют после инкубации.
Расчет. Активность фермента рассчитывают по калибровочному графику.
Оформление работы. Рассчитать активность фермента в исследуемой сыворотке крови, сделать вывод о возможных причинах изменений активности фермента.
Практическое значение работы. Определение активности лактатдегидрогеназы используется в клинико-биохимических лабораториях для диагностики и установления прогноза заболевания. В норме активность фермента составляет 0,8- 4,0 ммоль/ (ч л) и возрастает, как правило, у больных с повреждением миокарда, скелетных мышц, почек, а также при анемиях, опухолевых поражениях, остром гепатите и т.д.

