
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
Реактивное поле, рассчитанное в модели Онзагера, равно
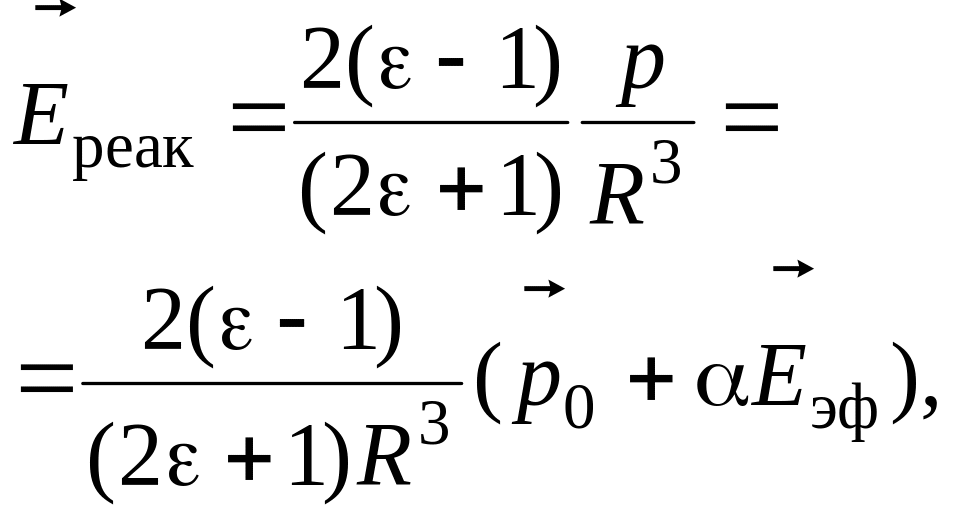 (6.56)
(6.56)
где R – радиус полости, – результирующий дипольный момент молекулы. Реактивное поле, так как и поле внутри полости, можно выразить через показатель преломления среды:
![]() .
(6.57)
.
(6.57)
Таким образом, эффективное поле, действующее на молекулу в озагеровской полости равно
![]()
или
![]() (6.58)
(6.58)
где
![]() и
и
![]() – функции от показателя преломления
среды n
(в общем случае n
может быть комплексным), R
– параметр теории, характеризующий
объем полости.
– функции от показателя преломления
среды n
(в общем случае n
может быть комплексным), R
– параметр теории, характеризующий
объем полости.
Из
формулы (6.58) видно, что свойства
эффективного поля в области примесной
молекулы существенно зависят от ее
поляризуемости и параметра теории R.
Если в единице объема находится N
молекул, которые занимают объем
![]() ,
то R3
определяет эффективный объем, приходящийся
на одну молекулу. Этот объем может быть
рассчитан по известным значениям
плотности и молекулярного веса для
однокомпонентной среды.
,
то R3
определяет эффективный объем, приходящийся
на одну молекулу. Этот объем может быть
рассчитан по известным значениям
плотности и молекулярного веса для
однокомпонентной среды.
Известно,
что объем молекул очень тесно связан с
ее поляризуемостью
,
входящей в формулу Лоренц – Лоренца.
Анализ этой зависимости приводит к
простому выражению
![]() .
.
Следовательно, онзагеровский радиус может быть оценен независимыми способами на основании различных характеристик вещества: показателей преломления или соответствующей величины рефракции, значения которых приведены в справочной литературе. Указанные способы применяются и к двухкомпонентным растворам, если радиусы молекулы и растворителя близки. Если радиус примесной молекулы больше, чем радиус молекулы растворителя, то онзагеровкий радиус для такой системы может быть выбран исходя из ван–дер–ваальсова радиуса исследуемой молекулы.
Модель Онзагера не лишена и некоторых недостатков:
модель шара с точечным диполем в центре не отражает реальных свойств молекулы, обладающей сложным расположением зарядов
нельзя рассматривать ближайшее окружение молекулы как сплошную среду с диэлектрической проницаемостью .
Недостаточно считать, что и связь данной молекулы с ее окружением выражается реактивным полем, имеющим то же направление, что и дипольный момент рассматриваемой молекулы. Логично предположить, что ориентация данной молекулы связана с ориентацией соседних молекул и, следовательно, зависит от их расположения.
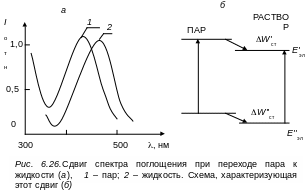
Несмотря на отмеченные недостатки с помощью этой модели можно рассчитывать взаимодействие растворенной молекулы с окружающей средой и определять положение ее электронно-колебательных уровней. Уровень энергии при переходе от газовой фазы к раствору смещается на величину так называемой энергии стабилизации Wст, под которой будем понимать энергию уровня, которая установится после осуществления всех релаксационных процессов в молекуле после акта поглощения или испускания. Разность энергий стабилизации ΔWст = W'ст + W''ст основного и возбужденного уровней молекулы в растворе характеризует смещения спектра поглощения или испускания (см. рис. 6.26)
 Величина
сдвига спектра может быть записана в
следующем виде:
Величина
сдвига спектра может быть записана в
следующем виде:
![]() ,
,
где
![]() ,
,
![]() и
и
![]() – изменения энергии молекулы в растворе,
обусловленные взаимодействиями
ориентационного, индукционного и
дисперсионного характера. Энергия
взаимодействия растворенной молекулы
со средой определяется значениями ее
дипольного момента
,
поляризуемости
,
а также величиной эффективного
электрического поля
,
действующего на молекулу в растворе.
Однако преимущества метода локального
поля проявились еще и в том, что на его
основе были рассчитаны динамические
сдвиги полос в электронных спектрах
поглощения. Влияние динамических
индуктивно-резонансных взаимодействий
на сдвиг частот максимумов полос спектров
растворов был рассмотрен Бахшиевым в
рамках описания общих закономерностей
влияния растворителя на смещение
электронных спектров при переходах от
газовой фазы к раствору. Величина сдвига
оценивается по формуле
– изменения энергии молекулы в растворе,
обусловленные взаимодействиями
ориентационного, индукционного и
дисперсионного характера. Энергия
взаимодействия растворенной молекулы
со средой определяется значениями ее
дипольного момента
,
поляризуемости
,
а также величиной эффективного
электрического поля
,
действующего на молекулу в растворе.
Однако преимущества метода локального
поля проявились еще и в том, что на его
основе были рассчитаны динамические
сдвиги полос в электронных спектрах
поглощения. Влияние динамических
индуктивно-резонансных взаимодействий
на сдвиг частот максимумов полос спектров
растворов был рассмотрен Бахшиевым в
рамках описания общих закономерностей
влияния растворителя на смещение
электронных спектров при переходах от
газовой фазы к раствору. Величина сдвига
оценивается по формуле
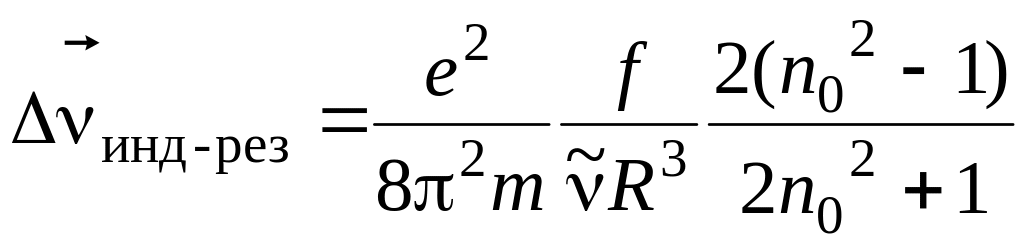 ,
(6.59)
,
(6.59)
где e и m – заряд и масса электрона; f – сила осциллятора полосы; n0 –показатель преломления растворителя; R – онзагеровский радиус молекулы; – частота максимума полосы
Принципиальное отличие динамических сдвигов от статических, рассматриваемых в теории Дебая, состоит в том, что динамические взаимодействия в конечном итоге определяются дипольным моментом перехода между квантовыми состояниями растворенной молекулы.
Итак, полный сдвиг частоты чисто электронного перехода для поглощения выразится в виде суммы
![]() (6.60)
(6.60)
где
![]() –
динамический сдвиг полосы, обусловленной
возникновением у молекулы наведенного
дипольного момента под действием
электрического вектора световой волны.
–
динамический сдвиг полосы, обусловленной
возникновением у молекулы наведенного
дипольного момента под действием
электрического вектора световой волны.
В электронных спектрах поглощения смещение полос может достигать весьма значительной величины, равной тысячам см–1. Причем полосы поглощения для одной и той же молекулы по разному сдвигаются в зависимости от растворителя. Например, спектр поглощения для молекулы 3-аминофталимида смещается в красную сторону в н-гептане на 1400 см–1, а в этиловом спирте и воде – до 2300 см–1.
В настоящее время установлены многие закономерности проявления межмолекулярных взаимодействий, имеющих самую разнообразную природу. Создан даже отдельный отдел спектроскопии межмолекулярных взаимодействий, который интенсивно развивается санкт-петербургской школой физиков (Бахшиев Н.Г., Либов В.С. и др.).
Источником информации в спектроскопии межмолекулярных взаимодействий о свойствах отдельных молекул служит не спектр молекулы как таковой, а изменение спектра при помещении молекулы в конденсированную среду.
