
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
4.4. Малые колебания в квантовой механике
Для определения уровней энергии и волновых функций при колебаниях молекулы необходимо решить уравнение Шредингера вида
![]() .
(4.21)
.
(4.21)
Запись указанного уравнения для i-го нормального колебания будет иметь следующий вид:
 (4.22)
(4.22)
причем
![]() .
(4.23)
.
(4.23)
Формула (4.22) представляет собой известное волновое уравнение для линейного гармонического осциллятора (здесь имеется в виду, что любое i-е нормальное колебание совершается по гармоническому закону). Значения энергии гармонического осциллятора определяются выражением
![]() (4.24)
(4.24)
i = 0, 1, 2, 3, ..., n; i – колебательное квантовое число;i – классическая частота (в с–1) i-го нормального колебания.
Частота света, поглощаемого или излучаемого молекулой, равна
![]() .
(4.25)
.
(4.25)
Переход из основного состояния (все = 0) в состояние, в котором i = 1, a все остальные i(i k) равны нулю, соответствует поглощению частоты k. , являющейся частотой k-го нормального колебания. Согласно правилам отбора для гармонического осциллятора в испускании и поглощении возможны лишь переходы с изменением квантового числа k на ±1.
Таким образом, имеется важное соответствие между результатами квантовой и классической теорий. Для гармонического осциллятора частота квантового перехода между соседними колебательными уровнями в соответствии с правилами отбора совпадает с классической частотой колебаний. Поэтому в гармоническом приближении задача о нормальных колебаниях молекулы может решаться методами классической механики. На рис.4.1 приведены уровни энергии трехатомной молекулы воды.
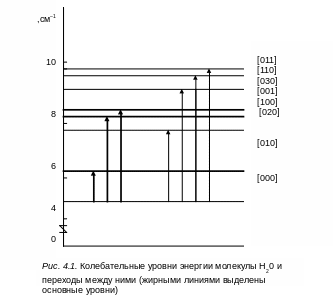
Она
имеет три колебательные степени свободы
и характеризуется тремя нормальными
колебаниями
1=
3657 см–1,
2.=
1595см–1и
3
=
3756 см–1.
Если все i
= 0, то мы,
согласно (4.24), получаем нулевую энергию
колебаний
![]() (где n
= 1, 2, 3),
равную
4504 см
–1.
Основные уровни энергии проведены более
жирными линиями, а обертонные и составные
уровни
– более
тонкими линиями. Переходы на составные
и обертонные уровни возможны при учете
ангармонизма колебаний. Для колебаний
многоатомной молекулы, так же как и для
двухатомной, нужно учитывать
ангармоничность, проявляющуюся тем
сильнее, чем больше колебательная
энергия, приходящаяся на отдельные
нормальные колебания. Ангармоничность
обусловлена отличием реальных сил в
молекуле от квазиупругих. В связи с этим
и потенциальная энергия молекулы не
является чисто квадратичной функцией.
С учетом ангармоничности колебаний
энергия молекулы будет определяться
формулой:
(где n
= 1, 2, 3),
равную
4504 см
–1.
Основные уровни энергии проведены более
жирными линиями, а обертонные и составные
уровни
– более
тонкими линиями. Переходы на составные
и обертонные уровни возможны при учете
ангармонизма колебаний. Для колебаний
многоатомной молекулы, так же как и для
двухатомной, нужно учитывать
ангармоничность, проявляющуюся тем
сильнее, чем больше колебательная
энергия, приходящаяся на отдельные
нормальные колебания. Ангармоничность
обусловлена отличием реальных сил в
молекуле от квазиупругих. В связи с этим
и потенциальная энергия молекулы не
является чисто квадратичной функцией.
С учетом ангармоничности колебаний
энергия молекулы будет определяться
формулой:
![]()
содержащей наряду с линейными членами и квадратичные. величина ангармоничности dik выражается в см–1. Формула (4.26) отличается от аналогичной формулы для двухатомной молекулы тем, что она содержит не только диагональные члены типа dii(i + 1/2)2, но и недиагональные – типа dik(i + 1/2)(k + 1/2), характеризующие взаимное влияние нормальных колебании. При наличии ангармоничности каждое нормальное колебание не только изменяется, но и перестает быть независимыми друг от друга.
коэффициенты
dik
малы по
сравнению с частотами
![]() ,отношение
,отношение
![]() составляет несколько сотых, как и для
двухатомных молекул.
составляет несколько сотых, как и для
двухатомных молекул.
Учет ангармоничности для многоатомных молекул представляет довольно трудную задачу, которая может быть решена для простейших многоатомных молекул. Он наиболее существен для молекул, содержащих атомы водорода (углеводороды, вода и др.).
Вследствие ангармоничности частоты переходов i = 0 i = 1, соответствующих отдельным нормальным колебаниям, не совпадают с нулевыми частотами 0k гармонических колебаний. Нулевая энергия колебаний равна
![]() (4.27)
(4.27)
и частота перехода i = 0i = 1 составляет
![]() (4.28)
(4.28)
В последней формуле (4.28) коэффициент dii характеризует ангармоничность данного колебания, а коэффициенты dij (i j) – связи различных нормальных колебаний, обусловленные ангармоничностью.
Для случая нелинейной трехатомной молекулы частоты переходов будут выражаться следующим образом:
![]() (4.29)
(4.29)
Для молекулы воды разница наблюдаемых i и нулевых частот 0i, оказывается весьма заметной
1 = 3657 см–1, 2 = 1595 см–1, 3 = 3756 см–1,
01 = 3825,3 см–1; 02 = 1653,9 см–1; 03 = 3965,6 см–1.
С учетом ангармоничности правила отбора по колебательному квантовому числу i = ±1 для гармонического осциллятора нарушаются. Оказываются возможными переходы с i 1, которым соответствуют обертоны и составные частоты, получающиеся при одновременном изменении квантовых чисел двух или нескольких колебаний. Поэтому, как видно на рис. 4.1, в молекуле воды наряду с основными переходами (переходы с нулевого колебательного уровня)
[0 0 0] [1 0 0]; [0 0 0] [0 1 0]; [0 0 0] [0 0 1] – 1, 2, 3 основные частоты;
можно наблюдать обертоны:
[2 0 0]; [0 2 0]; [0 0 2]; – первый обертон – 2 1, 2 2, 2 3,
[3 0 0]; [0 3 0]; [0 0 3] – второй обертон –3 1, 3 2, 3 3,
составные частоты:
[1 1 0]; [1 0 1]; [0 1 1] – 1+ 2, 1+ 3, 2+ 3,
[2 1 0]; [2 0 1]; [1 2 0] и др.
Таким образом, получается большое число возможных переходов. На опыте классифицировать основные колебания и их обертоны или составные частоты сравнительно легко, так как интенсивность их значительно меньше основных колебаний.
В спектрах поглощения существенное значение имеют переходы, связанные с основным состоянием, так как при нормальных условиях большинство молекул находится в основном состоянии. Однако могут встречаться и переходы из возбужденных состояний в состояния с большей энергией. соответствующие частоты будут называться разностными частотами.
