
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
Наиболее распространенными видами связи в молекулах являются σ- и π-связи, которые образуются в результате перекрывания электронных облаков внешних (валентных) электронов. Имеются и другие виды химических связей, которые характерны для комплексных соединений, содержащих атомы наиболее тяжелых элементов.
На рис. 5.13 и 5.14 приведены типичные варианты перекрывания s-, р- и d- электронных облаков при образовании химических связей. Перекрывание их происходит таким образом, чтобы при данной длине связи область перекрывания оказалась наибольшей, что отвечает максимально возможной силе химической связи.

Под σ-связью в молекуле будем понимать такую связь, которая образуется за счет перекрывания внешних s- или p-электронов. при этом перекрывании электронное облако в пространстве между атомами обладает цилиндрической симметрией относительно оси, проходящей через ядра атомов (см. рис. 5.13) Область перекрывания облаков при цилиндрически расположенной электронной плотности лежит на оси связи. Волновая функция определяется величиной электронной плотности в межъядерном пространстве (см. рис. 5.13). Максимальная электронная плотность описывается σ-связывающей МО орбиталью, а минимальная – σ*‑разрыхляющей. В связывающих МО электронная плотность между ядрами наибольшая и отталкивание ядер уменьшается. Энергия молекулы меньше, чем энергия АО, молекула устойчива, интеграл перекрывания S > 0. В антисвязывающих (или разрыхляющих) МО электронная плотность между ядрами равна нулю, увеличивается отталкивание ядер, энергия МО больше, чем энергия АО. Состояние молекулы неустойчиво, интеграл перекрывания S < 0.
Каждая пара АО, образующая МО, дает две молекулярные орбитали (связывающую и антисвязывающую), что находит отражение в появлении двух энергетических уровней и соответственно потенциальных кривых (см. рис. 5.12). В нормальном состоянии связывающие орбитали заполнены электронами.
Кроме связывающей и разрыхляющих орбиталей имеются несвязывающие орбитали. Обычно это АО атома, не образующего химических связей. Интеграл перекрывания в данном случае равен нулю. Что имеет место в том случае, если АО относятся к различным типам симметрии.
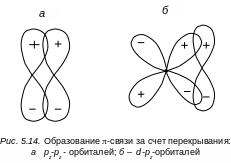
Наряду с σ-связями в молекуле могут существовать и π-связи, которые образуются в результате перекрывания атомных р-орбиталей или d- и р-орбиталей (рис. 5.14).
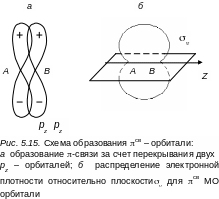
Электронное облако π-связи не обладает аксиальной симметрией. Оно симметрично относительно плоскости, проходящей через ось молекулы. Плотность электронного облака обращается в этой плоскости в нуль. На рис. 5.15 показано образование π-связи и электронная плотность для πсв-орбитали. π-связь слабее σ-связи, и на диаграмме уровней энергия π–связи изображается выше энергии σ-связи. Электронные конфигурации молекулы и заполнение электронами различных оболочек проводится таким же образом, как и для атомов. Электроны помещаются последовательно по два с учетом принципа Паули (начиная с более низкой МО и заканчивая более высокой) с противоположными спинами на каждый энергетический уровень (без учета вырождения).
Рассмотрим химические связи в простейших двухатомных молекулах, их энергетические уровни и заполнение их электронами.
Известно, в ионе молекулы Н2+ химическая связь осуществляется одним 1s-электроном, и находится он на связывающей орбитали σs. Это означает, что из 1s-атомной орбитали образуется связывающая молекулярная σ-орбиталь. для молекулы водорода Н2 уже два 1s электрона образуют аналогичную орбиталь – (σs)2. Можно считать, что два связывающих электрона соответствуют одинарной химической связи. Рассмотрим электронное строение молекулы Не2. Атом гелия содержит два валентных (1s-электрона) электрона, поэтому при рассмотрении молекулы мы должны четыре валентных электрона разместить на молекулярных орбиталях. Согласно принципу Паули два из них разместятся на связывающей σs-орбитали, а два других на разрыхляющей σs*-орбитали. Электронное строение этой молекулы можно записать следующим образом:
Не2 [(σs)2 (σs*)2].
Поскольку один разрыхляющий электрон уничтожает действие связывающего электрона, то такая молекула существовать не может. У нее два связывающих и два разрыхляющих электрона. Порядок химической связи равен нулю. А вот ион Не2+ уже существует. для него электронное строение будет иметь следующий вид:
Не2+[(σs)2 (σs*)1].
Один разрыхляющий электрон не компенсирует двух связывающих.
Рассмотрим образование молекул из атомов элементов второго периода таблицы Менделеева. Для этих молекул будем считать, что электроны заполненного слоя не принимают участия в химической связи. В молекуле Li2 имеются два связывающих (2s) электрона – Li2 (σs)2. Молекула Ве2 должна иметь электронную конфигурацию
Ве2[(σs)2 (σs*)2],
в которой на молекулярных орбиталях располагаются четыре электрона (по два 2s-электрона от каждого атома). Число связывающих и разрыхляющих электронов одинаково, поэтому молекулы Ве2 не существует (здесь полная аналогия с молекулой Не2).
В молекуле В2 на молекулярных орбиталях приходится размещать шесть электронов (четыре 2s-электрона и два 2р-электрона). Электронная конфигурация запишется следующим образом:
В2 [(σs)2 (σs*)2 (πx) (πy)].
Два электрона в молекуле В2 располагаются по одному на πx- и πy-орбиталях с одинаковой энергией. По правилу Гунда они имеют параллельные спины (на одной орбитали не могут располагаться два электрона с одинаковыми спинами). Действительно, эксперимент показывает наличие в этой молекуле двух неспаренных электронов.
В молекуле углерода С2 на молекулярных орбиталях нужно разместить восемь валентных электронов (два 2s-электрона и два 2р электрона одного и другого атомов). Электронное строение будет выглядеть следующим образом:
С2 [(σs)2 (σs*)2 (πx)2 (πy)2].
В молекуле С2 разрыхляющих электронов два, а связывающих шесть. Избыток связывающих электронов равен четырем, поэтому связь в этой молекуле двойная. Связь в молекуле азота N2 осуществляется электронами 2s2 и 2р3. Рассмотрим только участие в связи трех неспаренных p-электронов. 2s-электрона составляют заполненную оболочку и их участие в образовании связи близко к нулю. Облака трех px, py, pz электронов простираются в трех взаимно перпендикулярных направлениях. Поэтому в молекуле азота возможна лишь -связь за счет концентрации электронной плотности вдоль оси z (рис. 5.16), т. е. образуется за счет пары pz-электронов. Остальные две химические связи в молекуле N2 будут только -связями (за счет перекрывания px–px, py–py электронов. на рис. 5.16, б это перекрывание показано отдельно.
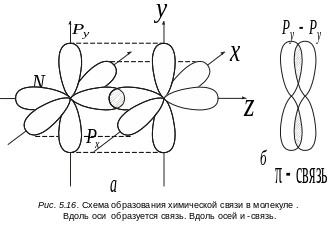
Таким образом, три общие электронные пары в молекуле азота образуют одну - и две -связи. В этом случае говорят о тройной химической связи. Два атома не могут быть связаны между собой более чем тремя электронными парами. Электронная конфигурация молекулы N2 имеет следующий вид:
N2[(σs)2 (σx*)2 (πx,y)4 (σz)2].
Высшей занятой орбиталью считается σz-орбиталь, образованная за счет перекрытия двух р-орбиталей, лепестки которых направлены вдоль оси связи (ось z). Это обусловлено закономерностью изменения энергии 2s- и 2р-электронов с ростом порядкового номера элемента.
В молекуле кислорода О2 по молекулярным орбиталям должны быть распределены двенадцать валентных электронов, два из которых, по сравнению с молекулой N2, должны занять разрыхляющие орбитали. Общее электронное строение запишется так:
О2 [(σs)2 (σs*)2 (σz)2 (πx)2, (πy)2 (πx*)1 (πy*)1].
Как и в молекуле B2, два электрона с параллельными спинами занимают две различные π-орбитали. Это обусловливает парамагнитные свойства молекулы кислорода, что соответствует опытным данным. Избыток четырех связывающих электронов обеспечивает порядок связи в молекуле, равный двум.
В следующей за кислородом молекуле F2 надо дополнительно расположить на орбиталях 2 валентных р-электрона, поэтому молекула фтора будет иметь следующее электронное строение:
F2 [(σs)2 (σs*)2 (σz)2 (πx)2 (πy)2 (πx*)2 (πy*)2].
Избыток двух связывающих электронов характеризует одинарную химическую связь в молекуле F2.
Легко показать, что молекулы Ne2 не существует, так как в ней число связывающих электронов равно числу разрыхляющих.
Рассмотрим электронное строение отдельных двухатомных молекул, состоящих из разнородных атомов, на примере молекулы СО. В молекуле СО на молекулярных орбиталях располагается десять валентных электронов. Ее электронное строение аналогично электронному строению N2, в которой также десять валентных электронов располагаются на тех же молекулярных орбиталях. Этим объясняется близость химических и физических свойств этих молекул. На рис. 5.17 приведена диаграмма уровней энергии МО в молекуле СО.
Из диаграммы видно, что уровни энергии 2s-электронов углерода и кислорода значительно различаются, поэтому их линейная комбинация не может соответствовать реальной МО в данной молекуле, как это могло следовать из упрощенных комбинаций. 2s-электроны кислорода остаются в молекуле на том же энергетическом уровне, что и в атоме, образуя несвязывающую молекулярную орбиталь (H). 2s – АО углерода при линейной комбинации с соответствующей по симметрии 2р- АО кислорода (2рz) образуют связывающую и разрыхляющую * молекулярную орбитали. При линейной комбинации 2рx и 2рy – АО углерода и кислорода образуются молекулярные орбитали x(связывающая) и πx* (разрыхляющая) и аналогично y и y*. 2рz – АО углерода, на которую перейдет один s-электрон в результате реакции будет второй несвязывающей Н-орбиталью. На нее перейдет дополнительно один из р-электронов кислорода. Таким образом, десять валентных электронов в молекуле СО заполняют три связывающие и две несвязывающие МО. Электронная конфигурация внешних электронов молекулы СО будет выглядеть следующим образом:
(σН)2 (σ)2 (πx,y)4 (πH)].
В молекуле NО на орбиталях нужно расположить одинадцать электронов, что приведет к строению электронной оболочки типа:
NО [(σs)2 (σs*)2 (πx)2 (πy)2 (σz)2 (πx*)].

Как видно, число избыточных связывающих электронов равно пяти. С точки зрения порядка химической связи надо ввести дробное число, равное 2,5, для ее характеристики. Если в этой молекуле удалить один электрон, то получится ион NO+ с более прочной межатомной связью, так как число связывающих электронов здесь будет равно шести (удален один электрон с разрыхляющей πx*-орбитали).
Если два атома могут связываться только одной общей парой электронов, то между такими атомами всегда образуется σ-связь. π-связь осуществляется в том случае, если два атома связываются двумя или тремя общими электронными парами. Типичным примером может служить молекула азота. Химическая связь в ней осуществляется за счет трех неспаренных px, py, и pz-электронов. Угловые лепестки их орбиталей простираются в трех взаимно перпендикулярных направлениях. Если за линию связи принять ось z, то перекрывание рz-атомных орбиталей дадут одну σz-связь. Остальные орбитали px и py дадут только π-связи. Таким образом, три пары связывающих электронов дают одну σ-связь и две π-связи. Итак, все одинарные химические связи между атомами являются σ-связями. В любой кратной связи одна σ-связь, а остальные – π-связи.
