
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
Вращательные постоянные и структурные параметры некоторых
пирамидальных четырехатомных молекул
-
Молекула
В, см–1
r, нм
(град)
NH3
9,940
0.1014
106° 47'
NF3
0,3563
0,1371
102° 9'
РН3
4.4522
0,1421
93°27'
PF3
0,2608
0,1550
102°
PCl335
0,0874
0.2043
100°б'
Необходимо заметить, что при всех определениях структурных параметров молекул не учитываются нулевые колебания, присутствующие в молекуле. При определении масс атомов из спектроскопических данных наличие нулевых колебаний вызовет ошибку в определении массы приблизительно того же порядка, что и для линейных молекул.
Конечно, знание спектров КР и ИК-поглощения молекул в газовой фазе позволяет определять не только геометрические параметры молекулы, но и ряд других параметров центробежного растяжения, а по интенсивности и ширине соответствующих линий можно определять компоненты тензора поляризуемости, доплеровское уширение, сечение рассеяния и др.
Развитие и применение СКР тесно связано с развитием источников возбуждающего излучения высокой яркости и мощности (лазерных источников возбуждения). Еще большие возможности открывает новый нелинейно-оптический метод спектроскопии комбинационного рассеяния, известный под названием КАРС (спектроскопия когерентного антистоксового рассеяния света). Этот метод позволяет получить более высокий уровень сигналов (примерно в 105 раз выше, чем в СКР) и улучшить разрешение линий в спектрах до 0,001 см–1. Разрешение в методе СКР порядка 0,06 см–1.
Глава 3.
КОЛЕБАТЕЛЬНО-ВРАЩАТЕЛЬНЫЕ СПЕКТРЫ ДВУХАТОМНЫХ МОЛЕКУЛ
3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
В химически устойчивой двухатомной молекуле между атомами действуют силы преимущественно электрического притяжения. Величина и характер этих сил зависят от перераспределения электронной плотности внешних (валентных) электронов. Рассмотрим двухатомную молекулу из образующие ее атомы с точки зрения зависимости их потенциальной энергии от расстояния между ними.
П ока
атомы находятся на достаточно большом
расстоянии друг от друга, сила их
взаимодействия очень мала. Она появляется
в результате притяжения, обусловленного
взаимной поляризацией электронных
оболочек атомов. Затем сила притяжения
возрастает при уменьшении расстояния
между атомами, однако это возрастание
не беспредельно. на
малых сравнительно расстояниях между
атомами в действие вступают силы
отталкивания, обусловленные взаимным
влиянием ядер, а также проникновением
электронных оболочек, что и проявляется
в специфическом отталкивании между
электронами. Потенциальная энергия
отталкивания изображена на рис. 3.1
(кривая 1).
ока
атомы находятся на достаточно большом
расстоянии друг от друга, сила их
взаимодействия очень мала. Она появляется
в результате притяжения, обусловленного
взаимной поляризацией электронных
оболочек атомов. Затем сила притяжения
возрастает при уменьшении расстояния
между атомами, однако это возрастание
не беспредельно. на
малых сравнительно расстояниях между
атомами в действие вступают силы
отталкивания, обусловленные взаимным
влиянием ядер, а также проникновением
электронных оболочек, что и проявляется
в специфическом отталкивании между
электронами. Потенциальная энергия
отталкивания изображена на рис. 3.1
(кривая 1).
с уменьшением расстояния она возрастает быстрее, нежели энергия притяжения (кривая 2). Благодаря одновременному действию двух сил противоположного направления (сил притяжения и отталкивания) на некотором расстоянии между атомами установится равновесие: силы отталкивания равны силам притяжения. Потенциальная энергия системы, понимаемая как результирующая сумма энергий притяжения и отталкивания (рис. 3.2), будет иметь минимум. Расстояние между ядрами, которое соответствует минимуму потенциальной энергии, будем называть равновесным и обозначать .
При расстоянии между ядрами меньшем равновесного, превалируют силы отталкивания, поэтому потенциальная энергия будет неограниченно и быстро возрастать (левая ветвь потенциальной кривой на рис. 3.2). При увеличении расстояния между ядрами атомов, когда r → , потенциальная энергия должна расти до нуля, так как свободные атомы, удаленные на бесконечно большое расстояние друг от друга, не взаимодействуют и потенциальной энергией не обладают (правая ветвь потенциальной кривой рис. 3.2).
П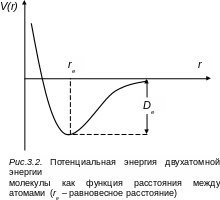 отенциальная
кривая V(r)
весьма характерна для химической связи
в двухатомной молекуле. Устойчивая
молекула будет существовать в том
случае, когда V(r)
имеет минимум. Значение r
будет
находиться в интервале 0 <
r
< .
Если минимум
отсутствует, то это означает, что при
сближении атомов не образуется устойчивой
молекулы. Первый случай соответствует
притяжению атомов при их сближении, а
второй –
отталкиванию.
Расстояние
отенциальная
кривая V(r)
весьма характерна для химической связи
в двухатомной молекуле. Устойчивая
молекула будет существовать в том
случае, когда V(r)
имеет минимум. Значение r
будет
находиться в интервале 0 <
r
< .
Если минимум
отсутствует, то это означает, что при
сближении атомов не образуется устойчивой
молекулы. Первый случай соответствует
притяжению атомов при их сближении, а
второй –
отталкиванию.
Расстояние
![]() ,
при котором энергия взаимодействия
имеет минимум, обычно принимают
за длину
химической связи.
,
при котором энергия взаимодействия
имеет минимум, обычно принимают
за длину
химической связи.
Расстояние
от минимума кривой до оси абсцисс, к
которой кривая асимптотически приближается
в своей правой части, соответствует
работе, которую необходимо затратить
для разрыва связи, а следовательно и
молекулы на составляющие ее атомы или
ионы и переноса их в бесконечность
(диссоциации). Энергия диссоциации
![]() = V
(r
=
)
–
V
(r
=
re)
(энергия
связи атомов в молекуле). Это определение
энергии не учитывает значения нулевой
колебательной энергии у молекулы,
поэтому определенная на опыте энергия
диссоциации будет меньше вычисленной.
= V
(r
=
)
–
V
(r
=
re)
(энергия
связи атомов в молекуле). Это определение
энергии не учитывает значения нулевой
колебательной энергии у молекулы,
поэтому определенная на опыте энергия
диссоциации будет меньше вычисленной.
