
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
Правила отбора для различных квантовых чисел выводятся в квантовой механике путем вычисления матричных элементов для соответствующих переходов. Мы приведем правила отбора для дипольных переходов при типе связи а по Гунду для электронного и вращательного движения
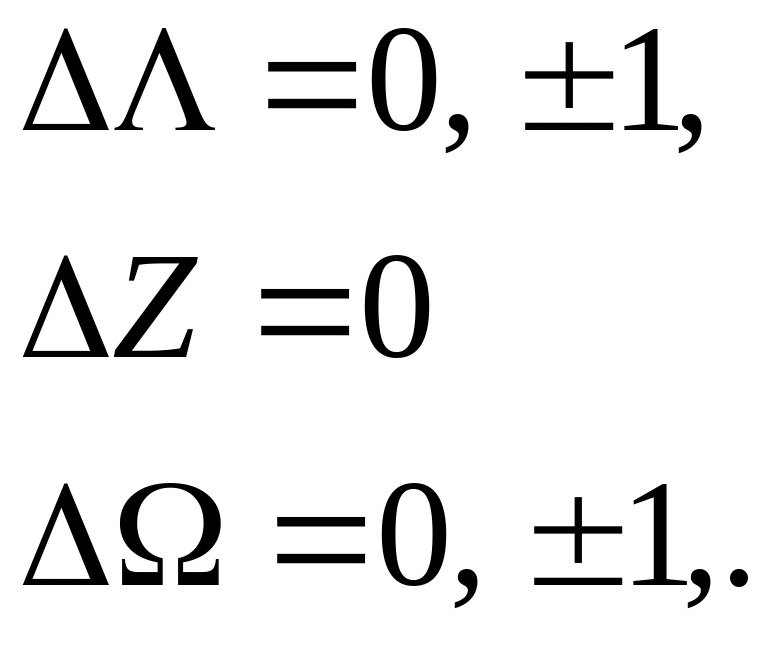 (5.83)
(5.83)
Согласно этих правил комбинировать между собой могут одинаковые или соседние электронные состояния. Например, возможны переходы между , ПП, , П состояниями и запрещенные комбинации , П и др. Правило Z = 0 существенно для понимания особенностей тонкой структуры молекулярных спектров. Это правило (подобно правилу S = 0) приводят к запретам комбинаций между состояниями, характеризующимися различной мультиплетностью (интеркомбинационные запреты). Правило запрета по спину S = 0 не является абсолютно строгим. Для тяжелых молекул оно может нарушаться. Тогда с небольшой интенсивностью могут осуществляться электронные переходы между состояниями с различной мультиплетностью. Указанное правило может нарушаться в присутствии сильного электрического поля. Такие переходы называются индуцированными (вынужденными). Указанные переходы могут наблюдаться в газах при высоких давлениях.
Существуют важные правила, связанные с характером симметрии молекулярных состояний. Для молекул, относящихся к точечной группе симметрии Dh(двухатомные молекулы с одинаковыми ядрами), четные состояния (g) комбинируют с нечетными (u), т. е.
g u, g / g, u / u. (5.84)
Перечеркнутые стрелки характеризуют запрет перехода.
Для молекул, состоящих из неодинаковых атомов, состояния молекулы делятся на положительные и отрицательные (по поведению волновой функции относительно отражения в плоскости , проходящей через ось молекулы). Разрешены переходы между состояниями противоположной симметрии и запрещены ‑ между состояниями одинаковой симметрии. Для переходов имеется дополнительное ограничение, связанное с тем, что Z-состояния могут быть положительными (+) и отрицательными (–). Разрешаются только переходы между -состояниями одной симметрии, т. е.
++, ––. (5.85)
Переходы между состояниями +и – запрещены. Как мы видели (5.83), при слабом спин-орбитальном взаимодействии для проекции орбитального момента количества движения на ось молекулы имеет место следующее правило отбора: = 0, 1. Таким образом, возможны переходы , П, П П, П и т. д. Все они делятся на три типа:
а переходы , для которых = 0 и = 0;
б переходы П, П ,..., для которых = 1, = 0 или = 1;
в переходы П П, , ..., для которых = 0 при 0
Для обозначения электронных переходов будем сначала писать символ нижнего состояния, а затем верхнего. Например, П обозначает переход между нижним -состоянием и верхним П-состоянием.
Переходы трех типов существенно отличается своей вращательной структурой. Для переходов первого типа имеется дополнительное правило отбора, запрещающее Q-ветвь, а появляются только R и Р-ветви. Для переходов второго типа появляются все три ветви (Q, R и Р) с примерно одинаковым распределением интенсивности. Для переходов третьего типа (П П) также возможны три ветви. однако, в Q-ветви интенсивность быстро спадает с увеличением квантового числа, и эта ветвь довольно слаба. Таким образом, с учетом мультиплетности возможны следующие переходы трех типов:
а) 1+ – 1+, 2+ – 2+, 3+ – 3+, ...
1– – 1–, 2– – 2–, 3– – 3–, ...
б) 1 – 1П, 1П – 1, 2 – 2П, 2П – 2, ...
1П – 1, 1 – 1П, 2П – 2,2 – 2П, ...
в) 1П – 1П, 2П – 2П, 3П – 3П, ... .
1 – 1, 2 – 2, 3 – 3, ...
Разнообразие возможных переходов увеличивается, если учесть, что уровни П и при S 0, т.е . уровни 2П, 3П,... и 2, 3, ..., могут иметь различную силу связи вращательного момента количества движения с электронным (случай связи а и б по Гунду). Спектр поглощения молекулы водорода Н2 соответствует возбуждению электрона из молекулярной оболочки (g)2 на более высоколежащие электронные состояния. Для молекулы водорода как наиболее легкой правила отбора по спину S = 0 хорошо выполняются и поэтому будем иметь две системы электронных переходов: синглетную и триплетную. Для синглетной системы получается спектр, лежащий в далекой ультрафиолетовой области и соответствующий комбинациям основного уровня 1+g с высокими возбужденными уровнями. Для триплетной системы получается спектр, лежащий в ультрафиолетовой и видимой области.
