
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
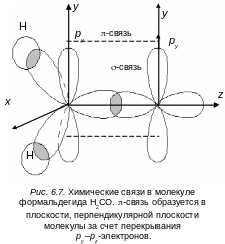
6.2.2. Молекулярные орбитали молекулы формальдегида н2со
Химические
связи в молекуле формальдегида образуются
s-
и p-
электронами. Так как молекула Н2СО
в нижнем электронном состоянии плоская
и относится к точечной группе симметрии
C2,
то для атома углерода осуществляется
sp2-гибридизация,
которая и приводит к плоскому строению
молекулы. Наглядный вид образования
связей в молекуле приведен на рис 6.7. В
молекуле образуются
-
и
![]() -связи
и остаются электроны (n
электроны
атома кислорода), находящиеся на не
связывающих орбиталях. Последовательность
молекулярных орбиталей и расположение
электронов на них выглядит следующим
образом:
-связи
и остаются электроны (n
электроны
атома кислорода), находящиеся на не
связывающих орбиталях. Последовательность
молекулярных орбиталей и расположение
электронов на них выглядит следующим
образом:
![]()
![]()
![]()
![]() .
.
Разрыхляющие
орбитали
![]() и
и
![]() остаются свободными. Таким образом, в
группе атомов С
= 0 все валентные электроны располагаем
на своих орбиталях (для атома кислорода
рассматриваем только p-электроны).
остаются свободными. Таким образом, в
группе атомов С
= 0 все валентные электроны располагаем
на своих орбиталях (для атома кислорода
рассматриваем только p-электроны).
Почему на несвязывающих орбиталях у нас получилось по два электрона с различной энергией. Дело в том, что один p-электрон атома кислорода смешивается с s-электроном и частично задействован с -связи с атомом углерода. Расчет показывает, что распределение электронной плотности для него обладает шаровой симметрией. В точечной группе симметрии C2 его орбиталь относится к типу симметрии а1 и по значению энергии расположена ниже орбитали px-электрона. Симметрия свободной орбитали px относится к типу b1, который определяется из рассмотрения операций симметрии для группы C2. Ось у направлена перпендикулярно плоскости молекулы.
Электронная плотность для орбитали -типа относится к типу b2 симметрии. Это проверяется по поведению волновой функции, описывающей распределение pz-электронов, при выполнении операций симметрии. На рис. 6.8. приведена схема расположения уровней энергии валентных электронов молекулы формальдегида и симметрия их молекулярных орбиталей.
Зная симметрию молекулярных орбиталей, можно установить симметрию нижнего электронного состояния как групповое произведение их симметрий молекулярных орбиталей. Итак
![]()
![]()
![]()
![]()
![]()
![]()
![]() .
.
Произведение
типа симметрии самого на себя всегда
дает полносимметричное представление
(исключая вырожденные состояния), т. е.
![]() или
или
![]() .
Таким образом, нижнее состояние молекулы
формальдегида относится к полносимметричному
представлению А1.
Переход электрона с заполненной
несвязывающей p-орбитали
(npx)
на разрыхляющую *-орбиталь
приводит к спектру поглощения в самой
длинноволновой области. На рис 6.8 этот
переход обозначается вертикальной
стрелкой. Определим симметрию этого
перехода. Электрон переходит с молекулярной
орбитали симметрии b1
на разрыхляющую орбиталь *
симметрии b2.
При этом переходе электроны распределяются
следующим образом:
.
Таким образом, нижнее состояние молекулы
формальдегида относится к полносимметричному
представлению А1.
Переход электрона с заполненной
несвязывающей p-орбитали
(npx)
на разрыхляющую *-орбиталь
приводит к спектру поглощения в самой
длинноволновой области. На рис 6.8 этот
переход обозначается вертикальной
стрелкой. Определим симметрию этого
перехода. Электрон переходит с молекулярной
орбитали симметрии b1
на разрыхляющую орбиталь *
симметрии b2.
При этом переходе электроны распределяются
следующим образом:
![]() .
.
Симметрия
электронного состояния (*)
будет определяться прямым произведением
симметрий переходов, или в конечном
итоге будет определяться произведением
![]() .
.

Если произвести перемножение типа симметрии b1 на тип симметрии b2 (см. таблицу характеров для точечной группы симметрии C2), то мы получим тип симметрии а2. с точки зрения типов симметрии электронных состояний этот переход обозначаем как A1A2.
Анализируя таблицу характеров для этого типа перехода, мы видим, что он запрещен в дипольном приближении.
Рассуждая
аналогичным образом, найдем тип симметрии
перехода
![]() .
Этот переход типа А1В1,
который в дипольном приближении разрешен.
.
Этот переход типа А1В1,
который в дипольном приближении разрешен.
Таким
образом, интерпретируя спектр поглощения
формальдегида, который в ближнем
ультрафиолете состоит из двух полос
270 нм (слабая) и 185 нм (сильная), можем
резюмировать, что первый относится к
типу 1A11A2
(запрещен в дипольном приближении), а
второй - к типу симметрии 1A11B1
(разрешен в дипольном приближении с
силой осциллятора, близкой к единице).
Цифра
![]() слева
вверху означает синглетность перехода,
т. е. переходы совершаются без изменения
спинового числа (
слева
вверху означает синглетность перехода,
т. е. переходы совершаются без изменения
спинового числа (![]() ).
).
Слабое
проявление поглощения в области 270 нм
может быть связано с вибронным
заимствованием интенсивности (см. спектр
поглощения бензола). Можно показать,
что за счет вибронного взаимодействия
колебание b1
в молекуле формальдегида (колебания в
молекуле Н2СО
распределяется по следующим типам
симметрии:
![]() )
может быть ответственно за разрешение
первого электронного перехода, так
какпрямое произведение А2
на b1
дает тип
симметрии B2,
который разрешен по правилам отбора.
Таким образом, за счет вибронного
взаимодействия с участием колебания
b1
первый электронный переход в молекуле
формальдегида Н2СО
частично разрешается.
)
может быть ответственно за разрешение
первого электронного перехода, так
какпрямое произведение А2
на b1
дает тип
симметрии B2,
который разрешен по правилам отбора.
Таким образом, за счет вибронного
взаимодействия с участием колебания
b1
первый электронный переход в молекуле
формальдегида Н2СО
частично разрешается.
