
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
5.5. Систематика электронных состояний в двухатомной молекуле
Для систематики электронных состояний в двухатомных молекулах, аналогично как и в атомах, вводятся определенные квантовые числа, характеризующие орбитальное и спиновое движение электронов. Наличие электрических и магнитных полей как в молекулах, так и в атомах, приводит к векторному сложению орбитальных и спиновых моментов количества движения. Однако в двухатомной молекуле валентные электроны движутся не в сферически-симметричном электрическом поле, что характерно для атома, а в аксиально-симметричном, что характерно для двухатомных или линейных многоатомных молекул. Все двухатомные молекулы относятся к двум типам симметрии: D∞h или С∞. К первому типу относятся молекулы, состоящие из одинаковых атомов, ко второму – из разноименных. Ось бесконечного порядка направлена вдоль химической связи. в том же направлении действует и электрическое поле, которое сильно влияет на полный орбитальный момент, вызывая его прецессию вокруг оси поля. В результате этого полный орбитальный момент перестает квантоваться, а сохраняется лишь квантование его проекции Lz на ось молекулы:
Lz = mL· ħ, (5.65)
где mL – квантовое число, принимающее значения mL = 0, ±1, ±2 и т. д. При этом энергия электронного состояния зависит только от абсолютного значения mL , что соответствует тому факту, что с наглядной точки зрения оба вращения электрона (правое и левое) вокруг оси молекулы приводят к одному и тому же значению энергии. Введем некоторую величину Λ, которая характеризует абсолютную величину проекции полного орбитального момента на ось молекулы. Тогда значения Λ будут целыми положительными числами, различающимися на одну единицу Λ = mL = 0, 1,2, ...
Для
классификации электронных состояний
двухатомной молекулы числа Λ играют ту
же роль, что и орбитальное квантовое
число l
для классификации электронных состояний
атомов. Общее суммарное квантовое число
для атомов принято обозначать
![]() ,
где суммирование производится по всем
электронам атома. Если L
= 0, то такие
электронные состояния обозначаются
буквой s;
если L =
1, то электронные состояния обозначаются
буквой р.,
т. е.
,
где суммирование производится по всем
электронам атома. Если L
= 0, то такие
электронные состояния обозначаются
буквой s;
если L =
1, то электронные состояния обозначаются
буквой р.,
т. е.
|
s, p, d, ... |
L= |
0, 1, 2, ... |
Пользуюясь обозначениями электронных состояний для атома, электронные состояния для молекулы с последовательными значениями Λ принято обозначать прописными греческими буквами:
Λ= |
0, 1, 2, 3, ... |
состояния |
Σ, Π, Δ, Φ, ... |
Для двухатомных молекул обычно приходится иметь дело со значениями Λ, не превышающими 2. Для нормальных состояний молекул Λ преимущественно равно 0 (Σ-состояния). Возбужденные состояния двухатомных молекул имеют в большинстве случаев Λ = 0 и Λ = 1 (Σ- и П-состояния).
Все значения энергии с Λ ≠ 0 являются дважды вырожденными, что соответствует двум значениям проекции орбитального момента – положительным и отрицательным (mL = Λ и mL = –Λ). Σ-состояния, для которых Λ = 0, являются невырожденными.
На полный спиновый момент молекулы S, в отличие от полного орбитального момента L, аксиально-симметричное электрическое поле не действует. Поэтому полный спиновый момент S квантуется обычным образом приближенно сохраняя свое значение. При заданном значении S полный спиновый момент может ориентироваться æ = 2s + 1 способами, что для молекулы, аналогично как и для атома, определяет мультиплетность æ электронных состояний. В зависимости от значений æ состояния могут быть синглетными (æ = 1), дублетными (æ = 2), триплетными (æ = 3) и т. д. индекс, указывающий мультиплетность, ставится слева вверху соответствующей прописной буквы.
Например, синглетные состояния 1Σ, 1Π, 1Δ, ...,
дублетные ‑ 2Σ, 2Π, 1Δ, ...,
триплетные ‑ 3Σ, 3Π, 3Δ, ...
Для характеристики электронных состояний линейных молекул важную роль играют элементы симметрии σ для гетеронуклеарных (молекул с разными атомами) и центр инверсии i гомонуклеарных молекул (с одинаковыми атомами). По отношению к отражению в плоскости симметрии σ, проходящей через ось молекулы, электронные состояния разделяются на положительные (+) и отрицательные (–). Для положительных состояний электронов волновая функция не меняет знак при отражении в плоскости σ, а для отрицательных состояний ‑ меняет на противоположный, т. е.
![]()
Следовательно, все Σ-состояния как невырожденные, являются либо положительными (Σ+), либо отрицательными (Σ–). Все дважды вырожденные состояния, для которых Λ ≠ 0, представляют собой совокупность положительных и отрицательных состояний. Если вырождение снимается, то дважды вырожденный уровень расщепляется на два, один из которых будет положительным, а другой ‑ отрицательным.
Если молекула относится к точечной группе D∞h, то электронные состояния делятся по отношению к отражению в центре на четные (g) и нечетные (u). Каждое электронное состояние является либо четным, либо нечетным:
Σg+, Σg–, Πg, Δg, ...
Σu+, Σu–, Πu, Δu, ... .
Таким образом, имеется четыре типа Σ-состояний и по два типа П-, Δ-состояний.
Волновые
функции оператора проекции орбитального
момента количества движения
![]() имеют вид
имеют вид
![]() .
.
При
Λ = 0 это значение дает одну функцию
![]() .
Если Λ≠0, то получаются две функции
.
Если Λ≠0, то получаются две функции
![]()
Закон
совместного преобразования функций
![]() и
и
![]() дает характеры для вырожденных состояний
Π, Δ, Φ,...
дает характеры для вырожденных состояний
Π, Δ, Φ,...
Если
волновые функции
и
![]() не обладают в отдельности свойством
положительности или отрицательности
по отношению к операции σ,
то их линейные комбинации
не обладают в отдельности свойством
положительности или отрицательности
по отношению к операции σ,
то их линейные комбинации
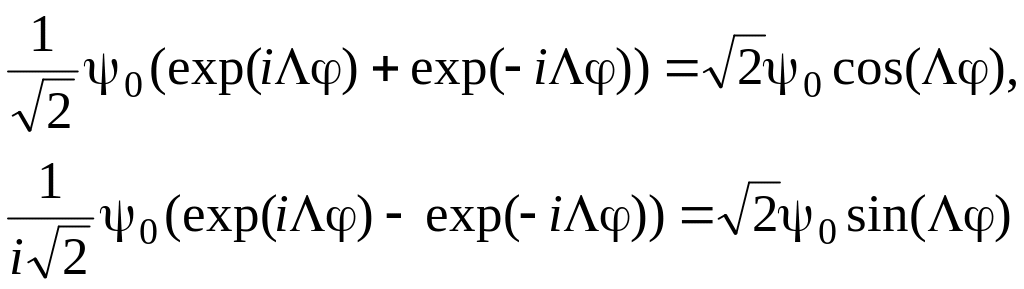
обладают этим свойством (это проверяется подстановкой φ = –φ).
Важно отметить, что из определенных электронных состояний исходных атомов возникает вполне определенный набор электронных состояний молекулы. На основании свойств симметрии можно установить характеристики этих состояний – значения квантовых чисел Λ и S, положительность или отрицательность Σ-состояний, четность или нечетность состояний для молекул, состоящих из одинаковых атомов. При каждом значении Λ состояния могут быть различной мультиплетности.
Спиновые
моменты
![]() и
и
![]() атомов при образовании молекулы векторно
складываются в полный спин молекулы
атомов при образовании молекулы векторно
складываются в полный спин молекулы
![]() .
Возможные значения спинового квантового
числа молекулы равны
.
Возможные значения спинового квантового
числа молекулы равны
S = S1 + S2, S1 + S2 –1, ... , |S2 – S1 |.
Соответственно мультиплетность æ состояния молекулы при заданных мультиплетностях æ1 и æ2 состояний атомов будет принимать значения
æ = æ1 + æ2–1, æ1 + æ2 – 3, ... , |æ1 – æ2| + 1.
Например, при æ1 = æ2 = 2 имеем æ = 3, 1; при æ1 = 3, æ2 = 2 имеем æ = 4, 2; при æ1 = æ2=3 имеем æ = 5, 3, 1.
Рассмотрим несколько примеров получения состояний молекулы, если известны состояния атомов, из которых образована молекула.
Пусть из двух s-состояний атомов образуется молекула. Например, два атома водорода в основном состоянии 2s образуют молекулу водорода. Орбитальные моменты электронов равны нулю, следовательно, образуются только Σ-состояния. В состоянии s находится только один электрон со спином s = 1/2, т. е. æ1 = æ2 = 2. поэтому образуются два состояния æ =3, 1. Таким образом образуется молекула в двух состояниях 1Σg+ и 3Σg –.
Из двух атомов азота в основном состоянии 4s возникают состояния молекулы азота N2 (æ = 1,3,5,7, æ1 = 4 и æ2 = 4) следующего вида 1Σg+, 3Σu+, 5Σg–, 7Σu+. Из двух атомов кислорода в основном состоянии 3p (æ=1,3,5) получаются следующие состояния молекулы:
а) синглетные 1Σg+, 1Σg+, 1Σu–, 1Πg ,1Πu, 1Δg
б) триплетные 3Σu+, 3Σu+, 3Σg–, 3Πg ,3Πu, 3Δu
в) квинтетные 5Σg+, 5Σg+, 5 Σu–, 5Πg ,5Πu, 5Δg
Таким образом, Σ-состояний получается столько, сколько раз комбинация орбитальных моментов атомов равна нулю (0 + 0=0, 1 – 1 = 0, –1 + 1 = 0), Π-состояние получается столько, сколько раз орбитальное результирующее квантовое число равно 1 или –1 (Π-состояния дважды вырождены) (1 + 0 = 1 и –1 + 0 = –1, 0 + 1 = 1 и 0 – 1 = –1). Δ-состояний получается столько, сколько раз результирующий орбитальный момент равен 2 или –2.
Как видно, число получающихся состояний может быть большим. Однако устойчивыми оказываются только те состояния, которым соответствует минимум потенциальной энергии, остальные – неустойчивыми. Определить устойчивость или неустойчивость электронных состояний можно только на основе квантовомеханических расчетов энергии химических связей. Например, расчет на основе квантовой механики энергии связи для молекулы H2 позволил установить, что из двух возможных состояний 1Σg+ и 3Σu+, возникающих при взаимодействии атомов водорода в основном состоянии 2s, первое устойчиво и является основным состоянием молекулы, а второе неустойчиво (ему соответствует типичная кривая отталкивания). В таблице 5.1 приведены обозначения термов основного состояния некоторых двухатомных молекул, межатомные расстояния и энергии химической связи.
Таблица 5.1
Электронные состояния, межатомные расстояния и энергия химической связи некоторых двухатомных молекул.
Молекула |
Электронная конфигурация основного состояния |
Межатомное расстояние, Ǻ |
Энергия связи, эВ |
H2 H2+ He2 He2+ |
(σg)2, 1Σg+ (σg)1, 2 Σg+ (σg)2 (σu*)2, 1Σg+ (σg)2 (σu*)1, 2Σu+ |
0,07415 0,106 – 1,108 |
4,48 2,65 ~0 ~3 |
O2 |
(πu)4 (σg)2 (πg*), 3Σg– |
0,120741 |
5,1 |
O2+ |
(πu)4 (σg)2 (πg*), 2Пg |
0,11227 |
6,48 |
O2– |
(πu)4 (σg)2 (πg*), 2П (?) |
0,126 |
– |
N2 |
(πu)4 (σg)2, 1Σg+ |
0,10976 |
9,75 |
N2+ |
(πu)4 (σg)1, 2Σg+ |
0,1116 |
8,73 |
C2 |
(πu)3 (σg)1, 3Пu |
0,1117 |
6,5 |
F2 |
(πu)4 (σg)2 (πg*)1, 1Σg+ |
0,1418 |
1,56 |
LiH |
(σs)2, 1Σ+ |
0,15953 |
2,51 |
BeH |
(σs)2 (σs*)1, 2Σ+ |
0,13431 |
2,29 |
CH |
(σs)2 (σs*)2 (π)1, 2П |
0,11198 |
3,47 |
CO |
(σs) 2 (πx,y)4, 1Σ |
0,11282 |
11,08 |
CN |
(πx,y)4 (σs) 1, 2Σ+ |
0,11718 |
8,15 |
CF |
(σs)2 (π*)1, 2П |
0,127 |
6,59 |
NO |
(πx,y)4 (σs)2 (π*)1, 2Π |
0,1150 |
8,02 |
NP |
(πx,y)4 (σs)2, 1Σ |
0,14910 |
5,98 |
PO |
(πx,y)4 (σs)1, 2Π |
0,1448 |
5,42 |
NH |
(σs)2 (σs*)2 (πx,y)2 , 3Σ– |
0,1038 |
3,69 |
HF |
(σs)2 (σs*)2 (πx,y)4, Σ |
0,09175 |
5,81 |
