
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
4.11. Типы симметрии колебаний молекул
Формы нормальных колебаний молекулы при выполнении операций симметрии преобразуются определенным образом. Нормальные колебания характеризуются типами симметрии, которые определяются совокупностью всех преобразований формы колебания.
Если при операции симметрии форма нормального колебания не изменяется, т. е. координаты симметрии не изменяются, то такие колебания называются симметричными.
Если при операции симметрии форма колебания изменяется так, что координаты симметрии умножаются на – 1, то такое колебание называется асимметричным. Если при операции симметрии координаты симметрии умножаются на число, не равное ±1, то такое колебание называется вырожденным.
Существуют следующие типы симметрии колебаний:
1. Колебания, симметричные по отношению ко всем операциям симметрии или элементам, определяющим эти операции, называются полносимметричными;
2. Колебания, асимметричные по отношению к некоторым элементам симметрии – неполносимметричные.
3. Колебания, вырожденные хотя бы к одному элементу симметрии – вырожденные.
Приняты следующие обозначения типов симметрии:
А – колебания, симметричные относительно поворотной оси симметрии;
В – колебания, антисимметричные относительно этой оси. Индекс 1 (например, А1, В1) означает симметрию колебания относительно плоскости , проходящей через поворотную ось, индекс 2 – антисимметрию относительно этой плоскости. Индексы один штрих и два штриха справа вверху означают соответственно симметрию или антисимметрию относительно горизонтальной плоскости h, перпендикулярной поворотной оси (например, А'1 и А"2 , В'1 и В"2). Индексы g и u, которые ставятся справа внизу после цифры означают симметрию или антисимметрию колебания относительно центра симметрии (инверсии). Например, колебание типа A1g, является полносимметричным, оно симметрично относительно всех элементов симметрии. Колебания дважды вырожденных типов симметрии обозначаются буквой Е с соответствующими индексами. Колебания трижды вырожденного типа – F. Число типов симметрии зависит от группы симметрии и равно числу классов элементов данной группы.
Рассмотрим преобразования координат симметрии при операциях симметрии на примере трехатомной молекулы воды Н2О, точечная группа симметрии C2 (см. рис. 4.14 и 4.15). В табл. 4.5 приведены коэффициенты, на которые умножаются координаты симметрии при операциях симметрии.
Действительно, при повороте на угол 180° симметричная координата должна умножаться на –1, чтобы перейти в антисимметричную. То же происходит и при отражении в плоскости .
Таблица 4.5
Таблица коэффициентов точечной группы C2
Операции симметрии |
||||
Координаты симметрии |
C1 I |
C2 |
() |
() |
qs |
1 |
1 |
1 |
1 |
qas |
1 |
–1 |
1 |
–1 |
qs |
1 |
1 |
1 |
1 |
Из таблицы 4.5 видно, что для молекулы воды возможны два полносимметричных колебания (qs, и qs) – координаты симметрии не изменяются при всех операциях симметрии – и одно неполносимметричное колебание (координаты qas при операциях C2 и умножаются на –1).
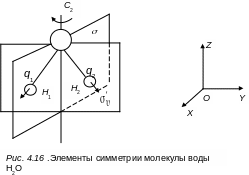
Рассмотрим представление группы C2 в естественных координатах на примере трехатомной молекулы Н2О (q1, q2, q3) (см. рис. 4.16)
При повороте вокруг оси С2 координаты преобразуются так:
![]() ,
,
![]() ,
(4.77)
,
(4.77)
![]() .
.
При повороте вокруг оси C1 (операция идентичности) и отражения в плоскости координаты преобразуются таким образом
![]() ,
,
![]() ,
(4.78)
,
(4.78)
![]() .
.
При операции отражения в плоскости получаем:
,
, (4.79)
![]() .
.
результаты можно представить в табл. 4.6. Можно проверить, что совокупность матриц в этой таблице образует группу. В координатах симметрии (qs, qas, qs) получается другое представление группы С2. Закон преобразования координат симметрии в этом случае будет следующим:
при операции С2 имеем:
![]() ,
,
![]() ,
(4.80)
,
(4.80)
![]() ;
;
при операции С1 и отражении в плоскости получим:
![]() ,
,
![]() ,
(4.81)
,
(4.81)
;
при операции отражения в плоскости :
![]() ,
,
![]() ,
(4.82)
,
(4.82)
![]() .
.
Полученные преобразования можно представить следующей таблицей:
Таблица 4.7
Матрицы преобразования координат симметрии для молекулы Н2О
|
Операции симметрии |
|||
Матрицы преобразования |
С1I |
С2 |
() |
() |
|
|
|
|
|
Представление группы С2 в координатах симметрии обладает той особенностью, что матрицы всех преобразований являются диагональными, т. е. каждая матрица 3-го ранга распадается на три матрицы 1-го ранга. Совокупность матриц первого ранга образует неприводимое представление группы С2, так как дальнейшее понижение ранга этих матриц уже невозможно.
Представление группы симметрии С2 в естественных координатах является приводимым, так как преобразованием координат его можно разложить на неприводимые представления. Таким образом, мы получим два одинаковых одномерных неприводимых представления Г1 (тип А1), отвечающие полносимметричному валентному колебанию О–Н и деформационному симметричному колебанию (изменение угла ). Кроме того, получилось одно неприводимое представление Г2 (тип В2), соответствующее неполносимметричному валентному колебанию.
Итак, полное представление группы симметрии С2 распадается на два представления типа Г1 и одно представление типа Г2. С точки зрения колебаний молекулы Н2О три ее колебания распадаются на два колебания типа А1 и одно колебание типа В2, т. е.
![]() .
.
Итак,
в молекуле Н2О
имеются два колебания полносимметричного
типа (![]() и
)
и одно колебание (
и
)
и одно колебание (![]() )
– антисимметричного типа.
)
– антисимметричного типа.
Оказывается, что определение типов симметрии нормальных колебаний возможно и в общем виде для молекул, принадлежащих к любой точечной группе. Для этого необходимо учитывать только характеры матриц, описывающих те или иные операции в группах симметрии.
Для молекул, принадлежащих к группам низшей симметрии, число типов симметрии равно числу элементов группы, т. е. ее порядку. Следовательно, оно равно 2 для групп второго порядка (Сi, Cs и C2) и 4 для групп четвертого порядка (С2 и С2h). Для точечной группы более высокой симметрии число типов колебаний меньше порядка группы. В качестве примера приведем таблицу характеров и обозначений типов симметрии молекулы бензола, точечной группы D6h (табл. 4.8).
Таблица 4.8
