
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
4.6.3. Точечные группы симметрии и их элементы
В
точечных группах симметрии молекул
операции симметрии группируются по
классам. Говорят, что две (и более)
операции относятся к одному классу,
если их можно получить некоторым
преобразованием координат, состоящим
из операций симметрии данной точечной
группы. Например, три отражения в
плоскостях
![]() ,
,
![]() и
и
![]() в
молекуле
NH3
принадлежат к одному классу, поскольку
их
можно реализовать, поворачивая систему
координат на 120°. Из определения классов
следует, что в один класс входят следующие
пары операций:
в
молекуле
NH3
принадлежат к одному классу, поскольку
их
можно реализовать, поворачивая систему
координат на 120°. Из определения классов
следует, что в один класс входят следующие
пары операций:
1) два поворота на одинаковый угол вокруг разных осей, если в группе имеется операция, переводящая одну ось в другую;
2)
два поворота
![]() и
и
![]() вокруг
одной оcи,
если в группе есть
операция поворота, меняющая направление
оси на обратное, либо
операция отражения в плоскости, содержащей
ось Сn;
вокруг
одной оcи,
если в группе есть
операция поворота, меняющая направление
оси на обратное, либо
операция отражения в плоскости, содержащей
ось Сn;
3) два отражения в разных плоскостях, если в группе имеется операция, переводящая одну плоскость в другую.
Например, мы видели, что наличие у молекулы оси S2 эквивалентно наличию центра симметрии i.
i S2= hС2. (4.37)
Отметим,
что операции Cn
и
h
коммутируют. При нечетных n (n =
2m
+
1)
из (4.37)
получаем (с учётом
![]() )
)
![]() ;
;
![]() ;
;
![]() .
(4.38)
.
(4.38)
Это означает, что система обладает в данном случае как осью Сn так и плоскостью h (в отдельности). Таким образом, лишь при четном n Sn представляет собой самостоятельный элемент симметрии. Заметим также, что в этом случае ось Sn одновременно является и осью Сn/2 (порядка n/2).
Сочетание в одной системе нескольких различных элементов симметрии автоматически приводит к появлению новых элементов симметрии. Так, линия пересечения двух взаимно перпендикулярных плоскостей симметрии всегда является осью симметрии молекулы (например, H2O). Чем больше число различных элементов симметрии (и их комбинаций), тем выше симметрия молекулы (например, С6Н6). Вообще говоря, особенность точечных групп заключается в том, что все они могут быть построены из простейших групп Сn путем присоединения новых элементов симметрии. Причем это добавление не может быть произвольным (например, новые оси симметрии не могут пересекаться со старыми осями под произвольными углами). Данное обстоятельство и служит причиной существования конечного числа точечных групп, а именно: Cn, Sn, Cnh, Cn, Dn, Dnh, Dnd, T, Th, Td, O, Oh, I, Ih. При этом каждая молекула принадлежит к одной точечной группе, являющейся строго определенной. Для конкретной точечной группы (молекулы) получаются вполне определенные типы симметрии состояний последней. Впервые полную классификацию групп симметрии молекул и кристаллов дал знаменитый русский кристаллограф Е. С. Федоров.
Число элементов группы h называется ее порядком (речь идет, естественно, о конечных группах в отличие от бесконечных). Задание группы определяется перечислением ее элементов и указанием закона их умножения (для конечных групп это делается в виде таблицы умножения). Во многих случаях, однако, более удобным оказывается задание группы с помощью указания образующих элементов (так называемых генераторов) и определяющих соотношений между ними. Для одной и той же группы генераторы можно выбирать разными способами. для каждого такого набора будут соответственно свои определяющие соотношения.
Рассмотрим вначале в самом общем виде как задаются перечисленные выше 14 точечных групп, а затем более подробно проанализируем их образование и свойства.
Группа Сn состоит из поворотов вокруг оси на углы 2m/n (m = 0, 1, 2, ..., n–1, где n – число элементов) и имеет один генератор Сn, а определяющее соотношение равно
![]() .
(4.39)
.
(4.39)
Группа Сnh имеет ось n-го порядка и перпендикулярную к ней плоскость отражения h (рис. 4.10, а) и состоит из:
1)
элементов
группы
![]() (m
=
1, 2,...< n–1);
(m
=
1, 2,...< n–1);
2)
n
зеркально-поворотных преобразований:
![]() .
.
Генераторами группы являются Сn, h, а определяющие соотношения имеют вид
![]() .
(4.40)
.
(4.40)
При
четных n
в группе есть инверсия
![]() ,
которая может быть выбрана в качестве
генератора вместо h
,
которая может быть выбрана в качестве
генератора вместо h
Группа
Sn
имеет одну
зеркально-поворотную
ось n-го
порядка. При нечетном n
она является группой Cnh,
при четном n
= 2m
![]() (определяющее
соотношение). Порядок
группы равен
h.
(определяющее
соотношение). Порядок
группы равен
h.
Группа Cn содержит ось n-го порядка и n плоскостей отражения, проходящих через эту ось (рис. 4.10, б). Состоит из 2n элементов: n из них являются поворотами Сn , а оcтальные – отражениями в n вертикальных плоскостях. Генераторами группы служат Сn и , а определяющие соотношения имеют вид
![]() .
(4.41)
.
(4.41)
Группа Dn имеет ось n-го порядка и n перпендикулярных к ней осей, которые обозначают С2 (или V2) (см. рис. 4.10, в). Группа содержит 2n элементов: n операций Cn, и n поворотов вокруг осей С2. Генераторами группы служат Сn и C2, а также соотношения
![]() .
(4.42)
.
(4.42)
 Группа
Dnh
получается из группы Dn
путем
добавления плоскоcти
отражения h,
перпендикулярной к оси Сn
(см. рис. 4.10 г).
Она состоит
из
4n
элементов: 2n
операций группы Dn,
произведений Сnh
и C2Cnh.
Генераторы этой группы – Сn,
C2,
h
(при четном n
вместо h
можно
использовать инверсию i).
Определяющие соотношения
Группа
Dnh
получается из группы Dn
путем
добавления плоскоcти
отражения h,
перпендикулярной к оси Сn
(см. рис. 4.10 г).
Она состоит
из
4n
элементов: 2n
операций группы Dn,
произведений Сnh
и C2Cnh.
Генераторы этой группы – Сn,
C2,
h
(при четном n
вместо h
можно
использовать инверсию i).
Определяющие соотношения
![]() (4.43)
(4.43)
Группа
Dnd
получается
из группы Dn
путем
добавления диагональных плоскостей
отражения d
проходящих через ось Сn
посередине между осями С2
(рис. 4.11
д).
Содержит 4n
элементов: 2n
элементов подгруппы Dn,
n
отражений в различных плоскостях
![]() (m
=
0, 1,
2, ...,
n
–
1) и n
произведений
(m
=
0, 1,
2, ...,
n
–
1) и n
произведений
![]() .
Данную группу можно получить и из группы
S2n
добавлением
к ней оси второго порядка C2
или
плоскости отражения .
Генераторами служат S2n
и C2.
Определяющие соотношения:
.
Данную группу можно получить и из группы
S2n
добавлением
к ней оси второго порядка C2
или
плоскости отражения .
Генераторами служат S2n
и C2.
Определяющие соотношения:
![]() . (4.44)
. (4.44)
Группа
Т
есть группа вращений,
совмещающих тетраэдр сам с собой,
(рис. 4.11,
а).
Она содержит три взаимно перпендикулярные
оси второго порядка, соединяющие середины
противоположных ребер тетраэдра, и
четыре оси третьего порядка, проходящие
через каждую из вершин и центры
противоположных граней. Эту группу
можно получить из группы D2
присоединением оси третьего порядка.
Группа Т
имеет 12 элементов: I,
3C2,
4C3
и 4![]() из вершин и центры противоположных
граней. Ее генераторами являются С2
и С3,
а определяющие соотношения
имеют вид:
из вершин и центры противоположных
граней. Ее генераторами являются С2
и С3,
а определяющие соотношения
имеют вид:
![]() .
.
Группа Тh получается из группы Т добавлением инверсии в центре тетраэдра. Так как С2i = h, то в группе появляются три взаимно перпендикулярные плоскости отражения.
Группа
Td
(см. рис. 4.11, б)
получается на группы Т
добавлением шести плоскостей симметрии,
проходящих (каждая
из
них) через две оси третьего порядка С3,
и одну ось второго порядка С2.
Она содержит
24 элемента: I,
4C3,
4
,
6,
3C4,
3![]() ,
3C2.
Генераторами
служат S4,
C3.
Определяющие
соотношения имеют вид
,
3C2.
Генераторами
служат S4,
C3.
Определяющие
соотношения имеют вид
S44=
I;
![]() = I;
S4C3S4
=
. (4.45)
= I;
S4C3S4
=
. (4.45)
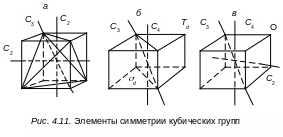
Группа
О
есть группа поворотов, совмещающих куб
с самим собой. Она cодержит
три оси четвертого порядка С4,
проходящие через центры противоположных
граней, четыре оси третьего порядка С3,
проходящие через противоположные
вершины куба, и шесть осей второго
порядка С2,
проходящих через середины противоположных
ребер (рис. 4.11 в.).
Группа состоит
из
24 элементов: I,
4C3,
4
,
3C4,
3![]() ,
3
,
6C2,
В качестве генераторов
можно выбрать
C4
и C3,
которые удовлетворяют следующим
cоотношениям:
,
3
,
6C2,
В качестве генераторов
можно выбрать
C4
и C3,
которые удовлетворяют следующим
cоотношениям:
![]() = I;
=
I;
C4C3C4
=
. (4.46)
= I;
=
I;
C4C3C4
=
. (4.46)
Группа
Oh
получается
добавлением к группе О
центра инверсии.
Число элементов равно 48: I,
i,
4C3,
4
,
4S6,
4![]() ,
3C4,
3
,
3
,
3S4,
3
,
3C4,
3
,
3
,
3S4,
3![]() ,
6C2,
3h,
6d.
Для этой группы генераторами
можно
выбрать поворот С4
и зеркальный поворот S6,
которые
удовлетворяют соотношениям
,
6C2,
3h,
6d.
Для этой группы генераторами
можно
выбрать поворот С4
и зеркальный поворот S6,
которые
удовлетворяют соотношениям
=
I;
![]() =
I;
C4
=
=
I;
C4
=
![]() C4;
S6
S6
= С4.
C4;
S6
S6
= С4.
Группы симметрии икосаэдра I, Ih. Поскольку молекулы данных групп встречаются крайне редко, на детальной их характеристике не будем останавливаться.
Помимо перечисленных групп, устремив порядок оси С4 к бесконечности, легко получим так называемые непрерывные точечные группы: С, Ch, С,D, Dh. Все точечные группы молекул по порядку осей, содержащихся в них, можно разделить на три вида:
1) низшей симметрии, соответствующей молекулам с осями симметрии Сn и n не выше 2(C1, C2, D2, Di, Ci, Cs, C2h, C2, D2h);
2) средней симметрии, соответствующей молекулам с выделенной осью симметрии с n 3(Cn, Dn, Cnh, Cn, Dnh, Sn, Dnd, Ch, Dh);
3) высшей симметрии кубические группы, соответствующие молекулам с несколькими осями симметрии с n 3(T, Th, Td, O, Oh).
С принадлежностью молекулы к определенному виду групп симметрии тесно связaна возможность вырождения ее уровней энергии. Так, молекулы групп низшей симметрии имеют только невырожденные состояния. В группах средней симметрии наряду с невырожденными появляются и двукратно вырожденные состояния. Тройное вырождение уровней энергии имеет место в группах высшей симметрии.
Весьма существенной характеристикой молекулы с точки зрения формирования оптического спектра является наличие или отсутствие у нее дипольного момента. Последнее же непосредственно связано с симметрией молекулы. Для молекул, имеющих дипольный момент и обладающих определенной симметрией, его направление частично или полностью определяется этой симметрией.
Другой важной характеристикой молекулы является ее поляризуемость, определяемая симметричным тензором поляризуемости (, =x, y, z) с составляющими xx, yy, zz, xy = yx; yz = zy; xz = zx Наличие симметрии накладывает определенные условия на тензор поляризуемости, что существенно сказывается на правилах отбора в спектрах комбинационного рассеяния.
В заключение рассмотрим табл.4.1, в которой несколько по-другому сопоставлены и охарактеризованы наиболее важные из возможных групп симметрии и примеры соответствующих молекул.
Таблица 4. 1
