
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
4.6.2. Элементы и операции симметрии
Рассмотрим более подробно отдельные элементы симметрии и соответствующие им операции симметрии.
1. Ось симметрии обозначают Сn, где n означает порядок оси и может принимать значения n = 1, 2, 3, 4, ... Элементу Сn соответствует операция поворота молекулы на угол 2/n, т. е. такая операция, при выполнении которой молекула переходит сама в себя (новая конфигурация молекулы не отличается от исходной, существовавшей до выполнения поворота). рассмотрим, например, молекулу бензола (рис. 4.7), обладающую наряду с другими элементами осью симметрии 6-го порядка С6.

При
всех операциях поворота на угол 2/n
молекула переходит сама в себя. Отметим,
что этот поворот можно совершать большое
число раз в прямом и обратном направлениях
(т. е. по часовой и против часовой стрелки),
не нарушая равновесной конфигурации.
Например, совершив операцию поворота
С6
три раза (это можно записать как
![]() ),
мы повернем молекулу на 180° без нарушения
равновесной конфигурации.
),
мы повернем молекулу на 180° без нарушения
равновесной конфигурации.
Совершив
указанную операцию пять раз (![]() ),
мы повернем
молекулу на угол 300°. Указанного положения
можно достигнуть повернув молекулу на
угол – 60°. Записывается
это следующим символом
),
мы повернем
молекулу на угол 300°. Указанного положения
можно достигнуть повернув молекулу на
угол – 60°. Записывается
это следующим символом
![]() .
Из
сказанного ясно, что
.
В общем виде
оси Сn
будет
соответствовать
n
операций
симметрии
.
Из
сказанного ясно, что
.
В общем виде
оси Сn
будет
соответствовать
n
операций
симметрии
![]() – поворотов вокруг оси на угол 2/n.
В предельном случае при n
возможны вращения
на
бесконечно малые углы или произвольные
углы (непрерывные вращения).
– поворотов вокруг оси на угол 2/n.
В предельном случае при n
возможны вращения
на
бесконечно малые углы или произвольные
углы (непрерывные вращения).
Ось симметрии C1 означает тождественный элемент симметрии. соответствующая операция симметрии оставляет молекулу неизменной, так как поворот на 360° равносилен его отсутствию (т. е. повороту на 0°).
На рис. 4.8. показано действие операции симметрии С3 на ион NO3–. При этой операции атом кислорода О1 переходит на место О2, О2 – на место О3, а О3 занимает место О1. При этом последующая конфигурация не отличается от предыдущей (кислороды О1, О2 и О3 тождественны).

Операцию
симметрии С3
можно повторять несколько раз
![]() .
при
этом симметрия равновесной конфигурации
не изменяется.
.
при
этом симметрия равновесной конфигурации
не изменяется.
Плоскость, в которой расположен ион NO3–, является плоскостью симметрии h, а это уже следующий элемент симметрии.
2. Плоскость симметрии обозначают символом с индексом или h. Этому элементу симметрии соответствует операция отражения в плоскости, которая переводит молекулу в новую равновесную конфигурацию, неотличимую от первоначальной. Легко показать, что 2 = I (рис. 4.8). – обозначает отражение в вертикальной плоскости, h – то же в горизонтальной плоскости. Если в молекуле имеется несколько осей симметрии, то вертикальная или горизонтальная плоскости рассматриваются относительно оси высшей симметрии. В некоторых молекулах (например, бензол С6H6) присутствует элемент d (диэдрическая плоскость симметрии).
3. Зеркально-поворотная ось порядка n обозначается символом Sn. Ей соответствует операция поворота на угол 2/n вокруг оси с одновременным отражением в плоскости h ,. перпендикулярной к оси, т. е.
Sn = hCn = Cn h (4.36)
Операции
поворота Cn.
и отражения h
коммутируют между собой. Зеркально-поворотная
ось симметрии порядка n(Sn)
является независимым элементом только
для четного n.
Действительно, для четного n
имеется n
операций:
![]()
П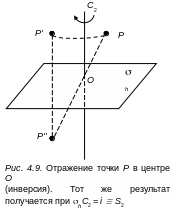 ри
этом ось Sn
одновременно
является осью Cn/2,
порядка n/2.
При нечетном n
зеркально-повторная оcь
представляет собой сочетание оси
симметрии Сn
с плоскостью
симметрии h
и не является независимым элементом
симметрии.
ри
этом ось Sn
одновременно
является осью Cn/2,
порядка n/2.
При нечетном n
зеркально-повторная оcь
представляет собой сочетание оси
симметрии Сn
с плоскостью
симметрии h
и не является независимым элементом
симметрии.
4. Центр симметрии обозначается символом i. Ему соответствует операция симметрии i-отражение в центре (инверсия). Эту операцию с точки зрения групповых законов можно рассматривать как произведение операций поворота вокруг оси 2-го порядка с последующим отражением в плоскости, перпендикулярной к оси, т. е. i = hC2 S2
На рис.4.9. показано действие операции инверсии на точку P в результате мы получаем точку P''. Этот же результат можно получить и путем поворота точки P на 180° с последующим отражением в плоскости бh , перпендикулярной к оси вращения С2.
