
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
4.6. Симметрия молекул
В
многоатомной молекуле можно выделить
одинаковые атомы, химические связи либо
отдельные фрагменты (группы атомов). Их
взаимное пространственное расположение
придает молекуле определенную структурную
форму, которая может быть подобна
некоторой геометрической фигуре. Ввиду
наличия в молекуле одинаковых частей
(атомов), которые можно взаимозаменять
в результате различных поворотов,
отражений, говорят, что молекула в
устойчивом электронном состояния
обладает определенной симметрией
равновесной конфигурации ядер. Атомы
либо структурные группы, которые можно
менять местами, эквивалентны по своей
симметрии. Молекула может обладать
одним или несколькими элементами
симметрии (например, ось симметрии,
плоскость симметрии и др. (рис. 4.6)).
Каждому элементу симметрии соответствует
своя операция симметрии, при которой
равновесная конфигурация молекулы
пер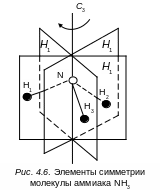 еходит
сама в себя. Эквивалентными атомами или
связями в молекуле будут такие атомы
или связи, которые могут взаимозаменяться
в результате операций симметрии. Все
атомы данного вида, а равным образом и
химические связи, эквивалентные в
отношении симметрии, являются химически
тождественными.
еходит
сама в себя. Эквивалентными атомами или
связями в молекуле будут такие атомы
или связи, которые могут взаимозаменяться
в результате операций симметрии. Все
атомы данного вида, а равным образом и
химические связи, эквивалентные в
отношении симметрии, являются химически
тождественными.
Например, в результате поворота молекулы NH3 на угол 120° вокруг оси третьего порядка (С3), проходящей через атом азота (рис. 4.6.), получим конфигурацию, эквивалентную первоначальной, так как атомы водорода и связи N–H считаются одинаковыми. Следующий поворот на 1200 переводит молекулу NH3 в новое положение, неотличимое от предыдущего. В общем случае молекула с осью симметрии n-го порядка имеет n эквивалентных положений, получающихся одно из другого вращением вокруг этой оси. Операцию вращения рассматривают как операцию симметрии.
Все операции симметрии для молекулы оставляют хотя бы одну точку в пространстве без изменения. Обычно в этой точке пересекаются все оси и плоскости симметрии, поэтому она является центром симметрии (центром тяжести молекулы). Наличие элементов симметрии и соответствующих им операций симметрии позволяет разбить все молекулы по числу и характеру их элементов симметрии на небольшое число групп. Эти группы называются точечными группами симметрии. Точечными потому, что при проведении любой операции симметрии в молекуле всегда имеется хотя бы одна точка, положение которой не меняется при проведении любой операции симметрии, присущей молекуле
4.6.1. Группа. Определение и основные свойства
Впервые понятие группы было введено в математике для описания такой совокупности элементов а, b, с, d, ...., которая подчиняется определенным групповым законам. Природа этих элементов может быть самой разнообразной. Это могут быть числа, перестановки, операции симметрии и др.
Основные законы теории групп можно сформулировать следующим образом:
1. Произведение двух элементов а и b группы дает третий элемент c, принадлежащий группе, т. е.
с = b a. (4.32)
Произведение здесь понимается в обобщенном смысле как комбинация или сочетание двух элементов, которое по определенным правилам дает третий элемент. Это произведение зависит от порядка элементов. Если под a и b понимать операции симметрии, то при записи b a, сначала выполняется операция a, а затем операция b. Обратное не всегда cправедливо. Иначе говоря, для элементов группы коммутативный закон не всегда выполняется, т. е.
ba ab.
2. Совокупность элементов группы содержит единичный элемент I, для которого выполняется правило
aI = Ia = a. (4.33)
Под a здесь понимается любой элемент группы. Для операций симметрии под единичным элементом будем понимать поворот системы на угол, равный нулю (С1) или 360°.
3. Совокупность содержит обратный элемент. Например, элементу а имеется обратный элемент а–1 такой, что
a a–1= a–1 a = 1. (4.34)
Для каждой операции симметрии всегда имеется обратная операция, которая уничтожает действие первой. Например, повороту системы на угол по часовой стрелке всегда найдется обратная операция – поворот той же системы на угол – (против часовой стрелки).
4. Для элементов группы всегда выполняется так называемый ассоциативный закон
c(ba) = (cb), (4.35)
т. е. безразлично умножается сначала a на b, а затем получаемое произведение ba умножить на c, либо умножается a на произведение b на c (т. е. cb). В силу cказанного произведение трех элементов группы можно записывать в виде cba.
Все группы разделяются на конечные и бесконечные в зависимости от того, сколько элементов они содержат. Число элементов в группе называют ее порядком h. Пример группы бесконечного порядка – это число поворотов вокруг оси связи на любой угол в двухатомной молекуле. Эта группа будет являться не только бесконечной, но и непрерывной, т. е. ее элементы (повороты) непрерывным образом зависят от угла , который может принимать любые значения от 0 до 2.
Важным понятием является подгруппа, под которой понимают часть элементов группы, удовлетворяющая групповым условиям.
Группы, для которых выполняется закон коммутативности, т. е. ba = ab, называются абелевыми (в честь норвежского математика Абеля). Все другие группы будут неабелевы, или некоммутативны.
Для молекул мы будем иметь дело с точечными группами симметрии, т. е. такими группами, операции симметрии которых оставляют хотя бы одну точку в пространстве неподвижной. Обычно эта точка является центром тяжести молекулы.
