
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
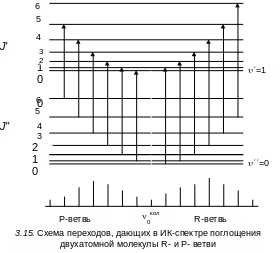
3.6.2 Колебательно-вращательные спектры. Ик-поглощения
Колебательно-вращательные спектры, соответствующие дипольным переходам в ИК области, подвержены следующим правилам отбора для вращательного квантового числа
J = J' – J" = 1. (3.66)
Это правило отбора относится к молекулам, не обладающим в нижнем электронном состоянии механическим моментом (преимущественно сюда относятся молекулы, находящиеся в -состоянии). Колебательные полосы таких молекул будут состоять из R-ветви, т. е. совокупности линий, для которых J = J' – J" = 1, и Р-ветви, т. е. совокупности линий, для которых J = J' – J" = –1.
Схема
переходов, дающих колебательно–вращательную
полосу для R-
и P-ветвей
в ИК-спектре поглощения, показана на
рис. 3.15.
Частоты
R-ветви
всегда расположены в коротковолновую
сторону от частоты
![]()
![]() ,
а частоты Р-ветви расположены с
длинноволновой стороны.
,
а частоты Р-ветви расположены с
длинноволновой стороны.
Выражая Е = Е'вн – Е''вн и частоты переходов в одних и тех же единицах (см–1), мы получим соответствующие формулы для R-ветви (J'– J" = 1)
![]() ,
(3.67)
,
(3.67)
или, выражая J'' через J' (J'' = J' – 1), получим
![]() ,
(3.68)
,
(3.68)
где J' = 1, 2, 3, ...(см. рис.3.15)
Аналогично получим, если произвести замену J' через J''(J'= J'' + 1)
![]() , (3.69)
, (3.69)
где J' = 0, 1, 2, 3, ...
Формулы
(3.68) и
(3.69), дают
ряд линий с частотами
![]() которые при B'
=
B'',
были бы равноотстоящими, но в силу
наличия квадратичного члена с B'
B'
будут
сходиться. Если бы
B'
B'',
линии расходились бы. Для
колебательно-вращательных
спектров имеет место именно первый
случай
B'
B'',
так как '
''.
которые при B'
=
B'',
были бы равноотстоящими, но в силу
наличия квадратичного члена с B'
B'
будут
сходиться. Если бы
B'
B'',
линии расходились бы. Для
колебательно-вращательных
спектров имеет место именно первый
случай
B'
B'',
так как '
''.
Аналогичную картину распределения линий вращательной структуры имеем для Р-ветви (J' – J'' = –1).
![]() ,
(3.70)
,
(3.70)
если выражать J' через J'' (здесь J'' = 1,2 , 3, ...). Можно получить и другую формулу
![]() ,
(3.71)
,
(3.71)
если;
выразить J''
через J'.
Формулы
(3.70) и
(3.71) также
дают ряд линий с
![]() ,
которые при B'
=
B''
были бы равноотстоящими, а в силу наличия
квадратичного члена с B'
B''
будут
расходиться (при B'
B''
они сходились бы). Проанализируем формулы
(3.68) и
(3.70), которые
подобны по своей записи, если J'
и J''
принимают
значения
1,
2, 3,
... Разница
этих формул состоит только в знаке
линейного члена. Если в формуле
(3.68) принять
J'
=
m
, где m
=
1,
2, 3,
...,
а в равенстве
(3.70) положить
J''
=
–m
, то обе
формулы становятся одинаковыми и их
можно записать в виде
,
которые при B'
=
B''
были бы равноотстоящими, а в силу наличия
квадратичного члена с B'
B''
будут
расходиться (при B'
B''
они сходились бы). Проанализируем формулы
(3.68) и
(3.70), которые
подобны по своей записи, если J'
и J''
принимают
значения
1,
2, 3,
... Разница
этих формул состоит только в знаке
линейного члена. Если в формуле
(3.68) принять
J'
=
m
, где m
=
1,
2, 3,
...,
а в равенстве
(3.70) положить
J''
=
–m
, то обе
формулы становятся одинаковыми и их
можно записать в виде
![]() , (3.72)
, (3.72)
где
m
= 1, 2, 3,... для
R-ветви;
m
= –1, –2, –3,
...
для Р-ветви.
В соответствии со знаком m
часто R-ветвь
называют положительной, а Р-ветвь
– отрицательной
ветвью. Зная расстояния между линиями
P-
и R-ветвей,
можно по формулам (3.73) и (3.70) приблизительно
оценить вращательную постоянную, а
затем найти равновесное расстояние rе.
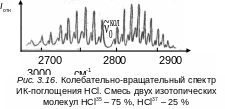
На рис. 3.16 приведен колебательно-вращательный
спектр ИК-поглощения молекулы НСl.
Применяя формулу
(3.72), нужно
всегда помнить, что m
> 0 соответствует
значению вращательного квантового
числа J
= J'
для верхнего колебательного уровня, a
m
<
0 –
значению квантового числа J
= J''
для нижнего,так что симметрия формулы
(3.72)
не является полной. на
рис. 3.16 линии R-ветви
расположены справа от колебательной
частоты
![]() ,
а Р-ветви
– слева. Нулевая линия
,
а Р-ветви
– слева. Нулевая линия
![]() ,
отсутствующая в колебательно-вращательном
спектре, соответствует случаю m
= 0.
В случае B'
= B''
формула
(3.72) упрощается
и принимает вид
,
отсутствующая в колебательно-вращательном
спектре, соответствует случаю m
= 0.
В случае B'
= B''
формула
(3.72) упрощается
и принимает вид
![]() .
(3.73
.
(3.73
Выражение
(3.73) дает
равноотстоящие линии, симметрично
расположенные относительно чисто
колебательной полосы
![]() .
.
В случае двухатомных молекул, у которых электронный момент количества движения не равен нулю, наряду с R- и Р-ветвью появляется Q-ветвь (нулевая) (J = J' – J'' = 0). Для Q-ветви получаем (J = J' = J'')
![]() (3.74)
(3.74)
Так
как разность
(B'
– B'')
мала по сравнению с
B'
и
B'',
то линии
Q-ветви
расположены в длинноволновую сторону
от
![]() (B'
B'')
и при малой дисперсии регистрируемого
прибора сливаются в одну узкую полосу.
(B'
B'')
и при малой дисперсии регистрируемого
прибора сливаются в одну узкую полосу.
