
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
Сущность метода графической экстраполяции заключается в том, что строится график зависимости колебательных интервалов E + 1,, от + 1, который экстраполируется до пересечения с осью абсцисс. Площадь под этой кривой соответствует энергии диссоциации De. Заштрихованная область дает нижний предел . На рис. 3.12 приведен график этой зависимости для молекулы водорода.
При справедливости двучленной формулы для колебательной энергии (3.30), график является прямой линией и соответствующая площадь выражается формулой
![]() .
( 3.51)
.
( 3.51)

При
небольших отступлениях от линейности
получаются несколько иные значения
диссоциации. Действительно, при линейной
зависимости первой разности
![]() ордината в нулевой точке (
+
1),
т. е. при + 1=0,
равна
.
В точке, для которой ордината обращается
в нуль, значение абсциссы
ордината в нулевой точке (
+
1),
т. е. при + 1=0,
равна
.
В точке, для которой ордината обращается
в нуль, значение абсциссы
![]() ,
как это следует из (3.41). Площадь треугольника
определяется формулой
,
как это следует из (3.41). Площадь треугольника
определяется формулой
![]() ,
что согласуется с (3.42). Здесь энергию
диссоциации
отсчитывают от минимума потенциальной
энергии. Реальную же энергию диссоциации
D0
следует
отсчитывать от уровня
=
0,
для которого нулевая энергия равна
,
что согласуется с (3.42). Здесь энергию
диссоциации
отсчитывают от минимума потенциальной
энергии. Реальную же энергию диссоциации
D0
следует
отсчитывать от уровня
=
0,
для которого нулевая энергия равна
![]() ,
,
а энергия диссоциации
D0 = De – E0 . (3.52)
Частоты переходов между соседними уровнями, как следует из (3.50), равны
![]() ,
(3.53)
,
(3.53)
где
отличается от
на величину ангармоничности
![]() .
Следовательно
.
Следовательно
![]() ,
т. е. величина
практически совпадает с экспериментально
измеряемой частотой
,
т. е. величина
практически совпадает с экспериментально
измеряемой частотой
![]() .
( 3.54)
.
( 3.54)
При
графическом определении энергии
диссоциации D0
нужно
откладывать по оси абсцисс
+
1/2,
а по оси ординат
![]() .
Из формулы (3.50) получаем прежний график
(прямую линию), что на рис. 3.12 только
смещенный вправо на 1/2
(см. рис.
3.13).
.
Из формулы (3.50) получаем прежний график
(прямую линию), что на рис. 3.12 только
смещенный вправо на 1/2
(см. рис.
3.13).
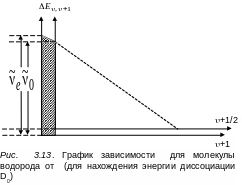
Разница
значений
и
D0
выражается
площадью, заштрихованной на рис. 3.13. Оси
абсцисс на рис. 3.13 совпадают. Действительно,
при
+
1,
согласно (3.35)
![]() а при
а при![]() согласно (3.50)
согласно (3.50)
![]() .
Заштрихованная площадь равна
.
Заштрихованная площадь равна
![]() (нулевая
энергия).
(нулевая
энергия).
Здесь
учтено, что
.
Следовательно, площадь треугольника
S
в координатах
и
![]() меньше площади другого треугольника
на величину E0.
Итак, D0
= De
–
E0
или же
меньше площади другого треугольника
на величину E0.
Итак, D0
= De
–
E0
или же
![]() .
.
П олучаемые
значения энергии диссоциации
и D0,
рассчитываемые описанными выше методами,
отличаются от истинных примерно на
15 %, что указывает на то, что формула
Морзе, аппроксимирующая реальную кривую
потенциальной энергии, является лишь
грубым приближением. Экспериментальные
точки ложатся не на прямую, а на кривую,
которая загибается раньше, т. е. пересекает
ось абсцисс при меньших значениях ,
чем это следует из анализа двучленной
формулы (3.30). На рис. 3.12 и 3.14 показаны
кривые зависимости E+1,
от квантового
числа
для молекул H2
и
Li2.
олучаемые
значения энергии диссоциации
и D0,
рассчитываемые описанными выше методами,
отличаются от истинных примерно на
15 %, что указывает на то, что формула
Морзе, аппроксимирующая реальную кривую
потенциальной энергии, является лишь
грубым приближением. Экспериментальные
точки ложатся не на прямую, а на кривую,
которая загибается раньше, т. е. пересекает
ось абсцисс при меньших значениях ,
чем это следует из анализа двучленной
формулы (3.30). На рис. 3.12 и 3.14 показаны
кривые зависимости E+1,
от квантового
числа
для молекул H2
и
Li2.

Энергия диссоциации определяется как площадь, ограниченная осями координат и реальной кривой, измеренная в соответствующем масштабе.
Энергию диссоциации можно измерить не только спектроскопическими, но и другими методами, которые мы здесь не рассматриваем (например, методом электронного удара, термическим или термохимическим. Знание энергий диссоциации молекул необходимо для термодинамических расчетов в химических реакциях.
Следует отметить, что задача определения энергии диссоциации по спектрам не проста, как может показаться из приведенного изложения. Требуется полная и точная расшифровка колебательного спектра, что не всегда можно довольно полно провести. Например, молекулы Н2, N2 и О2 при обычных условиях не поглощают ИК-радиации (у них отсутствует дипольный момент). Колебательные частоты у аналогичных молекул получают из спектров КР или из ИК-спектров при высоких давлениях, когда при соударениях симметрия (Dh) молекулы нарушается и могут наблюдаться оптически неактивные полосы.
