
- •Глава 1. Общие вопросы спектроскопии молекул
- •1.1. Единицы измерения энергии и длины волны различных видов излучения
- •Переводные множители единиц измерения энергии
- •Длины волн, частоты и энергии различных диапазонов
- •1.2. Ширина уровней энергии и спектральных линий
- •1.3. Распределение молекул по уровням энергии
- •1.4. Вероятности оптических переходов
- •1.5. Квантовомеханический расчет вероятностей переходов
- •1.6. Правила отбора для различных типов излучения и поглощения
- •1.7 Поглощение света классическим электрическим осциллятором
- •Глава 2. Вращательные спектры молекул
- •2.1. Вращение двухатомной молекулы. Классический случай
- •2.2. Квантовомеханический случай
- •Значения вращательной энергии Евр двухатомной молекулы в зависимости от j
- •Вращательные постоянные , межъядерные расстояния re
- •2.3. Вращательные спектры многоатомных молекул
- •2.3.1. Деление молекул на сферические, симметричные и асимметричные волчки
- •2.3.2. Вращательные уровни энергии сферического волчка.
- •2.3.3. Вращательные уровни энергии и спектры молекул типа симметричного волчка
- •2.3.4. Уровни энергии и спектры молекул типа асимметричного волчка
- •Значения энергии вращательных уровней молекулы н2о, см–1
- •2.4. Применения вращательных спектров молекул
- •Вращательные постоянные (в см–1), межатомные расстояния и дипольные
- •Вращательные постоянные и структурные параметры некоторых
- •Глава 3.
- •3.1.Образование двухатомной молекулы. Представление о ее потенциальной кривой.
- •3.2. Колебания двухатомной молекулы как гармонического осциллятора
- •3.2.1. Механическая модель двухатомной молекулы
- •3.2.2. Квантовомеханический случай
- •3.3. Колебания двухатомной молекулы как ангармонического осциллятора
- •3.3.1. Аппроксимация зависимости потенциальной энергии от межьядерного расстояния в реальной молекуле (кривая Морзе)
- •3.3.2 Уровни энергии, правила отбора и спектры двухатомной молекулы как ангармонического осциллятора
- •3.4. Определение энергии диссоциации двухатомной молекулы
- •3.4.1. Аналитический метод
- •3.4.2. Метод графической экстраполяции (метод Берджа – Шпонер)
- •3.5. Колебательные спектры двухатомных молекул с изотопным замещением
- •3.6. Колебательно-вращательные спектры двухатомных молекул
- •3.6.1. Общая характеристика колебательно-вращательных
- •3.6.2 Колебательно-вращательные спектры. Ик-поглощения
- •3.6.3. Колебательно-вращательные спектры кр
- •3.6.4. Интенсивности линий вращательной структуры
- •Глава 4 колебательные спектры многоатомных молекул
- •4.1. Колебательные степени свободы многоатомной молекулы
- •4.2. Колебания многоатомной молекулы в классическом случае
- •4.3. Нормальные координаты и колебания.
- •4.4. Малые колебания в квантовой механике
- •4. 5. Классификация нормальных колебаний по форме
- •4.6. Симметрия молекул
- •4.6.1. Группа. Определение и основные свойства
- •4.6.2. Элементы и операции симметрии
- •4.6.3. Точечные группы симметрии и их элементы
- •Группы симметрии молекул
- •4.7. Примеры применения групповых законов к конкретным молекулам
- •Одно из возможных представлений группы с3
- •4.8. Представления группы симметрии. Линейные преобразования координат, соответствующие операциям симметрии
- •4.9. Выбор колебательных координат для характеристики колебательного движения атомов в молекулах
- •4.10. Анализ симметрии колебаний с помощью теории групп
- •4.11. Типы симметрии колебаний молекул
- •Типы симметрии колебаний и характеры представлений точечной группы симметрии d6h
- •4.12. Порядок нахождения числа колебаний различных типов симметрии
- •Характеры приводимых представлений молекулы воды точечной группы симметрии с.
- •Характеры приводимых представлений молекулы бензола точечной группы симметрии d6h
- •Интерпретация колебательного спектра бензола
- •Частоты и симметрия колебаний свободной и бидентатно-координированной нитратной группы
- •4.14. Спектры комбинационного рассеяния многоатомных молекул
- •4.15. Правила отбора в колебательных спектрах
- •Результирующая симметрия для сочетаний вырожденных состояний точечной группы симметрии d6h
- •4.16. Характеристические частоты колебаний молекулы
- •Характеристические частоты колебаний отдельных функциональных групп
- •Глава 5
- •5.1. Колебательная структура электронного спектра двухатомной молекулы
- •5.2.Относительная интенсивность полос в электронно-колебательном спектре двухатомной молекулы. Принцип Франка – Кондона
- •5.2.2. Квантовомеханический принцип Франка – Кондона
- •5.3. Химическая связь в двухатомной молекуле
- •5.3.1. Общие сведения о двухатомной молекуле
- •5.3.2. Основы метода молекулярных орбиталей (мо)
- •5.4. Типы химических связей в двухатомных молекулах. Σ- и π-связи
- •5.5. Систематика электронных состояний в двухатомной молекуле
- •5.6. Молекулярные электронные оболочки в двухатомной молекуле
- •5.7. Вращательная структура электронно-колебательных полос
- •5.8. Взаимодействие электронного и вращательного движений
- •5.9. Правила отбора в электронно-колебательно-вращательных спектрах двухатомных молекул
- •Глава 6 Электронные спектры многоатомных молекул
- •6.1. Электронные состояния и химические связи в многоатомных молекулах
- •6.1.1 Характеристика электронных состояний в многоатомных молекулах
- •6.2.2. Молекулярные орбитали молекулы формальдегида н2со
- •6.2.3. Молекула бензола с6н6
- •6.4. Некоторые вопросы теории электронно-колебательных спектров многоатомных молекул
- •6.4.1.Адиабатическое приближение
- •. Учет электронно-колебательного взаимодействия. Эффект Герцберга – Теллера
- •6.6. Электронные спектры поглощения ароматических соединений в газовой фазе
- •6.6.1 Бензол
- •6.7.1. Растворы. Ван-дер-ваальсово взаимодействие
- •Молекулярные постоянные и величины межмолекулярных взаимодействий в различных средах
- •6.7.2 Модель Онзагера
- •Реактивное поле, рассчитанное в модели Онзагера, равно
- •6.8. Электронные спектры поглощения растворов бензола и его производных
- •6.8.1. Общие замечания
- •6.8.2 Спектры растворов бензола и его производных с алкильными заместителями
- •6.8.3. Спектры поглощения производных бензола с заместителями, содержащими неподеленные пары электронов
- •6.9. Электронные спектры молекул в твердотельных матрицах. Эффект Шпольского
- •6.10. Электронные спектры поглощения молекулярных кристаллов
- •6.10.1.Общая характеристика молекулярного кристалла
- •6.10.2. Возникновение экситонных состояний в кристаллах. Давыдовское расщепление
- •6.10.3. Электронные спектры поглощения кристаллов бензола, нафталина и антрацена
- •Литература
2.2. Квантовомеханический случай
Совсем по-иному подходит квантовая механика для нахождения энергии жесткого ротатора. Общий квантовомеханический подход для нахождения энергии заключается в решении уравнения Шредингера для жесткого ротатора
![]() ,
(2.7)
,
(2.7)
где
![]() –
оператор Гамильтона для жесткого
ротатора, ψвр
–
вращательная волновая функция, Евр
– собственное
значение энергии оператора.
–
оператор Гамильтона для жесткого
ротатора, ψвр
–
вращательная волновая функция, Евр
– собственное
значение энергии оператора.
Учитывая,
что для жесткого ротатора можно считать
его потенциальную энергию V
= 0,
оператор Гамильтона будет равен только
оператору кинетической энергии
![]() такой системы. Уравнение Шрёдингера
для стационарных состояний жесткого
ротатора формально будет совпадать с
уравнением движения свободной частицы
с кинетической энергией Т
и массой m:
такой системы. Уравнение Шрёдингера
для стационарных состояний жесткого
ротатора формально будет совпадать с
уравнением движения свободной частицы
с кинетической энергией Т
и массой m:
![]() ,
(2.8)
,
(2.8)
где
![]() –
оператор кинетической энергии частицы,
–
оператор кинетической энергии частицы,
![]() –
оператор Лапласа. символ
(набла
в квадрате) означает оператор, определяемый
соотношением
–
оператор Лапласа. символ
(набла
в квадрате) означает оператор, определяемый
соотношением
![]() .
Для вращающегося
ротатора это уравнение можно переписать
следующим образом:
.
Для вращающегося
ротатора это уравнение можно переписать
следующим образом:
![]() ,
(2.9)
,
(2.9)
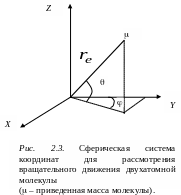
где приведенная масса вращающейся молекулы. Если это уравнение переписать в сферических координатах r, , связанных с декартовыми координатами x, y, z соотношениями x = rsin sin, y = rsincos, z = rcos, то оно примет вид:
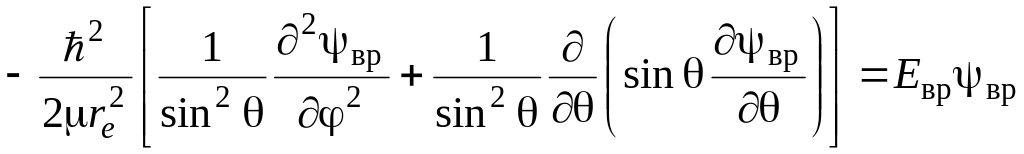 .
(2.10)
.
(2.10)
Здесь учтено то обстоятельство, что из общего выражения Лапласиана
![]() ,
,
первый
член равен нулю, так как радиальная
координата не изменяется в процессе
вращения (жесткий ротатор).
поэтому
вращательная волновая функция
![]() зависит
только от угловых координат
и ,
а значение
r
равно
.
Таким образом,
вращение двух масс m1
и m2
вокруг одной из осей, проходящих через
центр тяжести системы, мы заменяем
вращением массы .
(приведенная масса молекулы), находящейся
на расстоянии
от центра сферической системы координат
(рис. 2.3).
зависит
только от угловых координат
и ,
а значение
r
равно
.
Таким образом,
вращение двух масс m1
и m2
вокруг одной из осей, проходящих через
центр тяжести системы, мы заменяем
вращением массы .
(приведенная масса молекулы), находящейся
на расстоянии
от центра сферической системы координат
(рис. 2.3).
Решение уравнения (2.9) можно представить в виде произведения двух функций ( = f()j(), где функции f и j зависят только от одной переменной. Учет граничных условий приводит к тому, что значение энергии Eвр принимает только дискретные собственные значения:
![]() , (2.11)
, (2.11)
где J – вращательное квантовое число, принимающее значение J = 0, 1, 2, 3, …
Выражение
для энергии вращательных состояний
молекулы можно получить гораздо проще,
не решая уравнения Шрёдингера, а приняв
во внимание только квантование момента
вращения
![]() .
.
Согласно законам квантовой механики для свободной системы (в нашем случае двухатомной молекулы) квантуется квадрат момента количества движения. Он принимает ряд дискретных значений, определяемых формулой
![]() , (2.12)
, (2.12)
где J – вращательное квантовое число, принимающее целые значения (J = 0,1, 2, 3, …).
Одновременно квантуется и проекция вращательного момента количества движения на выделенное направление относительно неподвижной (лабораторной) системы координат. Эту систему координат будем обозначать X, Y, Z в отличие от системы координат X, Y, Z, cвязанной с молекулой. Проекция момента вращения относительно неподвижной оси (скажем, оси Z) равна:
![]() , (2.13)
, (2.13)
где mJ = J, J – 1, …, 0,…, –J принимает 2J + 1 значений. Энергия вращающейся молекулы не зависит от проекции момента количества движения, а только от величины квадрата момента, т. е.
![]() (2.14)
(2.14)
Здесь учтено, что P = I.
Так как энергия молекулы не зависит от проекции момента количества движения, а только от квадрата момента, то говорят, что вращательные уровни анергии свободной молекулы всегда вырождены со степенью вырождения g = 2J + 1 (кроме уровня J = 0, для которого g = 1). Это связано с произвольностью ориентации момента количества движения относительно неподвижной системы координат.
Принимая во внимание выражение (2.12) для квадрата момента количества движения, равенство (2.14) можно переписать следующим образом:
![]() ,
(2.15)
,
(2.15)
где
значение момента инерции
![]() относится
к равновесному расстоянию между атомами
(от латинского слова equilibrium
–
равновесие). Как видим, с учетом квантования
квадрата момента количества движения,
мы получили значение вращательной
энергии, как и в (2.11). Согласно выражению
(2.15) коэффициент при вращательном
квантовом числе есть величина постоянная
для данной молекулы. Обозначим этот
коэффициент через
относится
к равновесному расстоянию между атомами
(от латинского слова equilibrium
–
равновесие). Как видим, с учетом квантования
квадрата момента количества движения,
мы получили значение вращательной
энергии, как и в (2.11). Согласно выражению
(2.15) коэффициент при вращательном
квантовом числе есть величина постоянная
для данной молекулы. Обозначим этот
коэффициент через
![]() ,
тогда формулу (2.15) можно переписать
более просто:
,
тогда формулу (2.15) можно переписать
более просто:
![]() ,
(2.16)
,
(2.16)
где
![]() –
вращательная постоянная, относящаяся
к минимуму кривой потенциальной энергии
и соответствующая равновесному расстоянию
между атомами. Эта постоянная полностью
определяет значение вращательной
энергии двухатомной молекулы. При
изучении оптических спектров вращательную
постоянную
обычно выражают в см–1
(в системе СИ она, как и энергия, выражается
в Дж). Оценим для молекул H2
и HCl
величину
в Дж и в см–1.
для
чего будем использовать ряд фундаментальных
постоянных h
= 6,626·10–34Дж·с;
с= 2,998·108
м/с;
I а.е.м. = 1,66·10–27
кг; Н=1,67310–27
кг; Сl35=58,110–27
кг;
reH2 = 0,074 нм;
reHCl =
0,1275
нм.
–
вращательная постоянная, относящаяся
к минимуму кривой потенциальной энергии
и соответствующая равновесному расстоянию
между атомами. Эта постоянная полностью
определяет значение вращательной
энергии двухатомной молекулы. При
изучении оптических спектров вращательную
постоянную
обычно выражают в см–1
(в системе СИ она, как и энергия, выражается
в Дж). Оценим для молекул H2
и HCl
величину
в Дж и в см–1.
для
чего будем использовать ряд фундаментальных
постоянных h
= 6,626·10–34Дж·с;
с= 2,998·108
м/с;
I а.е.м. = 1,66·10–27
кг; Н=1,67310–27
кг; Сl35=58,110–27
кг;
reH2 = 0,074 нм;
reHCl =
0,1275
нм.
Вычислим моменты инерции Ie:
![]()
 Вычислим
в
Дж:
Вычислим
в
Дж:
 .
.
Учитывая,
что величина
![]() постоянна и равна в системе СИ
5,5610–69(Дж)2с2,
то выражение для
постоянна и равна в системе СИ
5,5610–69(Дж)2с2,
то выражение для
![]() будет иметь более простой вид:
будет иметь более простой вид:


Вычислим
в см–1
(так как
![]() ,
то для выражения
в см–1
необходимо полученные величины выражать
в системе СИ за исключением постоянной
с, которую следует выражать в смс–1).
Итак, получим:
,
то для выражения
в см–1
необходимо полученные величины выражать
в системе СИ за исключением постоянной
с, которую следует выражать в смс–1).
Итак, получим:
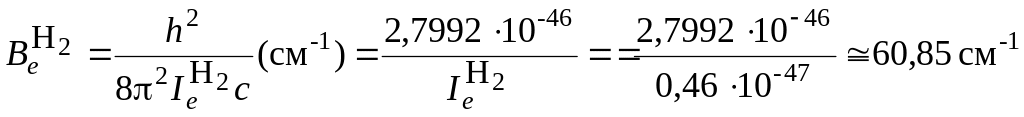
![]() .
.
Из оценки вращательной постоянной видно, что чисто вращательные спектры располагаются в далекой ИК-области, соответствующей сантиметровому и миллиметровому диапазонам.
Так как значения вращательной энергии квадратично зависят от вращательного квантового числа J, то уровни вращательной энергии представляют собой расходящуюся последовательность.
В табл. 2.1 приведены значения Евр в зависимости от вращательного квантового числа J, а в табл. 2.2 межъядерные расстояния двухатомных молекул. Чтобы описать спектр поглощения или испускания, необходимо знать вероятности переходов между уровнями энергии и правила отбора.
Таблица 2.1
