
- •Глава 1. Гематологические исследования
- •Глава 2. Цитохимические исследования
- •Глава 3. Общеклинические исследования
- •Глава 4. Биохимические исследования
- •Глава 5. Система гемостаза
- •Глава 6. Лекарственный мониторинг
- •Глава 7. Иммунологические исследования
- •Глава 8. Серологические исследования
- •Глава 9. Гормональные исследования
- •Глава 10. Реологические свойства крови и их значение в клинической практике
- •Кровь Общеклиническое исследование крови
- •В норме [Тиц II., 1997]
- •1. Тромбоцитопении, связанные со снижением образования тромбоцитов (недостаточность кроветворения).
- •Лейкоцитарная формула крови
- •Базофилы
- •Лимфоциты
- •Содержания лимфоцитов
- •Изменения размера
- •Изменения формы
- •Включения в эритроцитах
- •Ядросодержащие клетки эритроцитарного ряда
- •Скорость оседания эритроцитов (соэ)
- •Ретикулоциты
- •Время свертывания крови (по Сухареву)
- •Длительность кровотечения (по Дуке)
- •Плазмодии малярии в крови
- •Осмотическая резистентность эритроцитов
- •Серповидные эритроциты в крови
- •Эритроцитометрия
- •Пунктат костного мозга Миелограмма
- •Иммунный агранулоцитоз
- •Лейкемоидные реакции
- •Лейкемоидные реакции лимфатического и моноцитарного типа
- •Острые лейкозы
- •Эритремия
- •Хронический лимфолейкоз
- •Цитохимическая характеристика клеток крови и костного мозга в норме
- •Активность миелопероксидазы
- •Активность щелочной фосфатазы
- •При различных заболеваниях
- •Активность кислой фосфатазы
- •Активность альфа-нафтилацетатэстеразы
- •Активность альфа-нафтилацетатэстеразы с фторидом натрия
- •Активность нафтол-а8-ацетатэстеразы
- •Активность нафтол -as - d -хлорацетатэстеразы
- •Активность глюкозо-6-фосфатдегидрогеназы
- •Гликоген в клетках
- •Липиды в клетках
- •Сидероциты и сидеробласты
- •МочаОбщеклиническое исследование мочи
- •Химическое исследование
- •Причины увеличения выделения уробилиногена с мочой
- •Белок в суточном количестве мочи
- •Глюкозурический профиль
- •Проба по Адцису—Каковскому
- •Проба по Нечипоренко
- •Проба по Зимницкому
- •Стаканные пробы
- •Общеклиническое исследование жидкости из плевральной полости и перикарда
- •Бактериоскопическое исследование жидкости из плевральной полости и перикарда
- •Общеклиническое исследование жидкости из брюшной полости
- •[Каль л., 1995]
- •Пунктаты кистовидных образований
- •Мокрота Общеклиническое исследование мокроты
- •Волокна
- •Спирали и кристаллы
- •Бактериоскопическое исследование мокроты
- •Исследование мокроты методом флотации
- •[Черняев л.А., 1996]
- •Слизь из носа
- •Спинномозговая жидкость Общеклиническое исследование спинномозговой жидкости
- •Спинномозговая жидкость при менингитах
- •Спинномозговая жидкость при закрытой черепно-мозговой травме
- •Спинномозговая жидкость при геморрагическом инсульте
- •Бактериоскопическое исследование спинномозговой жидкости
- •Желудочное содержимое Общеклиническое исследование желудочного содержимого
- •Дуоденальное содержимое Общеклиническое исследование дуоденального содержимого
- •Микроскопическое исследование желчи
- •Общеклиническое исследование кала
- •Копрограмма в норме
- •Копрограмма при патологии
- •Скрытая кровь в кале
- •Яйца глистов в кале
- •Простейшие в кале
- •Соскоб с перианальных складок на энтеробиоз
- •Общеклиническое исследование отделяемого из влагалища
- •Тумилович л.Г., 1995]
- •Общеклиническое исследование отделяемого из цервикального канала
- •Общеклиническое исследование секрета предстательной железы
- •Микроскопическое исследование
- •Кожа и ногтевые пластинки Общеклиническое исследование содержимого пузырей при дерматозах
- •Исследование ресничек и содержимого розовых угрей на демодекоз
- •Белки и белковые фракцииОбщий белок в сыворотке
- •Альбумин в сыворотке
- •Белковые фракции сыворотки
- •Альбумин в моче
- •Специфические белки
- •Кислый альфа- 1-гликопротеин в сыворотке
- •Альфа-1-антитрипсин в сыворотке
- •Белок сывороточного амилоида а
- •Гаптоглобин в сыворотке
- •Альфа-2-макроглобулин в сыворотке
- •Витамин-а-связывающий белок в сыворотке
- •И хирургических вмешательств
- •Цистатин с в сыворотке
- •Витамин в12 в сыворотке
- •Показатели азотистого обмена Мочевина (азот мочевины) в сыворотке
- •Мочевина (азот мочевины) в моче
- •Креатинин в сыворотке
- •Креатинин в моче
- •Клиренс эндогенного креатинина (проба Реберга—Тареева)
- •Мочевая кислота в сыворотке
- •Мочевая кислота в моче
- •Аммиак в сыворотке
- •Гомоцистеин в сыворотке
- •Молекулы средней массы в крови
- •Молекулы средней массы в моче
- •Глюкоза в крови
- •Глюкоза в спинномозговой жидкости
- •Гликемический профиль
- •Глюкозотолерантный тест
- •Гликозилированный гемоглобин в крови
- •Фруктозамин в сыворотке
- •Молочная кислота (лактат) в крови
- •Пировиноградная кислота (пируват) в сыворотке
- •Липиды, липопротеины и аполипопротеины
- •Общие липиды в сыворотке
- •Общий холестерин (хс) в сыворотке
- •Альфа-холестерин (лпвп-хс) в сыворотке
- •Лпвп-хс [Климов а.Н., 1984]
- •Лпвп-хс
- •Бета-холестерин (лпнп-хс) в сыворотке
- •Электрофоретический анализ липопротеинов
- •Типирование дислипопротеинемий
- •Липонротеин(а) в сыворотке
- •Общие фосфолипиды в сыворотке
- •Неэстерифицированные (свободные) жирные кислоты (нэжк) в сыворотке
- •Показатели пигментного обмена Образование желчных пигментов
- •Общий билирубин в сыворотке
- •Прямой билирубин в сыворотке
- •Непрямой билирубин в сыворотке
- •Желчные кислоты в сыворотке
- •Ферменты и изоферменты
- •Аспартатаминотрансфераза (act) в сыворотке
- •Аланинаминотрансфераза (алт) в сыворотке
- •Общая лактатдегидрогеназа (лдг) в сыворотке
- •Щелочная фосфатаза в сыворотке
- •Лейцинаминопептидаза (лап) в сыворотке
- •Сорбитолдегидрогеназа (сдг) в сыворотке
- •Глутаматдегидрогеназа (ГлДг) в сыворотке
- •Холинэстераза (хэ) в сыворотке
- •Альфа-амилаза в сыворотке и моче
- •Альфа-амилаза в содержимом брюшной полости
- •Панкреатическая альфа-амилаза в сыворотке и моче
- •Липаза в сыворотке
- •Трипсин в сыворотке
- •Панкреатическая эластаза-1 в сыворотке
- •Панкреатическая эластаза-1 в кале
- •Кислая фосфатаза в сыворотке
- •Глютатионпероксидаза (гп) в крови
- •Маркеры повреждения миокарда
- •Общая креатинкиназа (кк) в сыворотке
- •Миоглобин в сыворотке
- •Тропонин т в сыворотке
- •Тропонин I в сыворотке
- •Изофермент лдг-1 в сыворотке
- •Маркеры повреждения мозговой ткани Белок s-100 в сыворотке
- •Водно-электролитный обмен Калий в сыворотке
- •Натрий в сыворотке
- •Калий в эритроцитах
- •Натрий в эритроцитах
- •Калий в спинномозговой жидкости
- •Натрий в спинномозговой жидкости
- •Калий в моче
- •Натрий в моче
- •Повышено
- •Общий кальций в моче
- •Неорганический фосфор в сыворотке
- •Неорганический фосфор в моче
- •Магний в сыворотке
- •Хлор в сыворотке
- •Гипохлоремия
- •Хлор в спинномозговой жидкости
- •Хлор в моче
- •Типовые нарушения осмотического гомеостаза
- •I. Нарушения, связанные с увеличением содержания основных осмотически активных веществ в плазме:
- •III. Нарушения, связанные с водным дисбалансом:
- •IV. Смешанные нарушения
- •Нарушения, связанные с водным дисбалансом
- •Смешанные нарушения осмобаланса
- •Клиническое применение осмометрии
- •Показатели кос
- •Формы нарушений кос
- •Диагностика дыхательной недостаточности
- •Показатели метаболизма железа Железо в сыворотке
- •[Авцын а.П., 1990]
- •Общая железосвязывающая способность сыворотки
- •Ферритин в сыворотке
- •Микроэлементы Медь в сыворотке
- •[Авцын а.П., 1990]
- •Цинк в сыворотке
- •[Авцын а.П., 1990]
- •Кобальт в сыворотке
- •[АвцынА.П., 1990]
- •Марганец в крови
- •Хром в крови
- •Молибден в сыворотке
- •Ванадий в крови
- •Селен в крови
- •Кремний в сыворотке
- •Никель в сыворотке
- •Оценка первой фазы плазменного гемостаза — образования протромбиназы
- •Оценка второй фазы плазменного гемостаза — образования тромбина
- •Тромбиновое время
- •Антитромбин III (at III)
- •Тромбогеморрагических осложнений
- •Г л а в а 6 лекарственный мониторинг
- •Гентамицин в сыворотке
- •Амикацин в сыворотке
- •Ванкомицин в сыворотке
- •Дигоксин в сыворотке
- •Дигитоксин в сыворотке
- •Фенобарбитал в сыворотке
- •Теофиллин в сыворотке
- •Хинидин в сыворотке
- •Новокаинамид в сыворотке
- •Лидокаин в сыворотке
- •Литий в сыворотке
- •Гуморальный иммунитет
- •IgA в сыворотке
- •IgM в сыворотке
- •IgG в сыворотке
- •Заболеваниях
- •Ревматических заболеваниях
- •Иммуноэлектрофорез белков сыворотки крови
- •Иммуноэлектрофорез белков мочи
- •Криоглобулины в сыворотке
- •Клеточный иммунитет
- •Натуральные киллеры (cd 16) в крови
- •Трансформация лимфоцитов
- •Агломерация лейкоцитов крови
- •Организма
- •Фагоцитоз
- •Активность нейтрофилов
- •Лизоцим в крови
- •Система комплемента
- •Цитокины
- •При иммунодефицитах
- •Фенотипирование гемобластозов
- •Титр антител к нуклеарным антигенам (антинуклиарный фактор) в сыворотке
- •Ревматоидный фактор (рф) в сыворотке
- •Антистрептолизин-0 (асло) в сыворотке
- •Синдрома
- •Антикардиолипиновые антитела в сыворотке
- •Волчаночный антикоагулянт в плазме
- •Диагностика аутоиммунных заболеваний
- •[Лукьянчиков b.C. И др., 1995]
- •Диагностика аутоиммунных заболеваний щитовидной железы
- •Диагностика аутоиммунных повреждений поджелудочной железы
- •Диагностика аутоиммунных повреждений надпочечников
- •Исследование онкомаркеров
- •Альфа-фетопротеин (афп) в сыворотке
- •Карбогидратный антиген са-19-9 в сыворотке
- •Карбогидратный антиген са-72-4 в сыворотке
- •Раковый антиген са-15-3 в сыворотке
- •Бета-2-микроглобулин в сыворотке и моче
- •Диагностика сифилиса
- •С результатами риф
- •Антигенами
- •Серологическая диагностика вирусных инфекций
- •Спид-индикаторные болезни
- •Антитела к вич в сыворотке
- •В сыворотке
- •Вирусные гепатиты
- •Вирусный гепатит а
- •Вирусный гепатит в
- •Вирусный гепатит с
- •Вирусный гепатит d
- •Вирусный гепатит е
- •Цитомегаловирусная инфекция
- •Герпетическая инфекция
- •Вирусный паротит
- •Ветряная оспа
- •Краснуха
- •Аденовирусная инфекция
- •Респираторно-синцитиальная инфекция
- •Инфекционный мононуклеоз
- •Серологическая диагностика бактериальных инфекций
- •Инфекции, вызываемые стафилококками
- •Инфекции, вызываемые пневмококками
- •Инфекции, вызываемые гемофильной палочкой
- •Менингококковая инфекция
- •Бруцеллез
- •Сальмонеллезная инфекция
- •Туберкулез
- •Дифтерия
- •Антитела к дифтерийному токсину в сыворотке
- •Легионеллез
- •Иерсиниоз
- •Псевдотуберкулез
- •Хеликобактериоз
- •Хламидийная инфекция
- •Микоплазменная инфекция
- •Гонорея
- •Амебиаз
- •Токсоплазмоз
- •Криптоспоридиоз
- •Серологическая диагностика паразитарных инфекций Эхинококкоз
- •Токсокароз
- •Пневмоцистоз
- •Серологическая диагностика грибковых инфекций Аспергиллез
- •Кандидоз
- •Обнаружение вируса гепатита с
- •Обнаружение вируса гепатита в
- •Обнаружение цитомегаловируса
- •Обнаружение вируса папилломы человека
- •Обнаружение микобактерий туберкулеза
- •Обнаружение Helicobacter pylori
- •Обнаружение гонококков
- •Обнаружение микоплазм
- •Обнаружение Chlamidia trachomatis
- •Г л а в а 9 гормональные исследования
- •Гормоны гипоталамуса
- •Гормоны гипофиза
- •Регуляция секреции гормонов гипоталамуса и гипофиза
- •Лабораторная диагностика
- •Соматотропный гормон (стг) в сыворотке
- •Соматомедин с (см) в сыворотке
- •Функциональное состояние
- •Системы
- •Кортизол в сыворотке
- •Свободный кортизол в моче
- •И установление его этиологии
- •Кортикостероидсвязывающий глобулин (ксг) в сыворотке
- •Функциональное состояние щитовидной железы
- •Биосинтез и метаболизм гормонов щитовидной железы
- •Метаболический эффект гормонов щитовидной железы
- •Тиреотропный гормон (ттг) в сыворотке
- •Общий трийодтиронин (тз) в сыворотке
- •Концентрация тз
- •Общий тироксин (т4) в сыворотке
- •Свободный трийодтиронин (сТз) в сыворотке
- •Свободный тироксин (сТ4) в сыворотке
- •Тиреоглобулин (тг) в сыворотке
- •Кальцитонин (кт) в сыворотке
- •Эутиреоидный (нетоксический) зоб
- •Гипотиреоз
- •Гипертиреоз (тиреотоксикоз)
- •Тиреоидиты
- •[Гончаров н.П., 1995]
- •Рак щитовидной железы
- •Функциональное состояние репродуктивной системы
- •Гонадотропин-рилизинг гормон
- •Гонадотропины
- •Лютеинизирующий гормон (лг) в сыворотке
- •Пролактин в сыворотке
- •Ингибин в сыворотке
- •Активин в сыворотке
- •Фоллистатин в сыворотке
- •Половые стероиды
- •Эстрадиол в сыворотке
- •Тестостерон в сыворотке
- •Гормоны плаценты
- •Гормональная регуляция сперматогенеза
- •Первичная аменорея
- •Гипогонадотропный гипогонадизм
- •Вторичная аменорея
- •Яичниковая гиперандрогенемия
- •Надпочечниковая гиперандрогенемия
- •Климактерический синдром
- •Антидиуретический гормон в плазме
- •Функциональное состояние ренин - ангиотензин - альдостероновой системы
- •В плазме
- •Эндотелии в плазме
- •Мелатонин в сыворотке
- •Функциональное состояние гормональных систем регуляции обмена кальция
- •Маркеры метаболизма и резорбции костной ткани
- •Пиридинолин (Пид) и дезоксипиридинолин (Дпид) в моче
- •Функциональное состояние симпатикоадреналовой системы
- •Адреналин и норадреналин в моче
- •Общие метанефрины в моче
- •Общие норметанефрины в моче
- •Ванилилминдальная кислота в моче
- •Инсулин в сыворотке
- •Инсулина в крови
- •Проинсулин в сыворотке
- •Глюкагон в плазме
- •Соматостатин в плазме
- •Панкреатический пептид (пп) в сыворотке
- •Рецепторы к инсулину
- •Инкреторная функция желудочно-кишечного тракта
- •Гастрин в плазме
- •Секретин в плазме
- •Серотонин в сыворотке
- •Гистамин в сыворотке
- •Синдром множественных эндокринных неоплазий
- •Эритропоэтин в сыворотке
- •Альфа-фетопротеин (афп) и свободный хорионический гонадотропин (хг) в сыворотке (тест на врожденные пороки развития цнс)
- •Неонатальный тиреотропный гормон — hTsh (тест на врожденный гипотиреоз)
- •Исследование крови на фенилкетонемию
- •Исследование крови на галактоземию
- •Кровообращение в сосудах зоны микрогемоциркуляции и его связь с системной гемодинамикой
- •Система микрогемоциркуляции (структура и функции)
- •Реометрия крови
- •Исследование процесса агрегации форменных элементов крови
- •Общие закономерности расстройств микрогемоциркуляции
- •Феномен внутрисосудистой агрегации форменных элементов крови
- •Синдром повышенной вязкости крови
- •Сосудов
- •214000, Г. Смоленск, проспект им. Ю. Гагарина, 2.
Кремний в сыворотке
Содержание кремния в сыворотке в норме составляет 152±9 мкг/л.
Наиболее богаты кремнием соединительная ткань аорты, трахеи, сухожилия, кость, кожа. Высокое содержание кремния в соединительной ткани связано с его присутствием в качестве структурного компонента в составе гликозоаминогликанов и их белковых комплексов, образующих остов данных тканей и придающих им прочность и упругость. Кремний необходим для процессов оссификации, в первую очередь для формирования основного вещества кости и хряща, и непосредственно участвует в процессе минерализации костной ткани. Физиологическая роль кремния при этом связана в основном с синтезом гликозоаминогликанов и коллагена. Функция кремния в синтезе коллагена связана со способностью данного МЭ активировать пролингидроксилазу. Кремний — плохо изученный МЭ, поэтому убедительных данных о патологических процессах, обусловленных дефицитом кремния, до настоящего времени нет, хотя в литературе встречаются отдельные сообщения, свидетельствующие о пониженном содержании этого МЭ при ряде патологических состояний.
Один из простых диагностических признаков недостаточности кремния в организме — повышенная ломкость ногтей, которые утрачивают нормальную флюоресценцию в ультрафиолетовом свете. Гипотетические силиконовые состояния: силиконовый дерматоз с недоразвитием придатков кожи, силиконовая онихопатия, силиконовая ангиопатия (типа синдрома Марфана), силиконовая аортопатия, силиконовая остеопатия.
Общий гиперсиликоз организма развивается при избыточном поступлении кремния, а также при нарушении его экскреции. Локальные формы силикоза: пневмокониоз (силикоз), нефросиликоз (эндемический кремниевый нефролитиаз), силикокальциноз лимфатических узлов корня легкого, окулосиликоз.
Пусковым механизмом развития силиконовых изменений как в легких, так и в других тканях являются фагоцитоз частиц кремнезема макрофагами, гибель последних и активация фибробластов, которые и запускают процессы склерозирования тканей с образованием склеротических силиконовых узлов с зоной эксцентричного роста.
16-5812
241
Никель в сыворотке
Содержание никеля в сыворотке в норме — 1,0—28,0 мкг/л.
Никель относится к малоизученным МЭ. В организме человека он играет определенную физиологическую роль. Уже в период эмбриогенеза никель концентрируется в тех органах и тканях, где происходят интенсивные обменные процессы и где сосредоточен биосинтез гормонов, витаминов и других биологически активных соединений.
Никель участвует в следующих биологических процессах:
активно участвует в гемопоэзе, способствуя всасыванию железа в пищеварительном тракте;
он необходим для отделения плаценты и предупреждения атонических кровотечений в послеродовом периоде. Его содержание в крови у рожениц сразу после родов, но до от деления плаценты, повышается в 20 раз, однако уже через 60 мин после отделения пла центы возвращается к норме;
участвует в гормональной регуляции организма, в частности вовлекается в обмен про- лактина;
принимает участие в структурной организации и функционировании основных клеточ ных компонентов — ДНК, РНК и белков.
Никельдефицитные состояния у человека не описаны, но возможны. Группу риска составляют больные с нарушением всасывания МЭ слизистой оболочкой желудочно-кишечного тракта при хронических гастроэнтероколитах.
Важнейшие заболевания, синдромы, признаки избытка никеля.
Профессиональные интоксикации никелем, сопровождающиеся литейной лихорад кой, ринитом, носовыми кровотечениями, отеком легких, токсической пневмонией, пневмосклерозом, гепатитом, постнекротическим циррозом; никелевым дерматитом (никелевая чесотка, никелевая экзема); изъязвлениями слизистой оболочки носа.
Никелевый рак слизистой оболочки носа, его придаточных пазух, бронхогенный рак легких.

 Г
л а в а 5 СИСТЕМА
ГЕМОСТАЗА
Г
л а в а 5 СИСТЕМА
ГЕМОСТАЗА


 Система
гемостаза —
совокупность функционально-морфологических
и биохимических механизмов,
обеспечивающих сохранение жидкого
состояния крови, предупреждение и
остановку кровотечений, а также
целости кровеносных сосудов.
Система
гемостаза —
совокупность функционально-морфологических
и биохимических механизмов,
обеспечивающих сохранение жидкого
состояния крови, предупреждение и
остановку кровотечений, а также
целости кровеносных сосудов.
В целостном организме при отсутствии каких-либо патологических воздействий жидкое состояние крови является следствием равновесия факторов, обусловливающих процессы свертывания и препятствующих их развитию. Нарушение подобного баланса может быть вызвано очень многими факторами, однако вне зависимости от этиологических причин тром-бообразование в организме происходит по единым законам с включением в процесс определенных клеточных элементов, энзимов и субстратов.
В свертывании крови различают два звена: клеточный (сосудисто-тромбоцитарный) и плазменный (коагуляционный) гемостаз.
Под клеточным гемостазом понимают адгезию клеток (т.е. взаимодействие клеток с чужеродной поверхностью, в том числе и с клетками иного вида), агрегацию (склеивание одноименных клеток крови между собой), а также высвобождение из форменных элементов веществ, активирующих плазменный гемостаз.
Плазменный (коагуляционный) гемостаз представляет собой каскад реакций, в которых участвуют факторы свертывания крови, завершающийся процессом фибринообразования. Образовавшийся фибрин подвергается далее разрушению под влиянием плазмина (фибри-нолиз).
Важно отметить, что деление гемостатических реакций на клеточные и плазменные является условным, однако оно справедливо в системе in vitro и существенно облегчает выбор адекватных методик и интерпретацию результатов лабораторной диагностики патологии гемостаза. В организме эти два звена свертывающей системы крови тесно связаны и не могут функционировать раздельно.
Очень важную роль в осуществлении реакций гемостаза играет сосудистая стенка. Эндо-телиальные клетки сосудов способны синтезировать и/или экспрессировать на своей поверхности различные биологически активные вещества, модулирующие тромбообразование. К ним относятся фактор Виллебранда, эндотелиальный фактор релаксации (оксид азота), простациклин, тромбомодулин, эндотелии, активатор плазминогена тканевого типа, ингибитор активатора плазминогена тканевого типа, тканевый фактор (тромбопластин), ингибитор пути тканевого фактора и некоторые другие. Кроме того, мембраны эндотелиоцитов несут на себе рецепторы, которые при определенных условиях опосредуют связывание с молекулярными лигандами и клетками, свободно циркулирующими в кровотоке.
При отсутствии каких-либо повреждений выстилающие сосуд эндотелиальные клетки обладают тромборезистентными свойствами, что способствует поддержанию жидкого состояния крови. Тромборезистентность эндотелия обеспечивается:
контактной инертностью внутренней, обращенной в просвет сосуда поверхности этих клеток;
синтезом мощного ингибитора агрегации тромбоцитов — простациклина;
наличием на мембране эндотелиоцитов тромбомодулина, который связывает тром бин; при этом последний утрачивает способность вызывать свертывание крови, но со храняет активирующее действие на систему двух важнейших физиологических анти коагулянтов — протеинов С и S;
высоким содержанием на внутренней поверхности сосудов мукополисахаридов и фик сацией на эндотелии комплекса гепарин—антитромбин III;
16- 243
способностью секретировать и синтезировать тканевый активатор плазминогена, обеспечивающий фибринолиз;
способностью стимулировать фибринолиз через систему протеинов С и S.
Нарушение целости сосудистой стенки и/или изменение функциональных свойств эн-дотелиоцитов могут способствовать развитию протромботических реакций — антитромботи-ческий потенциал эндотелия трансформируется в тромбогенный. Причины, приводящие к травме сосудов, весьма разнообразны и включают в себя как экзогенные факторы (механические повреждения, лучевое воздействие, гипер- и гипотермия, токсические вещества, в том числе и лекарственные препараты, и т.п.), так и эндогенные факторы. К последним относятся биологически активные вещества (тромбин, циклические нуклеотиды, ряд цитоки-нов и т.п.), способные при определенных условиях проявлять мембраноагрессивные свойства. Такой механизм поражения сосудистой стенки характерен для многих заболеваний, сопровождающихся склонностью к тромбообразованию.
Абсолютно все клеточные элементы крови принимают участие в тромбогенезе, но для тромбоцитов (в отличие от эритроцитов и лейкоцитов) прокоагулянтная функция является основной. Тромбоциты не только являются главными клеточными участниками процесса тромбообразования в артериях и важными компонентами, обеспечивающими флеботромбоз, но также обладают существенным влиянием на другие звенья гемокоагуляции, представляя активированные фосфолипидные поверхности, необходимые для реализации процессов плазменного гемостаза, высвобождая в кровь ряд факторов свертывания, модулируя фибринолиз и нарушая гемодинамические константы как путем транзиторной вазоконстрикции, обусловленной генерацией ТХА2 (тромбоксан А2), так и путем образования и выделения ми-тогенных факторов, способствующих гиперплазии сосудистой стенки. При инициации тром-богенеза происходит активация тромбоцитов (т.е. активация тромбоцитарных гликопротеи-нов и фосфолипаз, обмен фосфолипидов, образование вторичных посредников, фосфорили-рование белков, метаболизм арахидоновой кислоты, взаимодействие актина и миозина, №+/Н+-обмен, экспрессия фибриногеновых рецепторов и перераспределение ионов кальция) и индукция процессов их адгезии, реакции высвобождения и агрегации; при этом адгезия предшествует развитию реакции высвобождения и агрегации тромбоцитов и является первой ступенью формирования гемостатического процесса.
При нарушении эндотелиальной выстилки субэндотелиальные компоненты сосудистой стенки (фибриллярный и нефибриллярный коллаген, эластин, протеогликан и др.) вступают в контакт с кровью и образуют поверхность для связывания фактора Виллебранда, который не только стабилизирует фактор VIII в плазме, но и играет ключевую роль в процессе адгезии тромбоцитов, связывая субэндотелиальные структуры с рецепторами клеток (схема 5.1). Следует отметить, что взаимодействие тромбоцитарных рецепторов с фактором Виллебранда возможно только при наличии сил, создаваемых кровотоком.
Адгезия тромбоцитов к тромбогенной поверхности сопровождается их распластыванием. Этот процесс необходим для осуществления более полного взаимодействия тромбоцитарных рецепторов с фиксированными лигандами, что способствует дальнейшему прогрес-сированию тромбообразования, так как, с одной стороны, обеспечивает более прочную связь адгезированных клеток с сосудистой стенкой, а с другой стороны иммобилизованные фибриноген и фактор Виллебранда способны выступать в качестве тромбоцитарных агонистов, способствуя дальнейшей активации этих клеток.
Помимо взаимодействия с чужеродной (в том числе и поврежденной сосудистой) поверхностью, тромбоциты способны прилипать друг к другу, т.е. агрегировать. Агрегацию тромбоцитов вызывают различные по своей природе вещества, например тромбин, коллаген, АДФ, арахидоновая кислота, тромбоксан А2, простагландины G2 и Н2, серотонин, адреналин, фактор активации тромбоцитов и др. Проагрегантами могут быть и вещества, отсутствующие в организме, например латекс.
Как адгезия, так и агрегация тромбоцитов могут приводить к развитию реакции высвобождения — специфического Са2+-зависимого секреторного процесса, при котором тромбоциты выбрасывают содержимое некоторых своих внутриклеточных образований в экстрацеллюлярное пространство. АДФ, адреналин, субэндотелиальная соединительная ткань и тромбин являются физиологически важными агентами, индуцирующими реакцию высвобождения. Вначале высвобождается содержимое плотных гранул: АДФ, серотонин, Са2+; высвобождение содержимого а-гранул (тромбоцитарный фактор 4, р-тромбоглобу-лин, тромбоцитарный фактор роста, фактор Виллебранда, фибриноген и фибронектин) требует более сильной стимуляции тромбоцитов. Липосомальные гранулы, содержащие
244
Схема
5.1.
ТРОМБОЦИТАРНЫЙ ГЕМОСТАЗ [БАРКАГАН З.С.,
1998]
ПОВРЕЖДЕНИЕ СОСУДА
Г" Коллаген
АДФ
■ Лабилизация-
мембраны тромбоцитов I
Гемолиз
Высвобождение Са2+
АГРЕГАЦИЯ
I
АГРЕГАЦИЯ
II

Са , Mg , белковые плазменные кофакторы
Реакция высвобождения (АДФ, адреналин и др.)
АДГЕЗИЯ
т
Изменение формы, образование отростков, активация фосфолипазы А2
Арахидоновая кислота .Тромбоксан Аг
Реакция высвобождения (4-й фактор, (З-тромбоглобулин, ростовой фактор, тромбоспондин)

 СГУСТОК,
ТРОМБ
СГУСТОК,
ТРОМБ
Тромбин
Фибриноген
Фибрин


РЕТРАКЦИЯ
П римечание:
-»
— активация, — переход из одного
состояния в другое.
римечание:
-»
— активация, — переход из одного
состояния в другое.
кислые гидролазы, высвобождаются только в присутствии концентрированного коллагена или тромбина. Следует отметить, что высвободившиеся из тромбоцитов факторы способствуют закрытию дефекта сосудистой стенки и развитию гемостатической пробки, однако при достаточно выраженном поражении сосуда дальнейшая активация тромбоцитов и их адгезия к травмированному участку сосудистой поверхности формирует основу для развития распространенного тромботического процесса с последующей окклюзией сосудов.
В любом случае итогом повреждения эндотелиоцитов является приобретение интимой сосудов прокоагулянтных свойств, что сопровождается синтезом и экспрессией тканевого фактора (тромбопластина) — основного инициатора процесса свертывания крови. Тромбо-пластин, который хотя и не обладает энзиматической активностью, может выступать в роли кофактора активированного фактора VII. Комплекс тромбопластин—фактор VII способен активировать как фактор X, так и фактор XI, вызывая тем самым генерацию тромбина, что в свою очередь индуцирует дальнейшее прогрессирование реакций как клеточного, так и плазменного гемостаза.
Гемостатические реакции, совокупность которых принято называть плазменным (коагу-ляционным) гемостазом и итогом которых является образование фибрина, обеспечиваются в основном протеинами, носящими название плазменных факторов. В табл. 5.1 приведен перечень факторов, участвующих в свертывании крови.
Процесс протекания плазменного гемостаза можно условно разделить на три фазы.
Первая фаза — протромбиназообразование, или контактно-калликреин-кинин-каскад-ная активация. Первая фаза представляет собой многоступенчатый процесс, в результате которого в крови накапливается комплекс факторов, способных превратить протромбин в тромбин, поэтому комплекс называется протромбиназой. В зависимости от пути формирова-
245
Таблица 5.1. Международная номенклатура факторов свертывания крови
|
|
|
Период |
|
Факторы |
Синонимы |
полураспада, |
|
|
|
часы |
|
I |
Фибриноген* |
72-120 |
|
II |
Протромбин* |
48-96 |
|
III |
Тканевый тромбопластин, тканевый фактор |
— |
|
IV |
Ионы кальция |
— |
|
V |
Проакцелерин*, Ас-глобулин |
15-18 |
|
VI |
Акцелерин (исключен из употребления) |
|
|
VII |
Проконвертин* |
4-6 |
|
VIII |
Антигемофильный глобулин А |
7-8 |
|
IX |
Кристмас-фактор, плазменный тромбопластиновый |
15-30 |
|
|
компонент, антигемофильный фактор В* |
|
|
X |
Фактор Стюарта—Прауэра* |
30-70 |
|
XI |
Антигемофильный фактор С |
30-70 |
|
XI |
Фактор Хагемана, фактор контакта* |
50-70 |
|
XIII |
Фибриназа, фибринстабилизирующий фактор |
72 |
|
|
Дополнительные факторы |
|
|
|
Фактор Виллебранда |
18-30 |
|
|
Фактор Флетчера, плазменный прекалликреин |
— |
|
|
Фактор Фитцжеральда, высокомолекулярный кининоген |
— |
*Синтезируется в печени.
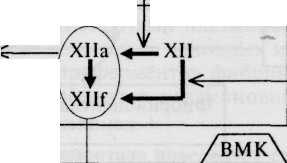
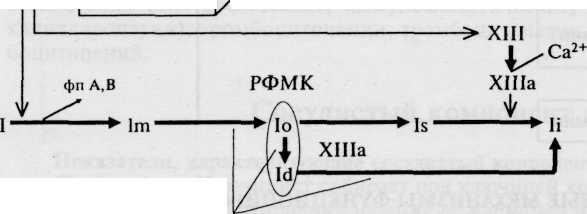
ния протромбиназы различают внутренний и внешний пути ее формирования. По внутреннему пути свертывание крови инициируется без участия тканевого тромбопластина; в образовании протромбиназы принимают участие факторы плазмы (XII, XI, IX, VIII, X), калли-креин-кининовая система и тромбоциты. В результате инициации реакций внутреннего пути образуется комплекс факторов Ха с V на фосфолипидной поверхности (3-й фактор тромбоцитов) в присутствии ионизированного кальция. Весь этот комплекс действует как протром-биназа, превращая протромбин в тромбин. Пусковым фактором этого механизма является фактор XII, который активируется либо вследствие контакта крови с чужеродной поверхностью, либо при контакте крови с субэндотелием (коллагеном) и другими компонентами соединительной ткани при повреждении стенок сосудов, либо фактор XII активируется путем его ферментативного расщепления (калликреином, плазмином, другими протеазами). Во внешнем пути формирования протромбиназы основную роль играет тканевый фактор (фактор III), который экспрессируется на клеточных поверхностях при повреждении тканей и образует с фактором Vila и ионами кальция комплекс, способный перевести фактор X в фактор Ха, который и активирует протромбин. Кроме того, фактор Ха ретроградно активирует комплекс тканевого фактора + фактора Vila. Таким образом, внутренний и внешний пути соединяются на факторах свертывания. Однако так называемые «мосты» между этими путями реализуются через взаимную активацию факторов XII, VII и IX. Эта фаза длится от 4 мин 50 с до 6 мин 50 с (схема 5.2).
Вторая фаза — тромбинообразование. В эту фазу протромбиназа вместе с факторами коагуляции V, VII, X и IV переводит неактивный фактор II (протромбин) в активный фактор Па — тромбин. Эта фаза длится 2—5 с.
Третья фаза свертывания крови — фибринообразование (схема 5.3). Возникший тромбин отщепляет от молекулы фибриногена два пептида А и два В, переводит его в фибрин-мономер. Молекулы последнего полимеризуются сначала в димеры, затем в еще растворимые, особенно в кислой среде, олигомеры, и фибрин-папилляры становятся фибрин-полимером. Кроме того, тромбин способствует превращению фактора XIII в фактор XII 1а. Последний в присутствии Са2+ изменяет фибрин-полимер из лабильной, легко растворимой фибриноли-зином (плазмином) формы в медленно и ограниченно растворимую форму, составляющую основу кровяного сгустка. Эта фаза длится 2—5 с.
246
Схема 5.2. ПЛАЗМЕННЫЙ ГЕМОСТАЗ [БАРКАГАН З.С., 1998]



Прекалликреин
l<
Калликреин ▼
 ВНЕШНИЙ
ПУТЬ
ВНЕШНИЙ
ПУТЬ
Тканевый фактор
Плазменные липопротеиды
ВНУТРЕННИЙ ПУТЬ
Контакт, субэндотелий
Плазминоген
Плазмин
^*\
Фибринолиз

Тканевый фактор
\
V
V
■Х1а
 Ca2t
Ca2t
VII-
XI + ХПа, f + Калликреин
v

Па+Ц-П
+ Va
+ Xa
Са2
 Ингибиторы
самосборки и агрегации протофибрилл
Ингибиторы
самосборки и агрегации протофибрилл
Примечание: ВМК — высокомолекулярный кининоген; РФМК — растворимые фибрин-мономерные комплексы; фп А,В — фибринопептиды А и В; Сз, Csb, C9 — факторы системы комплемента.
В процессе образования гемостатического тромба не происходит распространения тром-бообразования от места повреждения стенки сосуда по сосудистому руслу, так как этому препятствуют быстро возрастающий вслед за свертыванием антикоагулянтный потенциал крови и активация фибринолитической системы.
Сохранение крови в жидком состоянии и регуляция скоростей взаимодействия факторов во все фазы коагуляции во многом определяются наличием в кровотоке естественных веществ, обладающих антикоагулянтной активностью. Жидкое состояние крови достигается равновесием между факторами, индуцирующими свертывание крови, и факторами, препятствующими его развитию, причем последние не выделяются в отдельную функциональную систему, так как реализация их эффектов чаще всего невозможна без участия прокоагуляци-онных факторов. Поэтому выделение антикоагулянтов, которые препятствуют активации факторов свертывания крови и нейтрализуют их активные формы, является чисто условным. Вещества, обладающие антикоагулянтной активностью, постоянно синтезируются в организме и с определенной скоростью выделяются в кровоток. К ним относятся: антитромбин III, гепарин, протеины С и S, недавно открытый ингибитор тканевого пути свертывания — TFPI (ингибитор комплекса тканевый фактор—фактор Vila—Са2+), а2-макроглобулин, антитрипсин и др. В процессе свертывания крови, фибринолиза из факторов свертывания и других белков также образуются вещества, обладающие антикоагулянтной активностью. Антикоагулянты оказывают выраженное действие на все фазы свертывания крови, поэтому исследование их активности при нарушениях свертывания крови очень важно.
После стабилизации фибрина, образующего вместе с форменными элементами первичный красный тромб, начинаются два основных процесса посткоагуляционной фазы — спон-
247
Схема 5.3. ТРЕТЬЯ ФАЗА СВЕРТЫВАНИЯ КРОВИ - ФИБРИНООБРАЗОВАНИЕ
П рофибриназаXIII
рофибриназаXIII
Тромбин (Па)
Фибриноген (I)
V
Фибрин-мономер


 Фибринопептиды
А и В +
комплексы
Фибринопептиды
А и В +
комплексы
Фибрин-полимер растворимый

 Проактиваторы
плазминогена
Проактиваторы
плазминогена
+Са2
Фибриназа ХШа


 Плазминоген
Плазминоген
V


 Активаторы
Активаторы
плазминогена
(плазменный
или тканевый)
V
Фибрин-полимер нерастворимый
П ервичный
красный тромб (сгусток)
ервичный
красный тромб (сгусток)





 а
1-Антитрипсин аг-Макроглобул
Антитромбин
III
а
1-Антитрипсин аг-Макроглобул
Антитромбин
III
Плазмин (фибринолизин)

 у
у
а г-Антиплазмин
г-Антиплазмин
С хема
5.4.
ОСНОВНЫЕ МЕХАНИЗМЫ ФУНКЦИОНИРОВАНИЯ
ФИБРИНОЛИТИЧЕСКОИ
(ПЛАЗМИНОВОЙ) СИСТЕМЫ
хема
5.4.
ОСНОВНЫЕ МЕХАНИЗМЫ ФУНКЦИОНИРОВАНИЯ
ФИБРИНОЛИТИЧЕСКОИ
(ПЛАЗМИНОВОЙ) СИСТЕМЫ




ВНУТРЕННИЙ МЕХАНИЗМ
Фактор
XII
зависимый
Прекалликреин
+
ВМ кининоген
 НЕШНИЙ
МЕХАНИЗМАктиваторы
НЕШНИЙ
МЕХАНИЗМАктиваторы
Фактор XII независимый
\ Проактиватор
\ \
1
К

 алликреин+
ВМ кининоген
алликреин+
ВМ кининоген
 Активатор
Активатор
ПЛАЗМИНОГЕН





 Ингибитор
трансформации
Ингибитор
трансформации
Антиплазмины I ряда (а2-антиплазмин и др.)
 248
248
-ПЛАЗМИН
Ингибиторы II ряда
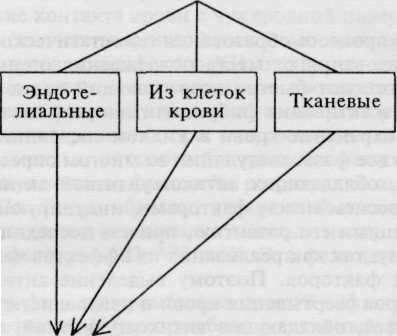
тайный фибринолиз и ретракция, приводящие в итоге к формированию гемостатически полноценного окончательного тромба. В норме эти два процесса идут параллельно. Физиологический спонтанный фибринолиз и ретракция способствуют уплотнению тромба и выполнению им гемостатических функций. В этом процессе активное участие принимают плазмино-вая (фибринолитическая) система и фибриназа (фактор XIПа). Спонтанный (естественный) фибринолиз отражает сложную реакцию между компонентами плазминовой системы организма и фибрином. Плазминовая система состоит из четырех основных компонентов: плаз-миногена, плазмина (фибринолизин), активаторов проферментов фибринолиза и его ингибиторов (схема 5.4). Нарушение соотношений компонентов плазминовой системы ведет к патологической активации фибринолиза.
В клинической практике исследование системы гемостаза преследует следующие цели:
диагностика нарушений в системе гемостаза;
выяснение допустимости оперативного вмешательства при выявленных нарушениях в системе гемостаза;
проведение контроля за лечением антикоагулянтами прямого и непрямого действия, а также тромболитической терапией.
СОСУДИСТО-ТРОМБОЦИТАРНЫЙ (ПЕРВИЧНЫЙ) ГЕМОСТАЗ
Сосудисто-тромбоцитарный, или первичный, гемостаз нарушают: изменения сосудистой стенки (дистрофические, иммуноаллергические, неопластические и травматические капилляропатии); тромбоцитопении; тромбоцитопатии, сочетание капилляропатий и тром-боцитопений.
Сосудистый компонент гемостаза
Показатели, характеризующие сосудистый компонент гемостаза.
Проба щипка. Клиницист собирает под ключицей кожу в складку и делает щипок. У здоровых людей никаких изменений на коже не наступает ни сразу после щипка, ни спустя 24 ч. Но если резистентность капилляров нарушена, на месте щипка появляются петехии или кровоподтек, особенно отчетливо видимые через 24 ч.
Проба жгута. Отступив на 1,5—2 см вниз от ямки локтевой вены, очерчивают круг диаметром приблизительно 2,5 см. На плечо накладывают манжетку тонометра и создают давление 80 мм рт.ст. Давление поддерживают строго на одном уровне в течение 5 мин. В очерченном круге подсчитывают все появившиеся петехии.
Трактовка результатов исследования. У здоровых лиц петехии не образуются или их не более 10 (отрицательная проба жгута).
При нарушении резистентности стенки капилляров количество петехии после проведения пробы резко возрастает.
Тромбоцитарный компонент гемостаза
Показатели, характеризующие тромбоцитарный компонент гемостаза
Определение длительности кровотечения по Дуке.
Подсчет количества тромбоцитов в крови. • 3. Тромбоцитарная формула.
Определение агрегации тромбоцитов с АДФ.
Определение агрегации тромбоцитов с коллагеном.
Определение агрегации тромбоцитов с адреналином.
Определение агрегации тромбоцитов с ристоцетином (определение активности фак тора Виллебранда).
Клиническое значение исследования первых трех перечисленных показателей представлено в главе 1 «Гематологические исследования». Здесь мы более подробно рассмотрим клиническую оценку и значение исследования агрегационных функций тромбоцитов.
249
Агрегация тромбоцитов с АДФ в плазме
Процессы агрегации изучают с помощью агрегометра, отражающего ход агрегации графически в виде кривой; в качестве стимулятора агрегации служит АДФ [Меньшиков В.В., 1987].
До добавления проагреганта (АДФ) возможны случайные осцилляции кривой оптической плотности. После добавления агреганта на кривой появляются осцилляции за счет изменения формы тромбоцитов. Осцилляции уменьшаются по амплитуде, уменьшается и оптическая плотность. Тромбоциты соединяются в агрегаты, и кривая идет вверх (первичная волна). Когда подъем переходит в «плато», происходит реакция высвобождения, и кривая еще больше поднимается вверх (вторичная волна).
При воздействии малых доз АДФ на агрегатограмме регистрируется двойная волна агрегации. Первая фаза (первичная волна) зависит от добавленного экзогенного АДФ, вторая фаза (вторичная волна агрегации) — за счет реакции высвобождения собственных агонис-тов, содержащихся в гранулах тромбоцитов. Вводимые извне большие дозы АДФ, обычно ЫСГ5М (1мкМ — Ы(Г6М), приводят к слиянию первой и второй волн агрегации. Для достижения двухволновой агрегации обычно используется АДФ в концентрации 110~7М.
При анализе агрегатограмм обращают внимание на общий характер агрегации (одновол-новая, двухволновая; полная, неполная; обратимая, необратимая), разницу между оптической плотностью плазмы до начала агрегации и после достижения максимальной агрегации (характеризует интенсивность агрегации), а также уменьшение оптической плотности плазмы за первую минуту агрегации или угол наклона кривой на этапе бурной афегации (характеризует скорость агрегации). Важно отметить, что появление двухволновой агрегации при стимуляции АДФ и адреналином в концентрациях, вызывающих в норме обратимую афега-цию (обычно 1—5 мкМ), указывает на повышение чувствительности тромбоцитов к этим индукторам, а развитие одноволновой неполной (а часто и обратимой) агрегации при стимуляции ими в концентрациях 10 мкМ и больше — на нарушение реакции высвобождения тромбоцитов. В клинических исследованиях общепринятым считается использование АДФ в концентрациях 110~5М (для достижения одноволновой агрегации) и Ы(Г7М (для достижения двухволновой афегации).
Результаты исследования агрегационной способности тромбоцитов могут выражаться в процентах (табл. 5.2).
Определение агрегации тромбоцитов с различными индукторами агрегации играет важнейшую роль в дифференциальной диагностике тромбоцитопатий (табл. 5.3).
Таблица 5.2. Агрегация по Вайсу для АДФ в норме
|
Концентрация АДФ, мкМ |
Агрегация в норме, % |
|
10 5 2 1 |
77,7 66,1 47,5 30,7 |
Таблица 5.3. Нарушения агрегации тромбоцитов при различных заболеваниях
|
Вид тромбоцитопати и |
Стимулятор агрегации и нарушения агрегации | ||||
|
АДФ |
коллаген |
адреналин |
ристоцетин | ||
|
первичная волна |
вторичная волна | ||||
|
Тромбастения Эссенциальная атромбия Аспириноподобный дефект Синдром Бернара—Сулье Синдром Вискотта—Олдрича Болезнь Виллебранда |
Патология Норма Патология Норма |
Патология Норма Патология Норма |
Патология Патология Норма |
Патология Патология Норма |
Норма Сниженная (патология) |
Примечание: (+,—) — диагностического значения не имеет 250
 В
зависимости от функционально-морфологических
характеристик тромбоцитов тром-боцитопатии
делят на следующие группы.
В
зависимости от функционально-морфологических
характеристик тромбоцитов тром-боцитопатии
делят на следующие группы.
♦ Наследственные дизагрегационные тромбоцитопатии без нарушения реакции высво бождения (вторичная волна). В эту группу входят:
а) тромбастения Гланцманна, для которой характерно падение АДФ-зависимой агре гации, при нормальной ристоцетинагрегации;
б) эссенциальная атромбия — при воздействии малых количеств АДФ агрегация не индуцируется, а при удвоении количества АДФ приближается к нормальной;
в) аномалия Мея—Хеглина — нарушается коллагензависимая агрегация; реакция ос вобождения при стимуляции АДФ и ристоцетином сохранена.
Парциальные дизагрегационные тромбоцитопатии. В эту группу входят заболевания с врожденным дефектом агрегации с тем или иным агрегантом или упадком реакции высвобождения.
Нарушение реакции высвобождения. Для этой группы заболеваний характерно отсут ствие второй волны агрегации при стимуляции малым количеством АДФ и адренали на. В тяжелых случаях отсутствуют АДФ и адреналинагрегация. Коллагенагрегация не выявляется.
Болезни и синдромы с недостаточным пулом накопления и хранения медиаторов аг регации. К этой группе относятся заболевания, характеризующиеся неспособностью тромбоцитов накапливать и выделять серотонин, адреналин, АДФ и другие факторы кровяных пластинок. Лабораторно для этой группы характерны снижение всех видов агрегации и отсутствие второй волны агрегации.
При приобретенных тромбоцитопатиях отмечают снижение агрегации в ответ на введение АДФ при пернициозной анемии, остром и хроническом лейкозе, миеломной болезни. У больных уремией при стимуляции коллагеном, адреналином АДФ-агрегация снижена. Для гипотиреоза характерно снижение агрегации при стимуляции АДФ. Ацетилсалициловая кислота, пенициллин, индометацин, делагил, диуретики (в частности фуросемид при применении в высоких дозах) способствуют снижению агрегации тромбоцитов, что нужно учитывать при лечении этими препаратами.
При хирургических операциях, осложненных кровотечениями, нарушения в системе со-судисто-тромбоцитарного гемостаза в большинстве случаев обусловлены не нарушением аг-регационных и других функциональных свойств тромбоцитов, а наличием тромбоцитопении той или иной степени.
Агрегация тромбоцитов с коллагеном в плазме
Коллагениндуцированная агрегация тромбоцитов имеет достаточно выраженную латентную фазу, во время которой происходит активация фосфолипазы С. В зависимости от используемого реагента продолжительность этой фазы может составить 5—7 мин. После завершения лаг-периода в тромбоцитах происходят процессы, приводящие к образованию вторичных посредников, вследствие чего развивается секреция тромбоцитарных гранул и синтез тромбокса-на А2, что сопровождается резким развитием межтромбоцитарного взаимодействия.
В лабораторно-клинической практике коллаген (например, фирмы «Stago», Франция) чаще всего используют в конечной концентрации 50 мкг/мл. Однако коллагены других фирм могут обладать иной активностью, что необходимо учитывать при их применении. Результаты исследования агрегационной способности тромбоцитов могут выражаться в процентах (табл. 5.4).
Диагностическое значение и оценку результатов исследования см. в разделе «Агрегация тромбоцитов с АДФ в плазме». Отдельно исследование не назначается, а проводится в комплексе с определением агрегации тромбоцитов с АДФ и адреналином.
Таблица5.4. Агрегация тромбоцитов по Вайсу для коллагена в норме
|
Концентрация коллагена, мкг/мл |
Агрегация в норме, % |
|
10 5 2 I |
93,1 75,0 69,4 46,4 |
251
Агрегация тромбоцитов с адреналином в плазме
Кривая, регистрируемая при записи адреналининдуцированной агрегации, имеет две волны. Адреналин при контакте с тромбоцитами взаимодействует с а2а-адренорецепторами, что вызывает ингибирование аденилатциклазы. Не исключено, что механизм, лежащий в основе реализации эффекта адреналина и развития первой волны агрегации, не зависит от образования ТХА2, реакции высвобождения или синтеза фактора агрегации тромбоцитов, а связан со способностью этого проагреганта прямо изменять проницаемость клеточной мембраны для Са2+. Вторичная агрегация при индукции процесса адреналином является итогом развития реакции высвобождения и продукции тромбоксана А2.
Результаты исследования агрегационной способности тромбоцитов могут выражаться в процентах (табл. 5.5).
Таблица 5.5. Агрегация тромбоцитов по Вайсу для адреналина в норме
|
Концентрация адреналина, мкМ |
Агрегация в норме, % |
|
300 150 60 30 |
92,5 46,0 42,5 35,0 |
Диагностическое значение и оценку результатов исследования см. в разделе «Агрегация тромбоцитов с АДФ в плазме».
Отдельно исследование не назначается, а проводится в комплексе с определением агрегации тромбоцитов с АДФ и коллагеном.
Агрегация тромбоцитов с арахидоновой кислотой в плазме
Арахидоновая кислота является природным агонистом, причем ее действие опосредовано эффектами простагландинов G2 и Н2 и тромбоксана А2 и включает активацию как фосфо-липазы С с последующим образованием вторичных посредников, мобилизацией внутриклеточного кальция и расширением процесса активации клеток, так и фосфолипазы А2, что непосредственно приводит к либерации эндогенной арахидоновой кислоты.
Активация тромбоцитов под действием арахидоновой кислоты происходит достаточно быстро, поэтому кривая, характеризующая этот процесс, чаще носит одноволновый характер.
Для индукции агрегации тромбоцитов арахидоновая кислота используется в концентрациях Ы0~3—МО"4 М. При работе с арахидоновой кислотой следует учитывать, что на воздухе это вещество очень быстро окисляется.
Рекомендуется выполнение агрегации с арахидоновой кислотой в случаях использования лекарств, влияющих на реакцию агрегации (например, ацетилсалициловая кислота, пенициллин, индометацин, делагил, диуретики), что нужно учитывать при оценке результатов исследований.
Агрегация тромбоцитов с ристоцетином в плазме
Активность фактора Виллебранда в норме — 58—166 %.
Фактор VIII свертывания плазмы — антигемофильный глобулин А — циркулирует в крови в виде комплекса из трех субъединиц, обозначаемых VIlI-к (коагулирующая единица), VIII-АГ (основной антигенный маркер) и VIII-фВ (фактор Виллебранда, связанный с VIII-АГ). Считают, что VIII-фВ регулирует синтез коагуляционной части антигемофильного глобулина (VIII-к) и участвует в сосудисто-тромбоцитарном гемостазе.
При болезни Виллебранда снижается активность как VIII-фВ, участвующего в сосудисто-тромбоцитарном гемостазе и являющегося основным маркером комплекса фактора VIII (фактор Виллебранда), так и VIII-к. При этом заболевании нарушается ристоцетинагрегация тромбоцитов.
252
Определение агрегации тромбоцитов с ристоцетином в плазме применяется для количественной оценки фактора Виллебранда. Установлена линейная зависимость между степенью ристоцетиновой агрегации и количеством фактора Виллебранда [Баркаган З.С., 1988]. При болезни Виллебранда отмечается нарушение ристоцетинагрегации при нормальном ответе на воздействие АДФ, коллагена и адреналина. Нарушение ристоцетинагрегации выявляется и при макроцитарной тромбодистрофии Бернара—Сулье (отсутствие на мембране тромбоцитов рецепторов ристоцетиновой агрегации). Дифференциальным тестом является тест с добавлением нормальной плазмы: при болезни Виллебранда после добавления нормальной плазмы ристоцетинагрегация нормализуется, в то время как при синдроме Бернара—Сулье нормализации не происходит.
Исследование может использоваться в дифференциальной диагностике между врожденной гемофилией А (недостаток фактора VIII) и болезнью Виллебранда. При гемофилии резко снижено содержание VIII-к, а содержание VIII-фВ находится в пределах нормы. Эта разница приводит к различию клинических форм геморрагического диатеза: гематомная форма возникает при гемофилии, а петехиально-гематомная — при болезни Виллебранда [Ogston D., Bennett В., 1977].
ПЛАЗМЕННЫЙ (КОАГУЛЯЦИОННЫЙ) ГЕМОСТАЗ
