
- •Глава 1. Гематологические исследования
- •Глава 2. Цитохимические исследования
- •Глава 3. Общеклинические исследования
- •Глава 4. Биохимические исследования
- •Глава 5. Система гемостаза
- •Глава 6. Лекарственный мониторинг
- •Глава 7. Иммунологические исследования
- •Глава 8. Серологические исследования
- •Глава 9. Гормональные исследования
- •Глава 10. Реологические свойства крови и их значение в клинической практике
- •Кровь Общеклиническое исследование крови
- •В норме [Тиц II., 1997]
- •1. Тромбоцитопении, связанные со снижением образования тромбоцитов (недостаточность кроветворения).
- •Лейкоцитарная формула крови
- •Базофилы
- •Лимфоциты
- •Содержания лимфоцитов
- •Изменения размера
- •Изменения формы
- •Включения в эритроцитах
- •Ядросодержащие клетки эритроцитарного ряда
- •Скорость оседания эритроцитов (соэ)
- •Ретикулоциты
- •Время свертывания крови (по Сухареву)
- •Длительность кровотечения (по Дуке)
- •Плазмодии малярии в крови
- •Осмотическая резистентность эритроцитов
- •Серповидные эритроциты в крови
- •Эритроцитометрия
- •Пунктат костного мозга Миелограмма
- •Иммунный агранулоцитоз
- •Лейкемоидные реакции
- •Лейкемоидные реакции лимфатического и моноцитарного типа
- •Острые лейкозы
- •Эритремия
- •Хронический лимфолейкоз
- •Цитохимическая характеристика клеток крови и костного мозга в норме
- •Активность миелопероксидазы
- •Активность щелочной фосфатазы
- •При различных заболеваниях
- •Активность кислой фосфатазы
- •Активность альфа-нафтилацетатэстеразы
- •Активность альфа-нафтилацетатэстеразы с фторидом натрия
- •Активность нафтол-а8-ацетатэстеразы
- •Активность нафтол -as - d -хлорацетатэстеразы
- •Активность глюкозо-6-фосфатдегидрогеназы
- •Гликоген в клетках
- •Липиды в клетках
- •Сидероциты и сидеробласты
- •МочаОбщеклиническое исследование мочи
- •Химическое исследование
- •Причины увеличения выделения уробилиногена с мочой
- •Белок в суточном количестве мочи
- •Глюкозурический профиль
- •Проба по Адцису—Каковскому
- •Проба по Нечипоренко
- •Проба по Зимницкому
- •Стаканные пробы
- •Общеклиническое исследование жидкости из плевральной полости и перикарда
- •Бактериоскопическое исследование жидкости из плевральной полости и перикарда
- •Общеклиническое исследование жидкости из брюшной полости
- •[Каль л., 1995]
- •Пунктаты кистовидных образований
- •Мокрота Общеклиническое исследование мокроты
- •Волокна
- •Спирали и кристаллы
- •Бактериоскопическое исследование мокроты
- •Исследование мокроты методом флотации
- •[Черняев л.А., 1996]
- •Слизь из носа
- •Спинномозговая жидкость Общеклиническое исследование спинномозговой жидкости
- •Спинномозговая жидкость при менингитах
- •Спинномозговая жидкость при закрытой черепно-мозговой травме
- •Спинномозговая жидкость при геморрагическом инсульте
- •Бактериоскопическое исследование спинномозговой жидкости
- •Желудочное содержимое Общеклиническое исследование желудочного содержимого
- •Дуоденальное содержимое Общеклиническое исследование дуоденального содержимого
- •Микроскопическое исследование желчи
- •Общеклиническое исследование кала
- •Копрограмма в норме
- •Копрограмма при патологии
- •Скрытая кровь в кале
- •Яйца глистов в кале
- •Простейшие в кале
- •Соскоб с перианальных складок на энтеробиоз
- •Общеклиническое исследование отделяемого из влагалища
- •Тумилович л.Г., 1995]
- •Общеклиническое исследование отделяемого из цервикального канала
- •Общеклиническое исследование секрета предстательной железы
- •Микроскопическое исследование
- •Кожа и ногтевые пластинки Общеклиническое исследование содержимого пузырей при дерматозах
- •Исследование ресничек и содержимого розовых угрей на демодекоз
- •Белки и белковые фракцииОбщий белок в сыворотке
- •Альбумин в сыворотке
- •Белковые фракции сыворотки
- •Альбумин в моче
- •Специфические белки
- •Кислый альфа- 1-гликопротеин в сыворотке
- •Альфа-1-антитрипсин в сыворотке
- •Белок сывороточного амилоида а
- •Гаптоглобин в сыворотке
- •Альфа-2-макроглобулин в сыворотке
- •Витамин-а-связывающий белок в сыворотке
- •И хирургических вмешательств
- •Цистатин с в сыворотке
- •Витамин в12 в сыворотке
- •Показатели азотистого обмена Мочевина (азот мочевины) в сыворотке
- •Мочевина (азот мочевины) в моче
- •Креатинин в сыворотке
- •Креатинин в моче
- •Клиренс эндогенного креатинина (проба Реберга—Тареева)
- •Мочевая кислота в сыворотке
- •Мочевая кислота в моче
- •Аммиак в сыворотке
- •Гомоцистеин в сыворотке
- •Молекулы средней массы в крови
- •Молекулы средней массы в моче
- •Глюкоза в крови
- •Глюкоза в спинномозговой жидкости
- •Гликемический профиль
- •Глюкозотолерантный тест
- •Гликозилированный гемоглобин в крови
- •Фруктозамин в сыворотке
- •Молочная кислота (лактат) в крови
- •Пировиноградная кислота (пируват) в сыворотке
- •Липиды, липопротеины и аполипопротеины
- •Общие липиды в сыворотке
- •Общий холестерин (хс) в сыворотке
- •Альфа-холестерин (лпвп-хс) в сыворотке
- •Лпвп-хс [Климов а.Н., 1984]
- •Лпвп-хс
- •Бета-холестерин (лпнп-хс) в сыворотке
- •Электрофоретический анализ липопротеинов
- •Типирование дислипопротеинемий
- •Липонротеин(а) в сыворотке
- •Общие фосфолипиды в сыворотке
- •Неэстерифицированные (свободные) жирные кислоты (нэжк) в сыворотке
- •Показатели пигментного обмена Образование желчных пигментов
- •Общий билирубин в сыворотке
- •Прямой билирубин в сыворотке
- •Непрямой билирубин в сыворотке
- •Желчные кислоты в сыворотке
- •Ферменты и изоферменты
- •Аспартатаминотрансфераза (act) в сыворотке
- •Аланинаминотрансфераза (алт) в сыворотке
- •Общая лактатдегидрогеназа (лдг) в сыворотке
- •Щелочная фосфатаза в сыворотке
- •Лейцинаминопептидаза (лап) в сыворотке
- •Сорбитолдегидрогеназа (сдг) в сыворотке
- •Глутаматдегидрогеназа (ГлДг) в сыворотке
- •Холинэстераза (хэ) в сыворотке
- •Альфа-амилаза в сыворотке и моче
- •Альфа-амилаза в содержимом брюшной полости
- •Панкреатическая альфа-амилаза в сыворотке и моче
- •Липаза в сыворотке
- •Трипсин в сыворотке
- •Панкреатическая эластаза-1 в сыворотке
- •Панкреатическая эластаза-1 в кале
- •Кислая фосфатаза в сыворотке
- •Глютатионпероксидаза (гп) в крови
- •Маркеры повреждения миокарда
- •Общая креатинкиназа (кк) в сыворотке
- •Миоглобин в сыворотке
- •Тропонин т в сыворотке
- •Тропонин I в сыворотке
- •Изофермент лдг-1 в сыворотке
- •Маркеры повреждения мозговой ткани Белок s-100 в сыворотке
- •Водно-электролитный обмен Калий в сыворотке
- •Натрий в сыворотке
- •Калий в эритроцитах
- •Натрий в эритроцитах
- •Калий в спинномозговой жидкости
- •Натрий в спинномозговой жидкости
- •Калий в моче
- •Натрий в моче
- •Повышено
- •Общий кальций в моче
- •Неорганический фосфор в сыворотке
- •Неорганический фосфор в моче
- •Магний в сыворотке
- •Хлор в сыворотке
- •Гипохлоремия
- •Хлор в спинномозговой жидкости
- •Хлор в моче
- •Типовые нарушения осмотического гомеостаза
- •I. Нарушения, связанные с увеличением содержания основных осмотически активных веществ в плазме:
- •III. Нарушения, связанные с водным дисбалансом:
- •IV. Смешанные нарушения
- •Нарушения, связанные с водным дисбалансом
- •Смешанные нарушения осмобаланса
- •Клиническое применение осмометрии
- •Показатели кос
- •Формы нарушений кос
- •Диагностика дыхательной недостаточности
- •Показатели метаболизма железа Железо в сыворотке
- •[Авцын а.П., 1990]
- •Общая железосвязывающая способность сыворотки
- •Ферритин в сыворотке
- •Микроэлементы Медь в сыворотке
- •[Авцын а.П., 1990]
- •Цинк в сыворотке
- •[Авцын а.П., 1990]
- •Кобальт в сыворотке
- •[АвцынА.П., 1990]
- •Марганец в крови
- •Хром в крови
- •Молибден в сыворотке
- •Ванадий в крови
- •Селен в крови
- •Кремний в сыворотке
- •Никель в сыворотке
- •Оценка первой фазы плазменного гемостаза — образования протромбиназы
- •Оценка второй фазы плазменного гемостаза — образования тромбина
- •Тромбиновое время
- •Антитромбин III (at III)
- •Тромбогеморрагических осложнений
- •Г л а в а 6 лекарственный мониторинг
- •Гентамицин в сыворотке
- •Амикацин в сыворотке
- •Ванкомицин в сыворотке
- •Дигоксин в сыворотке
- •Дигитоксин в сыворотке
- •Фенобарбитал в сыворотке
- •Теофиллин в сыворотке
- •Хинидин в сыворотке
- •Новокаинамид в сыворотке
- •Лидокаин в сыворотке
- •Литий в сыворотке
- •Гуморальный иммунитет
- •IgA в сыворотке
- •IgM в сыворотке
- •IgG в сыворотке
- •Заболеваниях
- •Ревматических заболеваниях
- •Иммуноэлектрофорез белков сыворотки крови
- •Иммуноэлектрофорез белков мочи
- •Криоглобулины в сыворотке
- •Клеточный иммунитет
- •Натуральные киллеры (cd 16) в крови
- •Трансформация лимфоцитов
- •Агломерация лейкоцитов крови
- •Организма
- •Фагоцитоз
- •Активность нейтрофилов
- •Лизоцим в крови
- •Система комплемента
- •Цитокины
- •При иммунодефицитах
- •Фенотипирование гемобластозов
- •Титр антител к нуклеарным антигенам (антинуклиарный фактор) в сыворотке
- •Ревматоидный фактор (рф) в сыворотке
- •Антистрептолизин-0 (асло) в сыворотке
- •Синдрома
- •Антикардиолипиновые антитела в сыворотке
- •Волчаночный антикоагулянт в плазме
- •Диагностика аутоиммунных заболеваний
- •[Лукьянчиков b.C. И др., 1995]
- •Диагностика аутоиммунных заболеваний щитовидной железы
- •Диагностика аутоиммунных повреждений поджелудочной железы
- •Диагностика аутоиммунных повреждений надпочечников
- •Исследование онкомаркеров
- •Альфа-фетопротеин (афп) в сыворотке
- •Карбогидратный антиген са-19-9 в сыворотке
- •Карбогидратный антиген са-72-4 в сыворотке
- •Раковый антиген са-15-3 в сыворотке
- •Бета-2-микроглобулин в сыворотке и моче
- •Диагностика сифилиса
- •С результатами риф
- •Антигенами
- •Серологическая диагностика вирусных инфекций
- •Спид-индикаторные болезни
- •Антитела к вич в сыворотке
- •В сыворотке
- •Вирусные гепатиты
- •Вирусный гепатит а
- •Вирусный гепатит в
- •Вирусный гепатит с
- •Вирусный гепатит d
- •Вирусный гепатит е
- •Цитомегаловирусная инфекция
- •Герпетическая инфекция
- •Вирусный паротит
- •Ветряная оспа
- •Краснуха
- •Аденовирусная инфекция
- •Респираторно-синцитиальная инфекция
- •Инфекционный мононуклеоз
- •Серологическая диагностика бактериальных инфекций
- •Инфекции, вызываемые стафилококками
- •Инфекции, вызываемые пневмококками
- •Инфекции, вызываемые гемофильной палочкой
- •Менингококковая инфекция
- •Бруцеллез
- •Сальмонеллезная инфекция
- •Туберкулез
- •Дифтерия
- •Антитела к дифтерийному токсину в сыворотке
- •Легионеллез
- •Иерсиниоз
- •Псевдотуберкулез
- •Хеликобактериоз
- •Хламидийная инфекция
- •Микоплазменная инфекция
- •Гонорея
- •Амебиаз
- •Токсоплазмоз
- •Криптоспоридиоз
- •Серологическая диагностика паразитарных инфекций Эхинококкоз
- •Токсокароз
- •Пневмоцистоз
- •Серологическая диагностика грибковых инфекций Аспергиллез
- •Кандидоз
- •Обнаружение вируса гепатита с
- •Обнаружение вируса гепатита в
- •Обнаружение цитомегаловируса
- •Обнаружение вируса папилломы человека
- •Обнаружение микобактерий туберкулеза
- •Обнаружение Helicobacter pylori
- •Обнаружение гонококков
- •Обнаружение микоплазм
- •Обнаружение Chlamidia trachomatis
- •Г л а в а 9 гормональные исследования
- •Гормоны гипоталамуса
- •Гормоны гипофиза
- •Регуляция секреции гормонов гипоталамуса и гипофиза
- •Лабораторная диагностика
- •Соматотропный гормон (стг) в сыворотке
- •Соматомедин с (см) в сыворотке
- •Функциональное состояние
- •Системы
- •Кортизол в сыворотке
- •Свободный кортизол в моче
- •И установление его этиологии
- •Кортикостероидсвязывающий глобулин (ксг) в сыворотке
- •Функциональное состояние щитовидной железы
- •Биосинтез и метаболизм гормонов щитовидной железы
- •Метаболический эффект гормонов щитовидной железы
- •Тиреотропный гормон (ттг) в сыворотке
- •Общий трийодтиронин (тз) в сыворотке
- •Концентрация тз
- •Общий тироксин (т4) в сыворотке
- •Свободный трийодтиронин (сТз) в сыворотке
- •Свободный тироксин (сТ4) в сыворотке
- •Тиреоглобулин (тг) в сыворотке
- •Кальцитонин (кт) в сыворотке
- •Эутиреоидный (нетоксический) зоб
- •Гипотиреоз
- •Гипертиреоз (тиреотоксикоз)
- •Тиреоидиты
- •[Гончаров н.П., 1995]
- •Рак щитовидной железы
- •Функциональное состояние репродуктивной системы
- •Гонадотропин-рилизинг гормон
- •Гонадотропины
- •Лютеинизирующий гормон (лг) в сыворотке
- •Пролактин в сыворотке
- •Ингибин в сыворотке
- •Активин в сыворотке
- •Фоллистатин в сыворотке
- •Половые стероиды
- •Эстрадиол в сыворотке
- •Тестостерон в сыворотке
- •Гормоны плаценты
- •Гормональная регуляция сперматогенеза
- •Первичная аменорея
- •Гипогонадотропный гипогонадизм
- •Вторичная аменорея
- •Яичниковая гиперандрогенемия
- •Надпочечниковая гиперандрогенемия
- •Климактерический синдром
- •Антидиуретический гормон в плазме
- •Функциональное состояние ренин - ангиотензин - альдостероновой системы
- •В плазме
- •Эндотелии в плазме
- •Мелатонин в сыворотке
- •Функциональное состояние гормональных систем регуляции обмена кальция
- •Маркеры метаболизма и резорбции костной ткани
- •Пиридинолин (Пид) и дезоксипиридинолин (Дпид) в моче
- •Функциональное состояние симпатикоадреналовой системы
- •Адреналин и норадреналин в моче
- •Общие метанефрины в моче
- •Общие норметанефрины в моче
- •Ванилилминдальная кислота в моче
- •Инсулин в сыворотке
- •Инсулина в крови
- •Проинсулин в сыворотке
- •Глюкагон в плазме
- •Соматостатин в плазме
- •Панкреатический пептид (пп) в сыворотке
- •Рецепторы к инсулину
- •Инкреторная функция желудочно-кишечного тракта
- •Гастрин в плазме
- •Секретин в плазме
- •Серотонин в сыворотке
- •Гистамин в сыворотке
- •Синдром множественных эндокринных неоплазий
- •Эритропоэтин в сыворотке
- •Альфа-фетопротеин (афп) и свободный хорионический гонадотропин (хг) в сыворотке (тест на врожденные пороки развития цнс)
- •Неонатальный тиреотропный гормон — hTsh (тест на врожденный гипотиреоз)
- •Исследование крови на фенилкетонемию
- •Исследование крови на галактоземию
- •Кровообращение в сосудах зоны микрогемоциркуляции и его связь с системной гемодинамикой
- •Система микрогемоциркуляции (структура и функции)
- •Реометрия крови
- •Исследование процесса агрегации форменных элементов крови
- •Общие закономерности расстройств микрогемоциркуляции
- •Феномен внутрисосудистой агрегации форменных элементов крови
- •Синдром повышенной вязкости крови
- •Сосудов
- •214000, Г. Смоленск, проспект им. Ю. Гагарина, 2.
Тромбиновое время
Тромбиновое время в плазме в норме — 12—16 с.
Тромбиновое время — время, необходимое для образования сгустка фибрина в плазме при добавлении к ней тромбина. Оно зависит только от концентрации фибриногена и активности ингибиторов тромбина (антитромбин III, гепарин, парапротеины); используется для оценки как третьей фазы свертывания крови — образования фибрина, так и состояния естественных и патологических антикоагулянтов.
В клинике определение тромбинового времени чаще всего преследует следующие цели:
контроль за гепаринотерапией, особенно при использовании гепарина с высоким мо лекулярным весом;
контроль за фибринолитической терапией;
диагностика гиперфибринолитических состояний;
диагностика афибриногенемии и дисфибриногенемии.
Тромбиновое время, являясь косвенным показателем содержания фибриногена, удлиняется при наследственных и приобретенных афибриногенемиях и гипофибриногенемиях (при тяжелых поражениях печени, фибринолизе, остром ДВС-синдроме). Удлиняется тромбиновое время и при парапротеинемиях.
Определение тромбинового времени является одним из распространенных методов контроля за лечением гепарином и фибринолитиками. В этих случаях тромбиновое время должно увеличиваться в 2—3 раза. При проведении тромболитической терапии определение тромбинового времени рекомендуется проводить каждые 4 ч, при этом следует помнить, что если тромбиновое время превышает оптимальное значение более чем в 2—3 раза, доза стрептоки-назы должна быть больше, чтобы увеличить потребление плазминогена и снизить образование плазмина; если тромбиновое время уменьшается до уровня ниже оптимального значения, дозу стрептокиназы следует уменьшить для того, чтобы часть плазминогена не была блокирована в форме активатора, а чтобы он полностью превращался в плазмин.
ФИЗИОЛОГИЧЕСКИЕ АНТИКОАГУЛЯНТЫ
Показатели, характеризующие состояние антикоагулянтов:
Антитромбин III.
Гепарин.
Активированное время свертывания крови.
Протеин С.
Протеин S.
Антитромбин III (at III)
Содержание AT III в плазме в норме — 80—120 %.
AT III — гликопротеид, наиболее важный естественный ингибитор свертывания крови; ингибирует тромбин и ряд активированных факторов свертывания (Ха, ХНа, IXa). AT III образует с гепарином быстродействующий комплекс — гепарин—AT III. Дефицит AT III может быть первичным (наследственным) и вторичным, связанным с определенным заболеванием
263
или состоянием. Снижение уровня AT III, являющееся фактором тромбогенного риска (снижение уровня AT III до 50—80 % ведет к значительному увеличению числа послеоперационных тромбозов), отмечается при ряде состояний и заболеваний:
при атеросклерозе, в старческом возрасте;
в середине менструального цикла, в последние месяцы беременности;
в послеоперационном периоде;
при заболеваниях печени (хронические гепатиты, циррозы печени) уровень AT III сни жается пропорционально тяжести заболевания;
при остром ДВС-синдроме, являясь его ранним и важным лабораторным признаком. Поэтому при состояниях, чреватых развитием этого осложнения, целесообразно как профилактическое определение AT III, так и определение его в качестве контроля за течением заболевания и проводимой терапией [Баркаган З.С., 1988];
при введении гепарина AT III снижается, так как соединяется с ним. Низкое содержа ние AT III ведет к неэффективности терапии гепарином. Ослабление действия гепари на наблюдается при снижении содержания AT III до 50 %; при снижении до 20 % дей ствие гепарина почти полностью прекращается. Наклонность к рецидивирующим тромбозам, особенно плохо поддающимся терапии гепарином, должна наводить на мысль о снижении AT III. При терапии гепарином желательно проводить контроль за уровнем содержания AT III;
при приеме пероральных контрацептивов и эстрогенов;
наиболее частая причина снижения уровня AT III — шоковые состояния, при которых резко падает продукция AT III печенью и активируются его ингибиторы в крови.
Повышение уровня AT III расценивается как фактор геморрагического риска и отмечается в следующих случаях:
при вирусном гепатите, холестазе, тяжелом остром панкреатите, раке поджелудочной железы;
при дефиците витамина К;
при приеме антикоагулянтов непрямого действия;
во время менструации.
Гепарин в плазме
Активность гепарина в плазме в норме — 0,24—0,6 кЕД/л.
Гепарин является сульфатированным полисахаридом, синтезируется в тучных клетках, не проникает через плаценту. В большом количестве содержится в печени и легких. Превращает AT III в антикоагулянт немедленного действия. С фибриногеном, плазмином и адреналином образует комплексы, обладающие противосвертывающим и фибринолитическим действием. В малых концентрациях ингибирует реакцию между факторами 1Ха, VIII, аутоката-литическую активацию тромбина и действие фактора Ха. В высоких концентрациях ингибирует коагуляцию во всех фазах, в том числе и тромбин-фибриногеновую. Тормозит некоторые функции тромбоцитов. Экзогенный гепарин инактивируется главным образом в печени, но 20 % его выделяется с мочой. Поэтому после назначения его больным с поражением печени и почек надо следить за эффективностью лечения антикоагулянтом и при необходимости (увеличение времени свертывания крови и тромбинового времени более чем в 2—3 раза) уменьшать его дозы.
Гепарин оказывает свое действие только при наличии полноценного AT III в крови.
Определение гепарина необходимо как для мониторинга гепаринотерапии, так и для выявления резистентности больных к гепарину. Основные формы гепаринорезистентности:
дефицит AT III. В основе механизмов развития дефицита AT III лежат усиленное по требление его (например, при ДВС-синдроме), гепарининдуцированное истощение, нарушение синтеза, потеря с мочой при массивной протеинурии;
функциональные аномалии AT III: снижение чувствительности к гепарину, снижение инактивирующего эффекта в отношении тромбина. В основе этой патологии AT III лежат врожденные качественные дефекты молекулы AT III;
нарушение взаимодействия AT III с гепарином. В основе патологии лежит конкурент ное взаимодействие иммунных комплексов, белков острой фазы воспаления, антиге паринового фактора тромбоцитов, фибронектина с AT III;
264
дисциркуляторные метаболические формы (стаз, ацидоз, микроциркуляторные нару шения);
смешанные формы.
Развитие указанных форм гепаринорезистентности является одной из основных причин неэффективного применения гепарина у больных.
Повышение количества гепарина наблюдается при диффузных болезнях соединительной ткани, лейкозах, лучевой болезни, при анафилактическом и посттрансфузионном шоке.
Активированное время свертывания крови (ABC)
ABC в норме — 80—120 с.
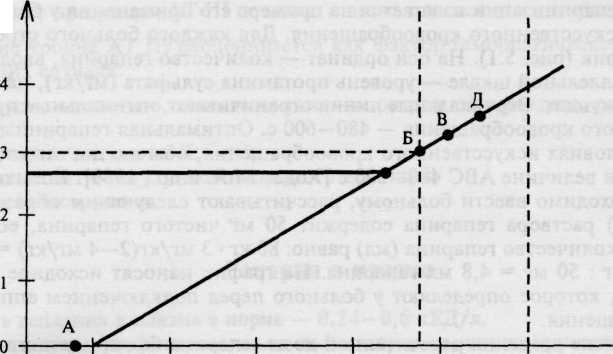
Метод определения активированного времени свертывания крови (ABC) позволяет контролировать и регулировать уровень гепаринизации больного во время работы искусственных органов (аппарат искусственного кровообращения, искусственная почка, печень, гемо-сорбция), рассчитывать нейтрализующую дозу протамина сульфата и оценивать полноту нейтрализации гепарина. Большим достоинством метода является возможность выявлять больных с той или иной степенью резистентности к гепарину, когда для достижения оптимальной степени гепаринизации приходится вводить больному гепарин в дозе до 13 мг/кг, в то время как обычно применяется 2—4 мг/кг. Практическое использование метода ABC для контроля уровня гепаринизации излагается на примере его применения у больных, оперируемых в условиях искусственного кровообращения. Для каждого больного строится свой индивидуальный график (рис. 5.1). На оси ординат — количество гепарина, вводимого больному (мг/кг), на параллельной шкале — уровень протамина сульфата (мг/кг), на оси абсцисс — величина ABC в секундах. Вертикальные линии ограничивают оптимальные пределы ABC во время искусственного кровообращения — 480—600 с. Оптимальная гепаринизация больного, оперируемого в условиях искусственного кровообращения, обычно достигается при дозе гепарина 2—4 мг/кг и величине ABC 480—600 с [Ходас М.Я. и др., 1989]. Количество гепарина (мл), которое необходимо ввести больному, рассчитывают следующим образом: 1 мл (1 мл содержит 5000 ЕД) раствора гепарина содержит 50 мг чистого гепарина, если масса тела больного 80 кг, то количество гепарина (мл) равно: 80 кг • 3 мг/кг(2—4 мг/кг) = 240 мг чистого гепарина; 240 мг : 50 мг = 4,8 мл гепарина. На график наносят исходное значение ABC (рис. 5.1, точка А), которое определяют у больного перед подключением аппарата искусственного кровообращения.
Через 5 мин после введения рассчитанной дозы гепарина больному повторно определяют ABC и отмечают эту точку на графике (рис. 5.2, точка Б) — место пересечения значения ABC и введенной дозы гепарина (мг/кг); точки А и Б соединяют прямой линией, которой затем пользуются для контроля за уровнем гепаринизации во время искусственного кровооб-
Гепарин мг/кг
4 --
3 --
2 --
1 --
секунды
100 200 300 400 500
Рис. 5.1. Исходное значение ЛВС.
600
265
Гепарин
„ мг/кг
•'
4
--

100 200 300 400 500 600
Рис. 5.2. Значения ЛВС через 5 мин после введения гепарина.
Гепарин
мг/кг
100 200 300 400 500 600
Рис. 5.3. Рабочий график для контроля за уровнем гепаринизации.
Гепарин
мг/кг
 Протамина
сульфат,
мг/кг
Протамина
сульфат,
мг/кг
3 ..
12 4-
100 200 300 400 500
Рис. 5.4. Рабочий график расчета дозы протамина сульфата.
\ ABC, секунды
,
ращения. Если это значение ABC не входит в оптимальные его значения (480—600 с), т.е. имеется рефрактерность к гепарину, дополнительное количество гепарина для введения рассчитывают по приведенной ниже методике. В дальнейшем ABC определяют каждые 30 мин искусственного кровообращения.
Рабочий график приведен на рис. 5.3. Например, ABC до введения гепарина составляло 90 с (точка А), через 5 мин после введения гепарина — 480 с (точка Б), в начале искусственного кровообращения — 510 с (точка В), спустя 30 мин искусственного кровообращения — 450 с (точка Г). Поскольку эта величина свидетельствует о недостаточном уровне гепаринизации больного, по рабочему графику легко рассчитать дополнительное количество гепарина, которое необходимо довести для достижения оптимальной гепаринизации. Для этого из точки Г на ось ординат опускается перпендикуляр. Расстояние между сплошной и исходной пунктирной линией, равное 0,2 мг/кг, соответствует дозе гепарина, необходимой для создания адекватного уровня гепаринизации. После ее введения ABC увеличилось до 500 с (точка Д).
Перед окончанием искусственного кровообращения ABC составляло 480 с (рис. 5.4, точка Е), что соответствовало содержанию гепарина 3 мг/кг.
Для нейтрализации этого гепарина больному необходимо ввести 9 мг/кг протамина сульфата. Для перевода этого количества протамина сульфата в миллилитры необходимо 9 мг/кг х 80 кг (масса тела больного) = 720 мг; 1 мл раствора протамина сульфата в ампулах содержит 10 мг чистого протамина сульфата, тогда количество его в миллилитрах равно: 720 мг : 10 мг = 72 мл. В практической работе необходимо помнить, что отечественный и импортный протамина сульфат обладают разной активностью по отношению к инактивации гепарина. После введения больному 72 мл протамина сульфата через 10 мин определяют ABC, которое составляет 120 с (рис. 5.4, точка Ж), что несколько выше исходного значения ABC (90 с). Дополнительную дозу протамина сульфата рассчитывают по графику, для этого из точки Ж опускают перпендикуляр на ось ординат. Расстояние между этим перпендикуляром и осью абсцисс равно 1 мг/кг. Это количество протамина сульфата было введено больному, и через 10 мин ABC нормализовалось, составило 95 с (точка Ж,).
 Протеин
С в плазме
Протеин
С в плазме
Содержание протеина С в плазме в норме — 70—130 %.
Протеин С — витамин-К-зависимый гликопротеид плазмы. Синтезируется печенью в виде неактивного профермента, который под влиянием комплекса тромбин—тромбомодулин превращается в активную форму. Активированный протеин С — антикоагулянтный энзим, который селективно инактивирует факторы Va и Villa путем их гидролиза в присутствии ионизированного кальция, фосфолипидов и его кофактора — протеина S, тем самым препятствуя переходу протромбина в тромбин.
Определение протеина С — дополнительный тест для оценки состояния антикоагулянт-ной системы у больного. Специфичностью теста является то, что дефицит протеина С связан с высоким риском развития тромбоза, особенно венозного тромбоза и тромбоэмболии легочной артерии у молодых людей.
Дефицит протеина С — частая причина тромбоэмболических заболеваний у пожилых людей, поэтому определение его показано у больных в возрасте старше 50 лет, страдающих тромбозами, у которых его недостаточность составляет 25—40 % [Sammana M. et al., 1983; D'Angelo S.V. et al., 1996]. Недостаточность протеина С может быть двух типов: количественная (тип I) — низкая концентрация протеина и качественная (тип II) — протеин имеется, но он неактивен или малоактивен. При врожденной недостаточности протеина С — гетерозиготной — его активность составляет 30—60 %, при гомозиготной — 25 % и ниже. Дальнейшие исследования показали, что резистентность к протеину С (неактивный протеин С) объясняется генетически обусловленным дефектом фактора V (и фактора VIII в других случаях) свертывающей системы крови [D'Angelo S.V. et al., 1996].
Особенностью антикоагулянтного действия протеина С является то, что он не оказывает влияния без присутствия кофактора — протеина S (так же как гепарин неэффективен без AT III), поэтому рекомендуется определять протеин С совместно с протеином S.
Протеин С не является белком острой фазы. Снижение протеина С отмечается при заболеваниях печени, витамин-К-авитаминозе, ДВС-синдроме. При нефротическом синдроме протеин С может теряться с мочой. Непрямые антикоагулянты, контрацептивы снижают концентрацию протеина С.
267
Протеин S в плазме
Содержание протеина S в плазме в норме — 60—140 %.
Протеин S — витамин-К-зависимый гликопротеид плазмы. Циркулирует в крови в двух формах: свободный белок — 40 % и связанный с С4 компонентом комплемента — 60 %. Они находятся в динамическом равновесии, но активным является только свободный белок Протеин S является кофактором протеина С в процессе инактивации Va и Villa факторов свертывания крови [Баркаган З.С., 1988].
Уровень протеина S у мужчин выше, чем у женщин. Непрямые антикоагулянты влияют на него слабее, чем на протеин С; это обусловлено тем, что протеин S синтезируется в эндо-телиальных клетках печени и мегакариоцитах. При заболеваниях печени его уровень выше, чем протеина С. В связи с тем что основная часть протеина S связана с С4 компонентом комплемента, при увеличении концентрации С4 (острая фаза воспалительных заболеваний или обострение хронических) происходит связывание протеина S с ним и количество свободного протеина S снижается. Снижение концентрации протеина S может наблюдаться при нефротическом синдроме вследствие его потерь.
Классификация недостаточности протеина S.
Тип I — недостаточность общего протеина S.
Тип II — недостаточность свободного протеина S при нормальном или пограничном содержании общего протеина S.
Тип III — дисфункция протеина S с ослабленной антикоагулянтной активностью.
Дефицит протеина S приводит к развитию венозного тромбоза, особенно у молодых людей.
В табл. 5.12. приведены данные о влиянии изменений показателей антикоагулянтной системы на риск развития тромбогеморрагических осложнений.
Таблица 5.12. Показатели антикоагулянтной системы и факторы риска развития
