
- •Міністерство освіти і науки України Харківський національний університет імені в. Н. Каразіна Теоретичні основи та способи розв’язання задач з аналітичної хімії
- •Вступне слово
- •Основні позначення
- •1. Величини, що визначають склад
- •1.1. Хімічний склад
- •Розв’язок. Масова концентрація дорівнює
- •1.2. Стехіометричні розрахунки за рівнянням реакції
- •1.3. Вправи
- •2. Закон дії мас. Алгебра хімічних реакцій
- •2.1. Загальні співвідношення
- •2.2. Активності та рівноважні концентрації
- •Позначення констант рівноваг
- •2.3. Лінійні комбінації реакцій
- •2.4. У який бік зміщено рівновагу реакції?
- •2.5. Як записувати реакції у лабораторних журналах?
- •2.6. Вправи
- •3. Концентраційно-логарифмічні діаграми (клд)
- •3.1. Клд для гетерогенних систем
- •3.2. Графіки логарифмів розчинності
- •3.3. Вправи із гетерогенних систем
- •3.4. Умови переважання в гомогенних системах
- •3.5. Ускладнення у визначенні областей переважання
- •3.6. Клд для систем із одноядерними комплексами
- •3.7. Зміна ядерності реагентів
- •3.8. Вправи із гомогенних систем
- •4. Баланс компонентів
- •4.1. Загальні принципи
- •4.2. Підстановка рівнянь здм у рівняння балансу
- •4.3. Одноядерні продукти
- •4.4. Фази постійного складу
- •4.5. Вправи Гомогенні системи
- •5. Розрахунки за балансом компонентів
- •5.1. Буферні розчини
- •5.2. Стехіометричні співвідношення концентрацій
- •Кислотно-основні рівноваги
- •5.3. Ієрархія макро- та мікрокомпонентів
- •5.4. Гетерогенні системи
- •5.5. Кількісний вимір буферних властивостей
- •5.6. Вправи Буферні розчини
- •Стехіометричне співвідношення концентрацій
- •Гетерогенні системи
- •Буферні властивості
- •Системи із комплексами
- •6. Розрахунки за балансом реакції
- •6.1. Умови балансу
- •6.2. Прості розрахунки
- •Добуваючи квадратний корінь з обох частин, маємо
- •6.3. Методи розрахунків
- •6.4. Вправи
- •7. Умовні константи рівноваги
- •7.1. Класи реагентів
- •7.2. Умовні константи рівноваги
- •7.3. Умовні константи в розрахунках рівноваг
- •7.4. Графіки залежностей часток та їх логарифмів
- •7.5. Графіки логарифмів умовних констант
- •Параметри графіка залежності
- •7.6. Вправи
- •8. Декілька фаз змінного складу
- •8.1. Розподіл речовини між фазами
- •Відношення об’ємів порцій фаз дорівнює
- •Тангенси кутів нахилу асимптот для логарифма умовної константи екстракції оксинату плюмбуму від pH, приклад 8.4
- •8.2. Іонний обмін
- •8.3. Вправи
- •9. Утворення певної рівноважної концентрації, розчинності або ступеня екстракції
- •9.1. Метод балансу компонентів
- •На кроці 5 (непотрібному для уточнення клд) використовуємо
- •9.2. Метод балансу реакцій
- •9.3. Концентрація реагенту, що забезпечує задані умови для іншої речовини
- •9.4. Відокремлення компонентів Графічний розв’язок цієї проблеми показано на прикладі 3.3. Тут розгляньмо типові розрахункові методи.
- •9.5. Вибір величини умовної константи
- •9.6. Вправи
- •Варіанти завдання для вправи 9.1
- •10. Визначення компонентів. Гравіметрія
- •10.1. Стехіометричні співвідношення у гравіметрії
- •10.2. Розрахунок результату аналізу
- •10.3. Похибки у гравіметрії
- •10.4. Вправи
- •11. Титриметрія: стехіометричні розрахунки
- •11.1. Загальні відомості про титриметрію
- •11.2. Результат кислотно-основного титрування
- •Аліквотне відношення, {Vк/Vп}, безрозмірне, бо величини Vк та Vп виражено у однакових одиницях.
- •Виводячи формулу, маємо (у процентах)
- •11.3. Визначення концентрації розчину титранту за титруванням зразкової речовини
- •Для еквівалентів коефіцієнти вживаємо неявно,
- •Стехіометричний множник 2 приховуємо, застосовуючи еквівалент, (1/2)h2c2o4, або (1/2)h2c2o4·2h2o.
- •11.4. Оцінка наважок та аліквот
- •Бюретці відповідає оптимальна витрата титранту 20 мл, отже nst(oh‑) 2·10‑3 моль, n(н2с4н4о4) nst(oh‑) / 2 1·10‑3 моль.
- •11.5. Окреме визначення декількох аналітів
- •За двома рівняннями,
- •11.6. Зворотне титрування
- •Титруванню надлишку реагенту відповідає реакція
- •Дія 4. Масова частка CaCo3(s) у мінералі дорівнює
- •11.7. Визначення продукту, в який перетворено аналіт
- •Бо при зворотному титруванні здобутий po43‑ знову переходить у hpo42‑. Надлишок реагенту титруємо за реакцією
- •Дія 5. Масова частка p2o5 у мінералі дорівнює
- •11.8. Окисно-відновне титрування
- •11.9. Комплексометричне титрування
- •Дія 4. Масова частка kAl(so4)2 12 h2o у технічному галуні ‑
- •11.10. Вправи
- •Окисно-відновне титрування
- •Комплексонометричне титрування
- •12. Титриметрія: розбіжність точок –стехіометрії та кінцевої
- •12.1. Загальні уявлення
- •12.2. Дослідження титрування безпосередньо за клд
- •12.3. Різні методи титрування
- •12.4. Класи та умовні константи у титруванні
- •12.5. Вибір умов титрування за графіками залежностей логарифмів умовних констант
- •Параметри асимптот для прикладу 12.10
- •Із здм реакції
- •Параметри асимптот графіків (приклад 12.11)
- •Параметри асимптот графіків (приклад 12.12)
- •12.6. Вправи
- •Кислотно-основне титрування
- •Окисно-відновне титрування
- •Комплексонометричне титрування
- •Теоретичні проблеми титрування
- •Цитована література
- •Відповіді до вправ
- •61077, М.Харків, пл. Свободи, 4 Харківський національний університет ім. В.Н. Каразіна, Організаційно-видавничий відділ нмц
12.3. Різні методи титрування
Вибір головної змінної pX визначають: різновид реакцій (наприклад, для окисно-відновних зручно pX = pe); складність аналізу (якщо аналітів декілька, то зручніше X = T); індикатор (якщо він реагує із A, то зручніше X = A). Не біда, якщо такі переваги суперечать одна одній. Якщо, наприклад, вибрано X = T, а індикатор реагує із Z X, то в околі «дна» подаємо графік lg [Z]. Потім знаходимо абсцису pX та точку на «стінці» для точки із ординатою lg [Z], у якій індикатор змінює колір.
Алгоритм дослідження титрування за КЛД дещо громіздкий, якщо охоплюємо усі види титрування, але приваблює його однаковість для цих видів. У конкретних випадках підхід спрощується. Відзначимо такі кроки:
1. Вибрати головну змінну pX, на її осі знайти сумісні області переважання продуктів, що утворюються в реакції титрування (11.1). Ці продукти є макрокомпонентами, Bj*. Перетин областей – це інтервал абсцис над «ямою» на сумісній КЛД для речовини, яку титрують, та титранту.
2. Оцінити загальні концентрації макрокомпонентів, tj*, з урахуванням реакцій (12.8) та взаємного розведення розчинів.
3. В області, знайденій на кроці 1, розглянути похилі фрагменти КЛД, що проходять вище за решту подібних графіків. Ці фрагменти відповідають продуктам A1 та A2 або із сусідніх областей переважання, або тим, що ніде не переважають.
4. Для A1 та A2 записати реакції (12.9). Визначити еквіваленти f1A1 й f2A2, що відповідають частинці X у цих реакціях, координати ТС та нахили для графіків lg [f1A1] та lg [f2A2], фрагменти яких, до їх перетину, є «стінками ями». Побудувати ці фрагменти графіків.
5. Вибрати індикатор із переходом забарвлення над «ямою» й оцінити відповідні рХfin та логарифм відносної похибки (12.17). Кінці вертикального відрізка, що відповідає lg ||, – це ордината lg {AХ c(A)}, для аналіту А, та точка на «стінці ями». Якщо ескіз КЛД виконано недостатньо ретельно, координати точок можна розрахувати або ґрунтуючись на геометричних співвідношеннях із відомими тангенсами, |fi|, або за приблизними рівняннями ЗДМ реакцій (12.9). Визначити знак похибки, використовуючи для конкретного Х підхід, намічений у розділі 12.2.
Кроки 1-3 є корисними на початковій стадії дослідження методики – можливо нової, ще не вживаної.
Ордината ТС може не збігатися із lg {AХ c(A)}. Так, якщо у прикладі 12.4 нас цікавить вміст Na2CO3 (зокрема, якщо визначаємо концентрацію титранту), то потрібна верхня ТС для лівої «ями», із зсувом, обумовленим обліком фактора еквівалентності. Отже, треба бути готовим вибирати верхній кінець відрізка для lg || за окремо розрахованою ординатою, як це було на рис. 12.2 для сильної кислоти.
У цій главі ми не наводимо прикладів зворотного титрування, титрування замісника тощо. Для зворотного титрування вибираємо ординату верхнього кінця відрізка для lg ||, що відповідає концентрації еквівалента для аналіту, а не для допоміжного реактиву.
Розрахунок рХst. У підручниках, орієнтованих на розрахунок кривих титрування, значну увагу приділяють розрахункові рХst. Формулу розрахунку може підказати КЛД. Нехай відомі абсциси точок на «стінках ями», що розташовані на однаковій висоті, рХл для лівої та рХп для правої «стінки». Такими точками часто можуть бути ТС для еквівалентів аналіту і титранту.
0 | рХл | рХst | рХп |
|
«Стінки» на КЛД відповідають графікам логарифмів рівноважних концентрацій еквівалентів, lg | 1X[A1] | та lg | 2X[A2] |. Їх відрізки від рХл або рХп до точки перетину (абсцисою рХst) є гіпотенузами двох трикутників. Довжину y спільного катета трикутників, що йде вертикально через точку перетину «стінок» виражаємо через абсциси,
| 1X | = у / (рХst ‑ рХл), | 2X | = у / (рХп ‑ рХst),
де тангенсами є стехіометричні коефіцієнти при Х у відповідних реакціях (12.9). Вирішуючи цю систему рівнянь відносно невідомої рХst , маємо
рХst = (| 1X | рХл + | 2X | рХп) / (| 1X | + | 2X |), (12.18)
тобто шукана абсциса є «середнім зваженим» зі значень відомих абсцис, рХл та рХп. «Вагою» є стехіометричні коефіцієнти. При | 1X | = | 2X | = 1 цей результат є очевидним: тоді «стінки» йдуть симетрично, утворюючи рівнобічний трикутник. Вивести формулу (12.18) із ЗДМ (ми до цієї задачі повернемось) легше, використовуючи ескіз КЛД як підказку.
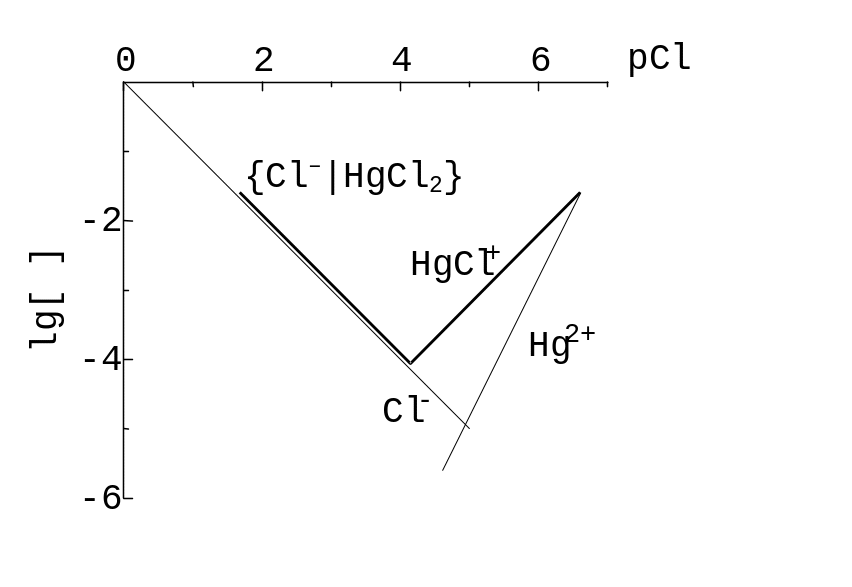
Рис. 12.5. Фрагменти КЛД для титрування хлоридів, t(Cl‑) =0,050 моль/л, розчином c(Hg(NO3)2) = 0,025 моль/л при c(HNO3) = 0,10 моль/л. Жирна лінія – графік lg |c(Cl-)|.
Приклад 12.5. Титрування розчину Cl‑ розчином Hg(NO3)2, якщо у точці стехіометрії c(HNO3) = 0,10 моль/л, c(NaCl)st = = 0,050 моль/л.
Розв’язок. Титрування ґрунтується на утворенні комплексу,
Hg2+ + 2 Cl‑ HgCl2,
продуктові відповідає «дах», на рис. 12.5 опущений. Реакціями (12.9) є
Cl‑ Cl‑ та HgCl2 ‑ Cl‑ HgCl+.
Для А1 = Cl‑ (аналіту) та А2 = HgCl+ числа еквівалентності дорівнюють 1. Оскільки до lg [Cl‑] близька паралельна асимптота lg [HgCl3‑], уведімо як «стінку» функцію lg [Cl‑| HgCl2], для класу A1 = {Cl‑| HgCl2} = {Cl‑, HgCl3‑} при [HgCl2] const = 0,025 моль/л. Відсутність відомостей про стійкість комплексів дифенілкарбазиду й дифенілкарбазону, індикаторів у меркурометрії (титруванні розчином Hg2+), не дозволяє здійснити крок 5.
Зауважмо, що, зменшуючи концентрацію аналіту, c(NaCl)st, ми зменшимо пов’язану з нею c(Hg2+)st, отже, і ординату ТС. Положення лівої «стінки ями» майже не зміниться, отже, «яма» стане мілкішою, і можлива точність титрування зменшиться.
Приклад 12.6. Титрування розчину іоду тіосульфатом, для концентрацій у точці стехіометрії: c(I2)st = 0,025 моль/л, c(KI)st = 0,120 моль/л.
Розв’язок. У прикладі 5.10 розглянуто рівноважний склад системи в точці стехіометрії. Там оцінено іонну силу розчину та концентраційні константи напівреакцій.
(1/2) I3‑ + e‑ (3/2) I‑, lg KIc = 9,31, (1/2) S4O62‑ + e‑ S2O32‑, lg KSc = 1,63.
У попередніх прикладах цієї глави ми не враховували коефіцієнтів активності, вважаючи, що їх вплив на висновки про придатність методу лише на межі припустимого значення похибки. Але тут, оскільки значення констант ми вже підрахували, чому б їх не використати?
Еквівалентами є (1/2) I3‑ та S2O32‑ для вихідних речовин й (3/2) I‑ та (1/2) S4O62‑ для продуктів титрування. Продуктам відповідає «дах» на КЛД, не показаний на рис. 12.6, для концентрацій
[B1*] = [S4O62‑] = 0,025 моль/л, [(1/2) S4O62‑] = 2 0,025 = 0,050 моль/л, [B2*] = [I‑] = 0,170 моль/л, [(3/2) I‑] = (2/3) 0,170 0,113 моль/л.
Логарифми концентрацій еквівалентів дорівнюють ординатам ТС: для лівої –1,3, а для правої –0,95. Абсциси розраховуємо, підставляючи у ЗДМ як для вихідного реагенту, так і для продукту граничні значення концентрацій, що відповідають протіканню реакцій у відповідних напрямках. Маємо: для лівої реТС 2,1, а для правої реТС 9,8. Тангенси кутів нахилу – (-1) для лівої «стінки» й 2 для правої. Із цими параметрами побудовано рис. 12.6.
В іодометрії (титруванні з участю I3‑ та S2O32‑) індикатор, крохмаль, утворює з I2 синій клатрат (сполуку включення). У конічній колбі місткістю 250 мл, із 100 мл розчину, виявляють с(I2) = 2,510‑5 моль/л [12, с. 247]. Їй відповідає ордината допоміжної горизонтальної прямої на рис. 12.5, lg [(1/2)I3‑]Ind = lg (22,510‑5) = ‑ 4,3, на 3 нижче за ліву ТС, для S2O32‑. Отже, lg || ‑ 3, точність аналізу достатня. Для цієї оцінки lg [ ]TC,I непридатна, завищена, бо у вихідну систему ввели продукт титрування, I‑.
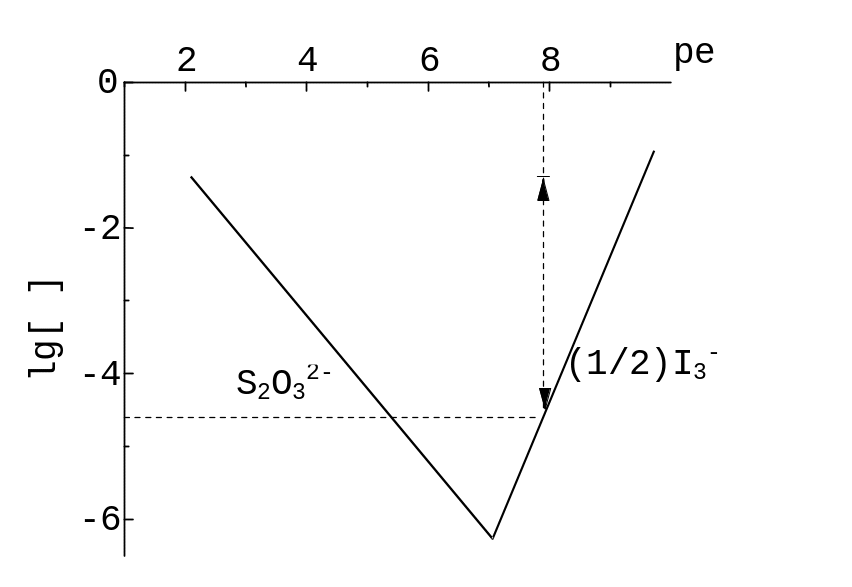
Рис. 12.6. Титрування іоду тіосульфатом, t(1/2 I3 ‑) = t(Na2S2O3) = 0,050 моль/л, c(KI) = 0,120 моль/л. Суцільна лінія – графік функції lg |c(e‑)|. Пунктирні лінії відповідають переходові забарвлення крохмалю.
Оцінку за КЛД можна уточнити розрахунками. Тут безпосередньо задано концентрацію ще невідтитрованого іоду, що її відчуває індикатор. Тому розрахувати відносну похибку занадто просто, це
= [I3‑]Ind / c(I2)st = ‑ 2,510‑5 / 0,025 моль/л = ‑ 10‑3, lg || = ‑ 3,
що збігається з оцінкою за графіком. Але ця простота є ілюзорною, бо не враховує, чи йде взагалі хімічна реакція титрування, і наскільки глибоко вона протікає. В термінах оцінок за КЛД нас цікавить, чи є на КЛД «яма», що відповідає кінцю титрування, і чи достатньо вона глибока. Якщо «яма» мілка, так що її «дну» відповідає lg [(1/2)I3‑]st > lg [(1/2)I3‑]Ind, то наприкінці титрування ми потрапимо в «лійку», із високим впливом випадкової складової похибки, через який ми ще у прикладі 12.2 домовились не зображувати «лійки» на графіках! Отже, щоб обмежитись розрахунками, маємо принаймні оцінити величину [(1/2)I3‑]st й порівняти її з [(1/2)I3‑]Ind.
Уточнити оцінку можна за геометрією КЛД. Щоб використати формулу (12.18), треба знати абсциси точок, що лежать на одній висоті на обох «стінках». Тут задачу ускладнено тим, що ТС лежать на різній висоті, бо до системи перед титруванням додано (щоб збільшити розчинність I2) продукт реакції, KI. Знайдімо абсцису точки на правій «стінці», що відповідає ординаті лівої, lg [S2O32‑]ТС = –1,3. Від правої ТС, із абсцисою –0,95, спустімось на (1,3 ‑ 0,95) = 0,35. Оскільки нахилу правої «стінки» відповідає тангенс 2, то різниці ординат відповідає різниця абсцис 0,35 / 2 = 0,175 0,2. Досить ескіза, щоб не помилитися у знаку поправки: шукана абсциса дорівнює peп = 9,8 – 0,2 = 9,6. Тоді реst = (2,1 + 2 9,6) / (1 + 2) = 7,1. Для питання про індикацію цікава ордината точки перетину «стінок». Різниця абсцис реТС 9,8 (для правої ТС) та реst дорівнює 2,7, різниця ординат вдвічі більша (бо тангенс дорівнює 2), тобто 2,72 = 5,4, у перетині lg [(1/2)I3‑] = ‑0,95 – 5,4 = 6,35 < lg [(1/2)I3‑]Ind = ‑ 4,3, отже, індикація є можливою.
Докладний розрахунок складу розчину в точці стехіометрії, без посилання на графічні оцінки, ми розглянули в прикладі 5.10. Знайдене там [I3‑]st = 2,3710‑7 моль/л, у межах точності оцінок збігається із знайденою за графіком та за розрахунком, підказаним ескізом. Аналогічною є оцінка за методом балансу реакцій,
1 |
3 I‑ |
|
I3‑ + 2 e‑, |
‑ 2 lg KIc = ‑18,62, |
||
1 |
S2O42‑ + 2 e‑ |
|
2 S2O32‑, |
2 lg KSc = 3,26, |
||
|
3 I‑ + |
S2O42‑ |
I3‑ |
+ 2 S2O32‑, |
‑ 15,36, |
|
c |
0,170 |
0,025 |
0 |
0 |
x << 0,025 моль/л |
|
[ ] |
0,170 ‑ 3 x |
0,025 ‑ x |
x |
2 x |
|
|
маємо: [I3‑] = 2,3710‑7 моль/л, що збігається з попередньою оцінкою.
Якщо пропорційно зменшити концентрації всіх реагентів, то глибина «ями» на КЛД дещо зміниться через вплив концентрацій на абсциси систем зі зміною ядерності (дивись приклад 5.10). Слід зважати також на зміну точності індикації (відповідна точка стане ближчою до «верху ями»), на вплив конкурентних реакцій, що погіршує точність титрування або унеможливлює його. Меншу концентрацію аналіту можна визначити, переходячи до інструментальних методів реєстрації кінцевої точки титрування.
