
- •Міністерство освіти і науки України Харківський національний університет імені в. Н. Каразіна Теоретичні основи та способи розв’язання задач з аналітичної хімії
- •Вступне слово
- •Основні позначення
- •1. Величини, що визначають склад
- •1.1. Хімічний склад
- •Розв’язок. Масова концентрація дорівнює
- •1.2. Стехіометричні розрахунки за рівнянням реакції
- •1.3. Вправи
- •2. Закон дії мас. Алгебра хімічних реакцій
- •2.1. Загальні співвідношення
- •2.2. Активності та рівноважні концентрації
- •Позначення констант рівноваг
- •2.3. Лінійні комбінації реакцій
- •2.4. У який бік зміщено рівновагу реакції?
- •2.5. Як записувати реакції у лабораторних журналах?
- •2.6. Вправи
- •3. Концентраційно-логарифмічні діаграми (клд)
- •3.1. Клд для гетерогенних систем
- •3.2. Графіки логарифмів розчинності
- •3.3. Вправи із гетерогенних систем
- •3.4. Умови переважання в гомогенних системах
- •3.5. Ускладнення у визначенні областей переважання
- •3.6. Клд для систем із одноядерними комплексами
- •3.7. Зміна ядерності реагентів
- •3.8. Вправи із гомогенних систем
- •4. Баланс компонентів
- •4.1. Загальні принципи
- •4.2. Підстановка рівнянь здм у рівняння балансу
- •4.3. Одноядерні продукти
- •4.4. Фази постійного складу
- •4.5. Вправи Гомогенні системи
- •5. Розрахунки за балансом компонентів
- •5.1. Буферні розчини
- •5.2. Стехіометричні співвідношення концентрацій
- •Кислотно-основні рівноваги
- •5.3. Ієрархія макро- та мікрокомпонентів
- •5.4. Гетерогенні системи
- •5.5. Кількісний вимір буферних властивостей
- •5.6. Вправи Буферні розчини
- •Стехіометричне співвідношення концентрацій
- •Гетерогенні системи
- •Буферні властивості
- •Системи із комплексами
- •6. Розрахунки за балансом реакції
- •6.1. Умови балансу
- •6.2. Прості розрахунки
- •Добуваючи квадратний корінь з обох частин, маємо
- •6.3. Методи розрахунків
- •6.4. Вправи
- •7. Умовні константи рівноваги
- •7.1. Класи реагентів
- •7.2. Умовні константи рівноваги
- •7.3. Умовні константи в розрахунках рівноваг
- •7.4. Графіки залежностей часток та їх логарифмів
- •7.5. Графіки логарифмів умовних констант
- •Параметри графіка залежності
- •7.6. Вправи
- •8. Декілька фаз змінного складу
- •8.1. Розподіл речовини між фазами
- •Відношення об’ємів порцій фаз дорівнює
- •Тангенси кутів нахилу асимптот для логарифма умовної константи екстракції оксинату плюмбуму від pH, приклад 8.4
- •8.2. Іонний обмін
- •8.3. Вправи
- •9. Утворення певної рівноважної концентрації, розчинності або ступеня екстракції
- •9.1. Метод балансу компонентів
- •На кроці 5 (непотрібному для уточнення клд) використовуємо
- •9.2. Метод балансу реакцій
- •9.3. Концентрація реагенту, що забезпечує задані умови для іншої речовини
- •9.4. Відокремлення компонентів Графічний розв’язок цієї проблеми показано на прикладі 3.3. Тут розгляньмо типові розрахункові методи.
- •9.5. Вибір величини умовної константи
- •9.6. Вправи
- •Варіанти завдання для вправи 9.1
- •10. Визначення компонентів. Гравіметрія
- •10.1. Стехіометричні співвідношення у гравіметрії
- •10.2. Розрахунок результату аналізу
- •10.3. Похибки у гравіметрії
- •10.4. Вправи
- •11. Титриметрія: стехіометричні розрахунки
- •11.1. Загальні відомості про титриметрію
- •11.2. Результат кислотно-основного титрування
- •Аліквотне відношення, {Vк/Vп}, безрозмірне, бо величини Vк та Vп виражено у однакових одиницях.
- •Виводячи формулу, маємо (у процентах)
- •11.3. Визначення концентрації розчину титранту за титруванням зразкової речовини
- •Для еквівалентів коефіцієнти вживаємо неявно,
- •Стехіометричний множник 2 приховуємо, застосовуючи еквівалент, (1/2)h2c2o4, або (1/2)h2c2o4·2h2o.
- •11.4. Оцінка наважок та аліквот
- •Бюретці відповідає оптимальна витрата титранту 20 мл, отже nst(oh‑) 2·10‑3 моль, n(н2с4н4о4) nst(oh‑) / 2 1·10‑3 моль.
- •11.5. Окреме визначення декількох аналітів
- •За двома рівняннями,
- •11.6. Зворотне титрування
- •Титруванню надлишку реагенту відповідає реакція
- •Дія 4. Масова частка CaCo3(s) у мінералі дорівнює
- •11.7. Визначення продукту, в який перетворено аналіт
- •Бо при зворотному титруванні здобутий po43‑ знову переходить у hpo42‑. Надлишок реагенту титруємо за реакцією
- •Дія 5. Масова частка p2o5 у мінералі дорівнює
- •11.8. Окисно-відновне титрування
- •11.9. Комплексометричне титрування
- •Дія 4. Масова частка kAl(so4)2 12 h2o у технічному галуні ‑
- •11.10. Вправи
- •Окисно-відновне титрування
- •Комплексонометричне титрування
- •12. Титриметрія: розбіжність точок –стехіометрії та кінцевої
- •12.1. Загальні уявлення
- •12.2. Дослідження титрування безпосередньо за клд
- •12.3. Різні методи титрування
- •12.4. Класи та умовні константи у титруванні
- •12.5. Вибір умов титрування за графіками залежностей логарифмів умовних констант
- •Параметри асимптот для прикладу 12.10
- •Із здм реакції
- •Параметри асимптот графіків (приклад 12.11)
- •Параметри асимптот графіків (приклад 12.12)
- •12.6. Вправи
- •Кислотно-основне титрування
- •Окисно-відновне титрування
- •Комплексонометричне титрування
- •Теоретичні проблеми титрування
- •Цитована література
- •Відповіді до вправ
- •61077, М.Харків, пл. Свободи, 4 Харківський національний університет ім. В.Н. Каразіна, Організаційно-видавничий відділ нмц
12. Титриметрія: розбіжність точок –стехіометрії та кінцевої
12.1. Загальні уявлення
Зміна загальних концентрацій у титруванні. Змішуючись, розчини розводять один одного. Спрощуючи розрахунок, вважають, що наближено об’єм суміші дорівнює сумі об’ємів розчинів, що складають цю суміш,
V = VA + VT, (12.1)
де, як у главі 11, індекс А відносимо до аналіту, а індекс Т – до титранту. Якщо концентрації аналіту та титранту відповідно дорівнюють с0(А) та с0(Т), то їх концентрації у суміші дорівнюють
c(A) = c0(A) VA / V, (12.2a)
c(T) = c0(T) VT / V, (12.2b)
де індекс 0 відноситься до вихідних, ще не змішаних, розчинів. У главі 11 цей індекс був непотрібний, бо взаємне розведення не відігравало ролі у стехіометричних розрахунках. У формулах (12.1) та (12.2) використовуємо співвідношення (11.3), що тут набуває вигляду
VT, st = {VA c0(A) / A } / {c0(T) / T}. (12.3)
Формули (12.1) та (12.2) не підставляємо у (12.3) – навіщо громіздкі перетворення, коли досить здійснити послідовні розрахунки!
Значна частина проблем теорії використовує рівноважний склад сумішей, близьких до точки стехіометрії. Спрощуючи розрахунки, наближено вважатимемо, що об’єм, знаменник у формулах (12.2), однаковий в усіх сумішах – такий, як у точці стехіометрії.
Похибка титрування. Титруючи, реєструють не точку стехіометрії, а “кінцеву точку”. Розбіжність між ними спричиняє похибку. В околі точки стехіометрії характерною є мала буферність, і відхили в доданку титранту значно впливають на рівноважні концентрації. Так легше помітити пов’язану з ними зміну властивостей. Кінцеву точку визначають, спостерігаючи залежність між витратою титранту та властивостями, такими як світлопоглинання, потенціал електроду, електропровідність розчину тощо. Простим є візуальне спостереження за зміною кольору розчину, до якого додано невелику кількість індикатору.
Методичну складову похибки, спричиненої розбіжністю між кінцевою точкою титрування та точкою стехіометрії, пов’язують із різними величинами. Абсолютна похибка у кількості речовини та об’ємі титранту – це
n(T) = n(T) fin ‑ n(T) st, (12.4a)
VT = VT, fin ‑ VT, st, (12.4b)
де індекс fin відповідає кінцевій точці титрування.
Відносна похибка дорівнює відношенню абсолютної похибки до величини, що вимірюють,
= n(T) / n(T) st = VT / VT, st. (12.5)
Крива титрування – графік залежності деякої властивості суміші від кількості уведеного в цю суміш титранту. Як властивість (ординату кривої) часто використовують показник активності (чи рівноважної концентрації) одного з учасників реакцій – величину рХ, яку часто можливо виміряти. На вісь абсцис можна наносити різні шкали (або декілька шкал), такі як n (T), n (fT T), VT. При малій буферності відносно Х в околі точки стехіометрії (розділи 5.2 та 5.5) уже малі доданки реагентів змінюють [X] на декілька порядків (“стрибок” у титруванні).
Будуючи теоретичну криву, розраховують рівноважний склад сумішей. Зручною абсцисою є частка доданого титранту від того, що відповідає точці стехіометрії, безрозмірна відносна величина
= VT / VT st = n(T) / n st(T) = 1 + . (12.6)
Індикатори. У пошуку кінцевої точки простим сигналом є зміна забарвлення доданого індикатору. Надмірна його концентрація шкодить, бо незручно спостерігати за забарвленням, коли поглинається значна частина світла. Сприйняття забарвлення залежить і від освітлення (денне світло чи вольфрамова лампа). У довідниках подають інтервали рХ = ‑ lg [X], що відповідають зміні забарвлення індикаторів й охоплюють границю переважання їх форм. Якщо відсутні довідкові дані, вважають, що на кінцях інтервалу співвідношення концентрацій форм індикатору 1 : 10. Для кислотно-основних індикаторів, що приєднують чи втрачають іон Н+, границі інтервалу – це наближено рН = lg КН 1.
Підвищуючи точність індикації, забарвлення порівнюють із таким для “свідка” – розчину, що за складом імітує точку стехіометрії із індикатором. Інший спосіб – вживати змішаний індикатор. Це або суміш двох різних індикаторів, інтервали переходу яких перетинаються, або суміш індикатору з барвником, що не змінює забарвлення. Корисні суміші, компоненти яких у кінцевій точці мають додаткові кольори, світло рівномірно поглинається у всій видимій області, й забарвлення стає слабко сірим. Їх інтервал pХ звужується до 0,2. Приклад суміші індикатору й барвника – метиловий оранжевий й індигокармін, що в лужній області жовто-зелена, у кислій фіолетова, а при pH 4 сіра.
Приклад 12.1. Крива титрування сильної кислоти сильною основою.
Розв’язок. Реакція (11.1) тут –
H+ + OH‑ H2O.
Координати (, pH) точок кривої титрування при заданих c0(H+) та c0(OH‑) обчислюємо, як у прикладі 5.1. Величина , за співвідношенням (12.6), задає методичну складову похибки. На рис. 12.1 подано криву для однакових концентрацій, c0(OH‑) = c0(H+) = 0,20 моль/л, й
Vst(OH‑) = V(H+), Vst = V(H+) + Vst(OH‑) = 2 V(H+),
отже, у точці стехіометрії c(OH‑)st = c(H+)st = 0,10 моль/л. Пунктиром зображено результати розрахунку в наближенні, що об’єм суміші розчинів, V, є постійним – таким, як у точці стехіометрії,
t(H+) {c0(H+) VH – c0(OH‑) VOH} / (2 VH) =
= c0(H+) / 2 – c0(OH‑) VOH / (2 VH).
Перед точкою стехіометрії майже всюди справедливе наближення [H+] << [OH‑], після неї [H+] >> [OH‑], а в її околі (при 1) лишаємо обидва доданки, зводячи рівняння до квадратного за [H+] = 10‑pH.
Якщо аналітом є основа, а титрантом – кислота, то рівняння кривої відрізняється знаком перед дробом у середині низки рівностей та взаємною заміною c0(H+) на c0(OH‑). Крива є не зростаючою, а спадною.
Задачі теорії титриметрії:
(1) оцінити методичну складову похибки (12.5), що відповідає методові фіксації кінцевої точки;
(2) вибрати метод фіксації кінцевої точки, що забезпечує задані вимоги до методичної складової похибки.
Першу з них вирішують, не розраховуючи усієї кривої титрування. За методами глави 8 можна визначити витрату титранту для рХfin, пов’язаного зі зміною забарвлення індикатору «показника титрування».
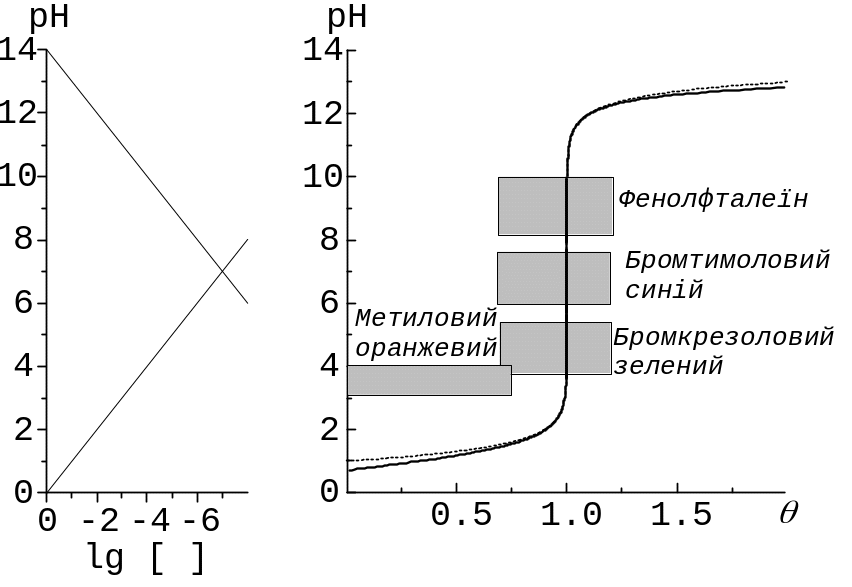
Рис. 12.1. Крива титрування сильної кислоти сильною основою при c0(H+) = c0(OH‑) = 0,20 моль/л. Пунктирний графік – у наближенні, де об’єм суміші розчинів є постійним, таким, як у точці стехіометрії. Ліворуч – КЛД з осями, що повернуті на 90o порівняно з традиційними (щоб сумістити осі pH). Заштриховано області зміни забарвлення індикаторів: метилового оранжевого (3,1 < pH < 4,0), бромфенолового зеленого (3,8 < pH < 5,4), бромтимолового синього (6,0 < pH 7,6), фенолфталеїну (8,2 < pH < 10,0).
Нехай у прикладі 12.1 рНfin = (3,1 + 4,0) / = 3,55 – на інтервалі переходу для метилового оранжевого. При = 1 маємо
[H+] = 10‑pH = 10‑3,55 = 2,810‑4 моль/л,
[OH‑] = ![]() = 10‑10,45 = 3,510‑11 моль/л,
[H+] ‑ [OH‑],
c(OH‑) = ‑ t(H+) = [OH‑] ‑ [H+] = ‑ 2,810‑4 моль/л.
= 10‑10,45 = 3,510‑11 моль/л,
[H+] ‑ [OH‑],
c(OH‑) = ‑ t(H+) = [OH‑] ‑ [H+] = ‑ 2,810‑4 моль/л.
Взаємне розведення розчинів дає c(OH‑)st = 0,10 моль/л, відносна похибка ‑
с(OH‑) / с(OH‑) st = ‑ 2,810‑4 / 0,10 = ‑ 2,810‑3 = ‑ 0,28 %.
Друга із задач – вибір умов індикації, якщо задано граничне значення похибки, наприклад, || 0,001. Величини с(Т) та – монотонні функції доданка титранту. На кінцях інтервалу ‑0,001 < < 0,001 у наближенні V = const прикладу 12.1 маємо t(H+) = 110‑4 моль/л та t(H+) = ‑ 110‑4 моль/л. Для першого з них нехтуємо у балансі доданком [OH‑],
[H+] = 10‑pH t(H+) = 110‑4 моль/л, pH ‑ lg t(H+) = 4,0.
Для другого із цих t(H+) нехтуємо доданком [H+], тоді
[OH‑] = ‑ t(H+) = 110‑4 моль/л,
pH + lg Kw lg {‑ t(H+)} = ‑ 4,0, pH = ‑ 4,0 + 14,0 = 10,0.
Знайдений інтервал 4,0 < рН < 10,0 на рис. 12.1 охоплює інтервали переходу для індикаторів бромтимолового синього (6,0 < pH < 7,6), фенолфталеїну (8,2 < pH < 10,0) і кінці інтервалів для метилового оранжевого (3,1 < pH < 4,0) та бромфенолового зеленого (3,8 < pH < 5,4).
Для теоретичних досліджень розроблено різні алгоритми. Їх автори часто спокушаються як аргумент у формулах похибок вживати похибку в рХ, спричинену індикацією,
pХ = рХfin ‑ рХst , (12.7)
і як крок 1 подають розрахунок рХst (наприклад, рНst). Типовою є формула для титрування слабкої основи сильною кислотою,
= (10 ‑ pH ‑ 10 pH) / {t(B) KH}1/2, (12.8)
де враховано найбільші рівноважні концентрації у рівнянні балансу. На кроці 2 за знаком pН визначають, нестачі чи надлишкові титранту відповідає кінцева точка. Нарешті за формулою (12.8) обчислюють .
Оцінюючи , стикаємось з проблемою похибки для малих pХ Теорію оцінок часто ускладнюють, поділяючи похибку на складові – систематичну та випадкову [11, с. 195]. У кислотно-основному титруванні середній квадратичний відхил рН прирівнюють 0,4 (за індикатором) та 0,2 (із застосуванням розчину “свідка”). Похибку перераховують на витрату титранту, множачи її на буферну ємність, та на 3 («правило 3 сiгма»). Загальна похибка – це, приблизно, більша із знайдених складових. На наш погляд, рХfin слід розглядати не як точне значення, а як інтервал. Випадкову складову окремо уводити не варто – досить узяти найбільшу із оцінок похибки на кінцях інтервалу. У формулах типу (12.8) обмежуємось більшим за абсолютною величиною доданком у чисельнику.
Більш наочно і просто в оцінках використовувати безпосередньо фрагменти КЛД. Якщо вжито приблизний ескіз цих фрагментів, то він допомагає швидко і легко вивести метод уточнення похибки розрахунком, що краще, ніж механічно і несвідомо застосовувати готові формули.
