- •Міністерство освіти і науки України Харківський національний університет імені в. Н. Каразіна Теоретичні основи та способи розв’язання задач з аналітичної хімії
- •Вступне слово
- •Основні позначення
- •1. Величини, що визначають склад
- •1.1. Хімічний склад
- •Розв’язок. Масова концентрація дорівнює
- •1.2. Стехіометричні розрахунки за рівнянням реакції
- •1.3. Вправи
- •2. Закон дії мас. Алгебра хімічних реакцій
- •2.1. Загальні співвідношення
- •2.2. Активності та рівноважні концентрації
- •Позначення констант рівноваг
- •2.3. Лінійні комбінації реакцій
- •2.4. У який бік зміщено рівновагу реакції?
- •2.5. Як записувати реакції у лабораторних журналах?
- •2.6. Вправи
- •3. Концентраційно-логарифмічні діаграми (клд)
- •3.1. Клд для гетерогенних систем
- •3.2. Графіки логарифмів розчинності
- •3.3. Вправи із гетерогенних систем
- •3.4. Умови переважання в гомогенних системах
- •3.5. Ускладнення у визначенні областей переважання
- •3.6. Клд для систем із одноядерними комплексами
- •3.7. Зміна ядерності реагентів
- •3.8. Вправи із гомогенних систем
- •4. Баланс компонентів
- •4.1. Загальні принципи
- •4.2. Підстановка рівнянь здм у рівняння балансу
- •4.3. Одноядерні продукти
- •4.4. Фази постійного складу
- •4.5. Вправи Гомогенні системи
- •5. Розрахунки за балансом компонентів
- •5.1. Буферні розчини
- •5.2. Стехіометричні співвідношення концентрацій
- •Кислотно-основні рівноваги
- •5.3. Ієрархія макро- та мікрокомпонентів
- •5.4. Гетерогенні системи
- •5.5. Кількісний вимір буферних властивостей
- •5.6. Вправи Буферні розчини
- •Стехіометричне співвідношення концентрацій
- •Гетерогенні системи
- •Буферні властивості
- •Системи із комплексами
- •6. Розрахунки за балансом реакції
- •6.1. Умови балансу
- •6.2. Прості розрахунки
- •Добуваючи квадратний корінь з обох частин, маємо
- •6.3. Методи розрахунків
- •6.4. Вправи
- •7. Умовні константи рівноваги
- •7.1. Класи реагентів
- •7.2. Умовні константи рівноваги
- •7.3. Умовні константи в розрахунках рівноваг
- •7.4. Графіки залежностей часток та їх логарифмів
- •7.5. Графіки логарифмів умовних констант
- •Параметри графіка залежності
- •7.6. Вправи
- •8. Декілька фаз змінного складу
- •8.1. Розподіл речовини між фазами
- •Відношення об’ємів порцій фаз дорівнює
- •Тангенси кутів нахилу асимптот для логарифма умовної константи екстракції оксинату плюмбуму від pH, приклад 8.4
- •8.2. Іонний обмін
- •8.3. Вправи
- •9. Утворення певної рівноважної концентрації, розчинності або ступеня екстракції
- •9.1. Метод балансу компонентів
- •На кроці 5 (непотрібному для уточнення клд) використовуємо
- •9.2. Метод балансу реакцій
- •9.3. Концентрація реагенту, що забезпечує задані умови для іншої речовини
- •9.4. Відокремлення компонентів Графічний розв’язок цієї проблеми показано на прикладі 3.3. Тут розгляньмо типові розрахункові методи.
- •9.5. Вибір величини умовної константи
- •9.6. Вправи
- •Варіанти завдання для вправи 9.1
- •10. Визначення компонентів. Гравіметрія
- •10.1. Стехіометричні співвідношення у гравіметрії
- •10.2. Розрахунок результату аналізу
- •10.3. Похибки у гравіметрії
- •10.4. Вправи
- •11. Титриметрія: стехіометричні розрахунки
- •11.1. Загальні відомості про титриметрію
- •11.2. Результат кислотно-основного титрування
- •Аліквотне відношення, {Vк/Vп}, безрозмірне, бо величини Vк та Vп виражено у однакових одиницях.
- •Виводячи формулу, маємо (у процентах)
- •11.3. Визначення концентрації розчину титранту за титруванням зразкової речовини
- •Для еквівалентів коефіцієнти вживаємо неявно,
- •Стехіометричний множник 2 приховуємо, застосовуючи еквівалент, (1/2)h2c2o4, або (1/2)h2c2o4·2h2o.
- •11.4. Оцінка наважок та аліквот
- •Бюретці відповідає оптимальна витрата титранту 20 мл, отже nst(oh‑) 2·10‑3 моль, n(н2с4н4о4) nst(oh‑) / 2 1·10‑3 моль.
- •11.5. Окреме визначення декількох аналітів
- •За двома рівняннями,
- •11.6. Зворотне титрування
- •Титруванню надлишку реагенту відповідає реакція
- •Дія 4. Масова частка CaCo3(s) у мінералі дорівнює
- •11.7. Визначення продукту, в який перетворено аналіт
- •Бо при зворотному титруванні здобутий po43‑ знову переходить у hpo42‑. Надлишок реагенту титруємо за реакцією
- •Дія 5. Масова частка p2o5 у мінералі дорівнює
- •11.8. Окисно-відновне титрування
- •11.9. Комплексометричне титрування
- •Дія 4. Масова частка kAl(so4)2 12 h2o у технічному галуні ‑
- •11.10. Вправи
- •Окисно-відновне титрування
- •Комплексонометричне титрування
- •12. Титриметрія: розбіжність точок –стехіометрії та кінцевої
- •12.1. Загальні уявлення
- •12.2. Дослідження титрування безпосередньо за клд
- •12.3. Різні методи титрування
- •12.4. Класи та умовні константи у титруванні
- •12.5. Вибір умов титрування за графіками залежностей логарифмів умовних констант
- •Параметри асимптот для прикладу 12.10
- •Із здм реакції
- •Параметри асимптот графіків (приклад 12.11)
- •Параметри асимптот графіків (приклад 12.12)
- •12.6. Вправи
- •Кислотно-основне титрування
- •Окисно-відновне титрування
- •Комплексонометричне титрування
- •Теоретичні проблеми титрування
- •Цитована література
- •Відповіді до вправ
- •61077, М.Харків, пл. Свободи, 4 Харківський національний університет ім. В.Н. Каразіна, Організаційно-видавничий відділ нмц
7.5. Графіки логарифмів умовних констант
Вплив частки одного реагенту. Якщо лише частка r(Aj| L) одного з учасників реакції, Aj, відрізняється від 1, то графік логарифма умовної константи зміщено на lg K за ординатою на |j| lg r(Aj| L), де j – відповідний стехіометричний коєфіцієнт при продуктові розчинення, Aj. Почнімо з прикладів «показників» добутку розчинності, pKs = ‑ lg Ks .
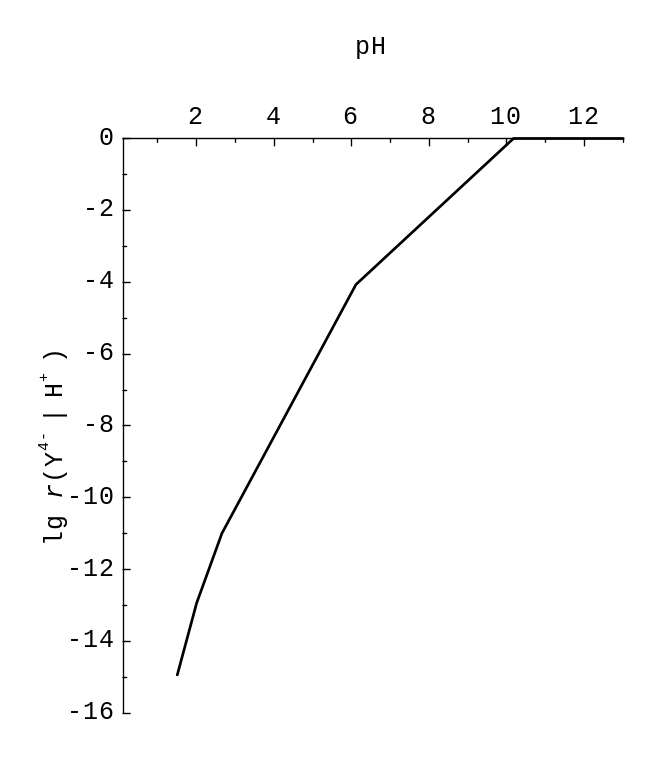 Рис.
7.5. Залежність від рН частки іона
етилендіамінтетраацетату, Y4‑.
Спряження не проведенi.
Рис.
7.5. Залежність від рН частки іона
етилендіамінтетраацетату, Y4‑.
Спряження не проведенi.
Таблиця 7.3
Параметри графіка залежності lg r(Y4‑) від pH (приклад 7.14)
рН |
Тангенс кута нахилу |
Ордината кінця інтервалу |
|
від |
до |
||
… |
1,5 |
5 |
-14,93 |
1,5 |
2,0 |
4 |
-12,93 |
2,0 |
2,65 |
3 |
-10,99 |
2,65 |
6,11 |
2 |
-4,06 |
6,11 |
10,17 |
1 |
0 |
10,17 |
… |
0 |
0 |
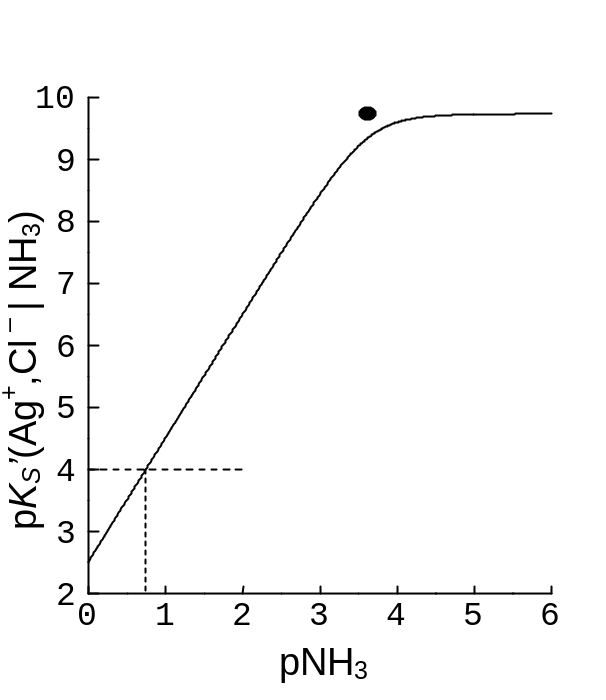
Приклад 7.15. Залежності показників умовних добутків розчинності AgCl(s) та Ag2CrO4(s) від pNH3.
Розв’язок. У реакціях AgCl(s) Ag+ + Cl‑, lg Ks = ‑ 9,74, Ag2CrO4(s) 2 Ag+ + CrO42‑, lg Ks = ‑ 11,56,
лише один продукт – іон Ag+ – реагує з NH3, отже
pKs’ (Ag+, Cl‑ | NH3) = pKs(Ag+, Cl‑) + lg r(Ag+[ NH3), pKs’ (2 Ag+, CrO42‑ | NH3) = pKs(2 Ag+, CrO42‑) + 2 lg r(Ag+| NH3).
Залежність r(Ag+| NH3) від pNH3 розглянуто у прикладі 7.10. Графік pKs(Ag+, Cl‑), рис. 7.6, починаємо з горизонтальної асимптоти, де r(Ag+| NH3) 1, а ордината дорівнює pKs(Ag+, Cl‑). Лівіше за ТС, при pNH3 < (lg 2) / 2 = 3,61, як і на КЛД, наближений графік переходить у промінь із тангенсом кута нахилу (‑ 2). Гілки графіка з’єднуємо спряженням, на lg 3 0,5 нижчим за точку перетину лінійних відрізків прямих, бо у ТС є близькими рівноважні концентрації трьох представників класу {Ag+| NH3}.
|
|
Рис. 7.6. Залежність показників умовних добутків розчинності AgCl(s) – графік ліворуч, та Ag2CrO4(s) – графік праворуч – від pNH3. Жирні точки – перетин асимптот графіка (приклад 7.15). Пунктири – графічний розв’язок прикладу 9.13 (глава 9).
Коефіцієнт при Ag+ у реакції, що відповідає графікові pKs’(2 Ag+, CrO42‑), дорівнює 2, і лівіше за ТС наближений графік переходить у промінь із подвоєним тангенсом кута нахилу, (‑ 4). Спряження гілок відхиляється від точки перетину промінів на величину 2 lg 3 1,0.
Приклад 7.16. Залежність показника умовного добутку розчинності KH(C4H4O6)(s) від pH.
Розв’язок. У реакції
KH(C4H4O6)(s) K+ + H(C4H4O6)‑, lg Ks = ‑ 2,9,
тільки іон H(C4H4O6)‑, або HL‑ – реагує з H+ (для L2‑: маємо lg KH1 = 4,4, lg KH2 = 3,0), отже
pKs’(K+, HL‑| H+) = pKs(K+, HL‑) + lg r(HL‑| H+).
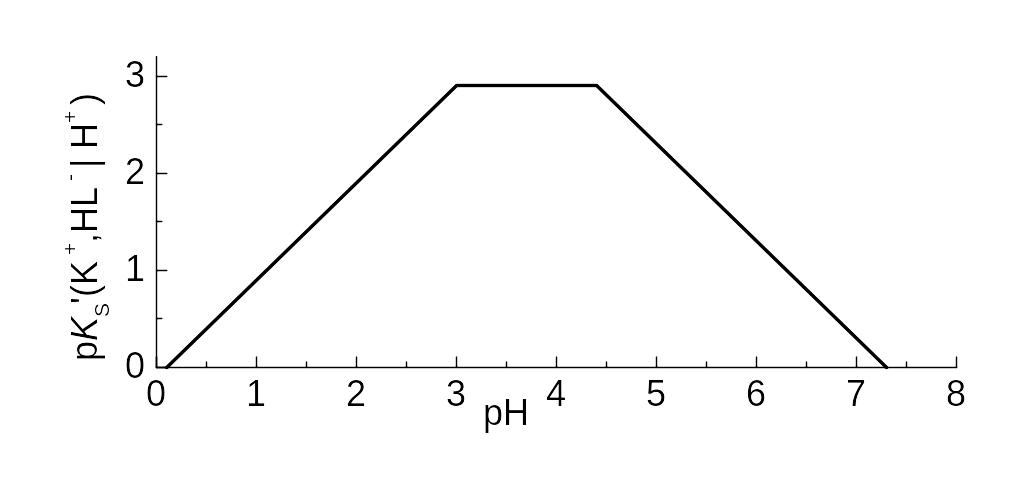
Рис. 7.7. Залежність показника умовного добутку розчинності гідротартрату калію, KHL(s), від pH.
Графік pKs’(K+, HL‑| H+), рис. 7.7, починаємо із горизонтальної ділянки з ординатою pKs(K+, HL‑), де переважає HL‑, при 3,0 < pH < 4,8. По обидва боки від неї склад частинки, що переважає, змінюється на 1 координований іон H+, й горизонтальна ділянка при pH = 3,0 та при pH = 4,4 переходить у похилі із тангенсами ±1. Спряження (на рис. 7.7 не проведені) – нижче за точки перетину лінійних гілок графіка на lg 2 0,3.
Приклад 7.17. Залежність логарифма умовної константи стійкості комплексу Mg2+ із аніоном етилендіамінтетраоцтової кислоти, Y4‑, від рН.
Розв’язок. Серед учасників реакції
Mg2+ + Y4‑ MgY2‑, lg = 8,83 [I = 0,1, 20oC],
лише Y4‑ в середній області pH помітно піддається кислотно-основним перетворенням, де наближено
lg ’( | H+) = lg + lg r(Y4‑| H+).
Графік рис. 7.8 відрізняється від наведеного на рис. 7.5 графіка lg r(Y4‑| H+) зміщенням за ординатою на lg .
У далекій кислій області є істотною протонізація
H+ + MgY2‑ MgHY‑, lg KH = 3,85, [I = 0,1, 20oC],
а у далекій лужній – утворення гідроксокомплексів Mg2+ (lg K = 2,55) [I = 0]. Там графік lg ’( | H+) потребує уточнення. На рис. 7.8 ці уточнення й спряження не враховано.
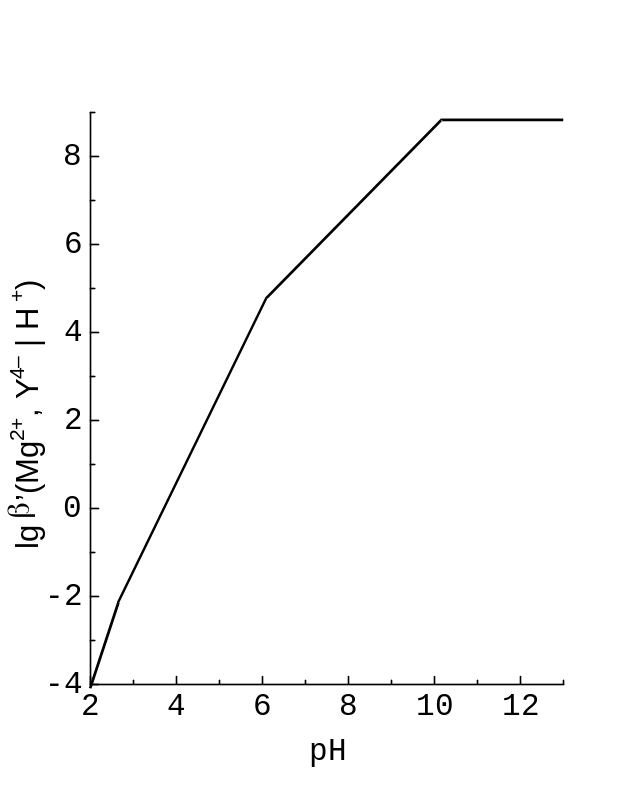
Рис. 7.8. Залежність логарифма умовної константи стійкості комплексу Mg(II) з EDTA від pH.
Загальний випадок. Для реакції (2.1) залежність логарифма умовної константи, lg K’( | L), від pL визначають залежності логарифмів часток й внесок (L pL):
pKs’ ( | L) = pKs + j lg r(Aj| L) ‑ L pL.
Вплив різних доданків на тангенси кутів нахилу сумуємо. Це врахуємо в алгоритмі побудови графіка залежності:
1. Обчислити значення головної змінної на границях областей переважання в класах для учасників реакції.
2. Знайти tg j = tg (Aj) – тангенси кутів нахилу наближених графіків lg r(Aj| L), що дорівнюють різницям стехіометричних індексів при L для частинки, що переважає у відповідній області, та Aj. Для Aj = L тангенс прийняти рівним (‑ 1).
3. Для відрізків осі pL між сусідніми границями областей переважання (з кроку 1) обчислити тангенс кута нахилу наближеного графіка
tg = ‑ j tg j.
4. Вибрати значення абсциси pL й обчислити відповідне значення наближеної ординати lg K’. Відкласти цю точку на наближеному графіку. Щоб зручніше оцінювати координати цієї точки, доцільно:
(a) Якщо є стаціонарна область у наближених значеннях lg K’, із tg = 0, то вибрати pL у цій області. Інакше вибрати pL у межах будь-якої спільної області переважання реагентів.
(b) Щоб спростити розрахунок ординати lg K’, використати реакцію між переважаючими учасниками, обчислити її lg K, склавши лінійну комбінацію реакцій, і оцінити lg K’ за цією lg K, вважаючи, що для переважаючих реагентів lg r(Aj| L) = 0. Нагадуємо, що, як показано у розділі 7.2, lg K’ не залежить від вибору представників класів.
5. Починаючи з відкладеної точки, провести неперервну ламану з тангенсами кутів нахилу, обчислених на кроці 3, та зі зломами на границях областей переважання.
6. Замінити зломи плавними спряженнями, що відхиляються на (‑ l ) від точки злому, де – відхил, визначений у п. 5 алгоритму побудови КЛД (розділ 3.6).
У багатьох застосуваннях графіків уточнювати ламані плавними спряженнями (крок 6) не потрібно.
Приклад 7.18. Залежність реального потенціалу системи As(III) – As(V) від pH.
Розв’язок. Розглядувана напівреакція —
(1/2) H3AsO4 + H+ + e‑ (1/2) As(OH)3 + (1/2) H2O,
lg K’ ( | H+) = Ереал / =
= lg K ‑ (1/2) lg r(As(OH)3| H+) + (1/2) lg r(H3AsO4| H+) ‑ pH,
де lg K = (1/2) lg K53 = 9,45 (дивись приклад 7.3).
На осі ординат рис. 7.9 – дві шкали, lg K’ та ’ = Ереал. На кроці 1 визначаємо границі областей переважання у класах для учасників напівреакції. Це логарифми ступінчатих констант продуктів AsO43‑, lg KH1 = 11,5, lg KH2 = 6,9, lg KH3 = 2,2 (приклад 7.4), та As(OH)4‑, lg KH = 9,2.
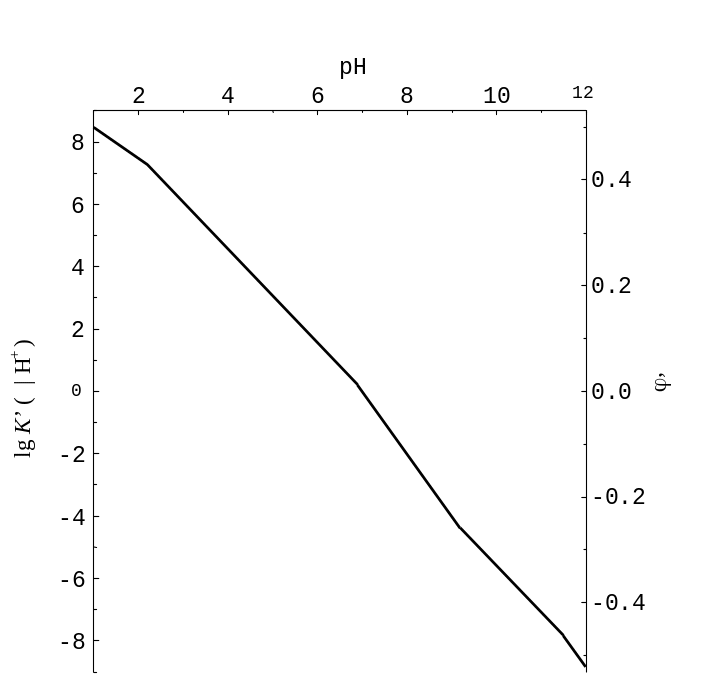 Рис. 7.9.
Залежність від рН логарифма умовної
константи напівреакції
(1/2) H3AsO4 + H+ + e‑ (1/2) As(OH)3 + (1/2) H2O.
Рис. 7.9.
Залежність від рН логарифма умовної
константи напівреакції
(1/2) H3AsO4 + H+ + e‑ (1/2) As(OH)3 + (1/2) H2O.
Тангенси кутів нахилу наближених графіків (крок 2) дорівнюють різницям стехіометричних індексів при H+ у хімічних формулах частинок, що переважають у відповідних областях, тобто 0 для H3AsO4, (– 1) для H2AsO4‑, (– 2) для HAsO42‑, (– 3) для AsO43‑. Тангенс дорівнює 0 для As(OH)3 та 1 для As(OH)4‑ – коефіцієнтові при H+ у реакції As(OH)3 + H2O As(OH)4‑ + H+.
На кроці 3 обчислюємо tg . Кроки 1-3 зведено у табл. 7.4. Координати точки (крок 4) обчислюємо для абсциси pH = 0, де переважають реагенти, що беруть участь у вихідній напівреакції, й lg K’ практично дорівнює логарифмові константи напівреакції, lg K 9,45. На кроці 5 продовжуємо графік (нахили з табл. 7.4). Спряження лінійних гілок (крок 6) не наведено. Враховуючи стехіометричні коефіцієнти, вони мали б відхилятися від зломів на 0,3 / 2 = 0,15. Для реакції iз участю 2e‑ константа дорівнює (K’)2.
Таблиця 7.4
Параметри графіка залежності від pH для lg K’( | H+) для напівреакції відновлення As(V) до As(III)
pH |
(1/2) tg As(V)) |
(1/2) tg As(III)) |
- tg H+) |
tg |
Ордината кінця інтервалу |
|
Від |
До |
|||||
… |
… |
0 |
0 |
-1 |
-1 |
9,45 (pH = 0) |
… |
… |
0 |
0 |
-1 |
-1 |
8,45 (pH = 1) |
… |
2,2 |
0 |
0 |
-1 |
-1 |
7,25 |
2,2 |
6,9 |
-0,5 |
0 |
-1 |
-1,5 |
0,20 |
6,9 |
9,2 |
-1 |
0 |
-1 |
-2 |
-4,40 |
9,2 |
11,5 |
-1 |
0,5 |
-1 |
-1,5 |
-7,85 |
11,5 |
… |
-1,5 |
0,5 |
-1 |
-2 |
-8,85 (pH=12) |
Стаціонарна область на наближеному графіку, де tg = 0 й логарифм умовної константи є логарифмом «звичайної» константи для реакції між переважаючими частинками. На кроці 4 будуємо не точку, а горизонтальний відрізок.
Якщо знаки tg праворуч та ліворуч від області є різними, то стаціонарним точкам відповідає екстремум.
Приклад 7.19. Залежність «показника» умовного добутку розчинності MgNH4PO4(s) від pH.
Розв’язок. У прикладі 7.5 обчислено умовний добуток розчинності при pH = 11,6. Обговорювана реакція –
MgNH4PO4(s) Mg2+ + NH4+ + PO43‑, lg Ks = ‑ 12,6.
Крок 1. рН границь областей переважання представників класів наведені у прикладі 7.5.
Крок 2. Тангенси кутів нахилу наближених графіків логарифмів часток – це різниці стехіометричних індексів при H+ у формулах Мg2+, NH4+ та PO43‑ та частинок, що переважають у відповідних областях pH (табл. 7.5).
Крок 3. Тангенси кутів нахилу наближеного графіка дорівнюють
tg = tg (Mg2+) + tg (NH4+) + tg (PO43‑).
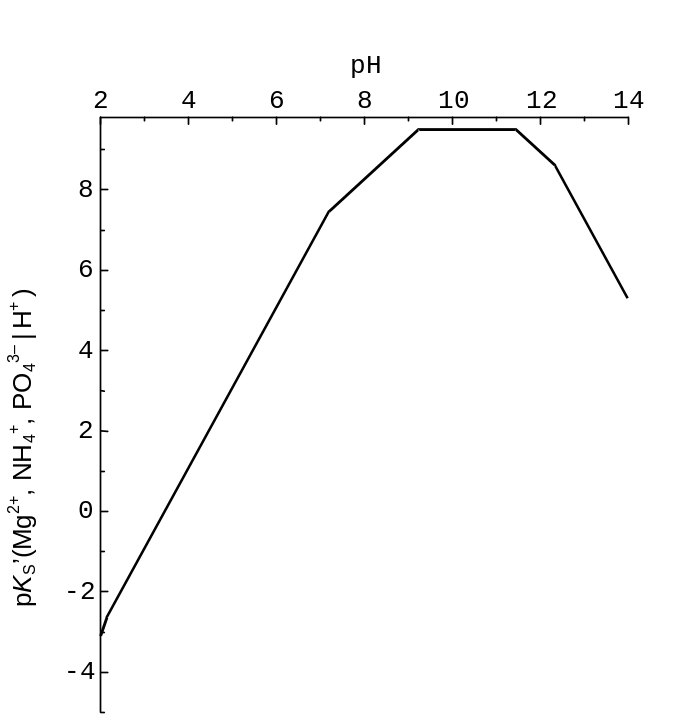
Рис. 7.10. Залежність «показника» умовного добутку розчинності MgNH4PO4(s) від pH.
Крок 4. Горизонтальний відрізок – стаціонарна область, 9,24 < pH < 11,45, ордината – логарифм константи лінійної комбінації,
1 |
MgNH4PO4(s) |
Mg2+ + NH4+ + PO43‑ |
lg Ks = ‑ 12,6 |
1 |
H+ + PO43‑ |
HPO42‑ |
lg Ka = ‑ 9,24 |
1 |
NH4+ |
NH3 + H+ |
lg KH1 = 12,35 |
MgNH4PO4(s) |
Mg2+ + NH3 + HPO42‑ |
lg K = ‑ 9,49 |
|
Крок 5. Будуємо похилі по обидва боки від горизонтального відрізка, точки злому та tg наведено у табл. 7.5. Спряження (крок 6, на рис. 7.11 не проведені) лежали би нижче за зломи на lg 2 0,3.
Таблиця 7.5