- •Міністерство освіти і науки України Харківський національний університет імені в. Н. Каразіна Теоретичні основи та способи розв’язання задач з аналітичної хімії
- •Вступне слово
- •Основні позначення
- •1. Величини, що визначають склад
- •1.1. Хімічний склад
- •Розв’язок. Масова концентрація дорівнює
- •1.2. Стехіометричні розрахунки за рівнянням реакції
- •1.3. Вправи
- •2. Закон дії мас. Алгебра хімічних реакцій
- •2.1. Загальні співвідношення
- •2.2. Активності та рівноважні концентрації
- •Позначення констант рівноваг
- •2.3. Лінійні комбінації реакцій
- •2.4. У який бік зміщено рівновагу реакції?
- •2.5. Як записувати реакції у лабораторних журналах?
- •2.6. Вправи
- •3. Концентраційно-логарифмічні діаграми (клд)
- •3.1. Клд для гетерогенних систем
- •3.2. Графіки логарифмів розчинності
- •3.3. Вправи із гетерогенних систем
- •3.4. Умови переважання в гомогенних системах
- •3.5. Ускладнення у визначенні областей переважання
- •3.6. Клд для систем із одноядерними комплексами
- •3.7. Зміна ядерності реагентів
- •3.8. Вправи із гомогенних систем
- •4. Баланс компонентів
- •4.1. Загальні принципи
- •4.2. Підстановка рівнянь здм у рівняння балансу
- •4.3. Одноядерні продукти
- •4.4. Фази постійного складу
- •4.5. Вправи Гомогенні системи
- •5. Розрахунки за балансом компонентів
- •5.1. Буферні розчини
- •5.2. Стехіометричні співвідношення концентрацій
- •Кислотно-основні рівноваги
- •5.3. Ієрархія макро- та мікрокомпонентів
- •5.4. Гетерогенні системи
- •5.5. Кількісний вимір буферних властивостей
- •5.6. Вправи Буферні розчини
- •Стехіометричне співвідношення концентрацій
- •Гетерогенні системи
- •Буферні властивості
- •Системи із комплексами
- •6. Розрахунки за балансом реакції
- •6.1. Умови балансу
- •6.2. Прості розрахунки
- •Добуваючи квадратний корінь з обох частин, маємо
- •6.3. Методи розрахунків
- •6.4. Вправи
- •7. Умовні константи рівноваги
- •7.1. Класи реагентів
- •7.2. Умовні константи рівноваги
- •7.3. Умовні константи в розрахунках рівноваг
- •7.4. Графіки залежностей часток та їх логарифмів
- •7.5. Графіки логарифмів умовних констант
- •Параметри графіка залежності
- •7.6. Вправи
- •8. Декілька фаз змінного складу
- •8.1. Розподіл речовини між фазами
- •Відношення об’ємів порцій фаз дорівнює
- •Тангенси кутів нахилу асимптот для логарифма умовної константи екстракції оксинату плюмбуму від pH, приклад 8.4
- •8.2. Іонний обмін
- •8.3. Вправи
- •9. Утворення певної рівноважної концентрації, розчинності або ступеня екстракції
- •9.1. Метод балансу компонентів
- •На кроці 5 (непотрібному для уточнення клд) використовуємо
- •9.2. Метод балансу реакцій
- •9.3. Концентрація реагенту, що забезпечує задані умови для іншої речовини
- •9.4. Відокремлення компонентів Графічний розв’язок цієї проблеми показано на прикладі 3.3. Тут розгляньмо типові розрахункові методи.
- •9.5. Вибір величини умовної константи
- •9.6. Вправи
- •Варіанти завдання для вправи 9.1
- •10. Визначення компонентів. Гравіметрія
- •10.1. Стехіометричні співвідношення у гравіметрії
- •10.2. Розрахунок результату аналізу
- •10.3. Похибки у гравіметрії
- •10.4. Вправи
- •11. Титриметрія: стехіометричні розрахунки
- •11.1. Загальні відомості про титриметрію
- •11.2. Результат кислотно-основного титрування
- •Аліквотне відношення, {Vк/Vп}, безрозмірне, бо величини Vк та Vп виражено у однакових одиницях.
- •Виводячи формулу, маємо (у процентах)
- •11.3. Визначення концентрації розчину титранту за титруванням зразкової речовини
- •Для еквівалентів коефіцієнти вживаємо неявно,
- •Стехіометричний множник 2 приховуємо, застосовуючи еквівалент, (1/2)h2c2o4, або (1/2)h2c2o4·2h2o.
- •11.4. Оцінка наважок та аліквот
- •Бюретці відповідає оптимальна витрата титранту 20 мл, отже nst(oh‑) 2·10‑3 моль, n(н2с4н4о4) nst(oh‑) / 2 1·10‑3 моль.
- •11.5. Окреме визначення декількох аналітів
- •За двома рівняннями,
- •11.6. Зворотне титрування
- •Титруванню надлишку реагенту відповідає реакція
- •Дія 4. Масова частка CaCo3(s) у мінералі дорівнює
- •11.7. Визначення продукту, в який перетворено аналіт
- •Бо при зворотному титруванні здобутий po43‑ знову переходить у hpo42‑. Надлишок реагенту титруємо за реакцією
- •Дія 5. Масова частка p2o5 у мінералі дорівнює
- •11.8. Окисно-відновне титрування
- •11.9. Комплексометричне титрування
- •Дія 4. Масова частка kAl(so4)2 12 h2o у технічному галуні ‑
- •11.10. Вправи
- •Окисно-відновне титрування
- •Комплексонометричне титрування
- •12. Титриметрія: розбіжність точок –стехіометрії та кінцевої
- •12.1. Загальні уявлення
- •12.2. Дослідження титрування безпосередньо за клд
- •12.3. Різні методи титрування
- •12.4. Класи та умовні константи у титруванні
- •12.5. Вибір умов титрування за графіками залежностей логарифмів умовних констант
- •Параметри асимптот для прикладу 12.10
- •Із здм реакції
- •Параметри асимптот графіків (приклад 12.11)
- •Параметри асимптот графіків (приклад 12.12)
- •12.6. Вправи
- •Кислотно-основне титрування
- •Окисно-відновне титрування
- •Комплексонометричне титрування
- •Теоретичні проблеми титрування
- •Цитована література
- •Відповіді до вправ
- •61077, М.Харків, пл. Свободи, 4 Харківський національний університет ім. В.Н. Каразіна, Організаційно-видавничий відділ нмц
3.5. Ускладнення у визначенні областей переважання
Нормальна й аномальна послідовність констант. Якщо послідовність усіх N ступінчатих констант спадна,
K1 > K2 > . . . > KN,
то у всіх N + 1 реагентів існують області переважання, із границями pL = lg Ki. Якщо ж Ki < Ki+1 (аномальна послідовність), то MLi ніде не переважає. Для сусідніх областей переважання MLi і MLi+j (j > 1):
MLi + j L MLi+j, lg K = lg i+j ‑ lg i = lg Ki+1 + lg Ki+2 + . . . + lg Ki+j,
де lg 0 = 0, і, згідно ЗДМ,
lg ([MLi+j] / [MLi]) = lg K ‑ j pL.
Границя областей переважання, [MLi+j] = [MLi] при pL = (lg K) / j, дорівнює середньому від логарифмів констант.
Приклад 3.6. Комплекси Ag+ із NH3.
Розв’язок. Тут lg K1 = 3,31, lg K2 = 3,91, K1 < K2, отже, послідовність констант є аномальною. На допоміжній смузі схеми косим штрихом (\\\ або ///) позначено області, де над AgNH3+ переважають інші комплекси.
Ag(NH3)2+ | Ag+ 0 | 2 | 4 | 6 | pNH3 |
//////////////////////////////////|χχ|χχ|\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\ |
При pNH3 > lg K1 = 3,31 маємо [AgNH3+] < [Ag+], а при pNH3 < lg K2 = 3,91 маємо [AgNH3+] < [Ag(NH3)2+]. Ці області перекриваються. У AgNH3+, проміжного комплексу, немає області переважання. Реагенти із областями переважання взаємно перетворюються за реакцією
Ag+ + 2NH3 Ag(NH3)2+, lg 2 = lg K1 + lg K2 = 7,22.
Із ЗОМ маємо координату границі областей [Ag+] = [Ag(NH3)2+],
pNH3 = lg K = (lg 2) / 2 = 3,61.
Окисно-відновні рівноваги розглядаємо на осі ре аналогічно реакціям без проміжних ступеней, якщо у напівреакції витрачається більше за 1 e‑. Напівреакції, у якій беруть участь еквіваленти, відповідає границя
(lg K) / e = ‑ k E0.
Для багатьох напівреакцій такий простий підхід непридатний, бо у них, крім окисненої та відновленої форм, беруть участь H+ чи OH‑, ліганди, або змінюється ядерність.
Алгоритм побудови областей переважання:
1. Знайти та нанести на вісь pL границі областей переважання. Для спадної послідовності ступінчатих констант стійкості значення pL на границях дорівнюють lg Ki. Якщо таку послідовність порушено (вона є аномальною), то проміжні комплекси ніде не переважають. Границя для комплексів, найближчих за складом до ніде не переважаючих, дорівнює середньому арифметичному логарифмів ступінчатих констант аномальної послідовності.
2. До комплексу МLі із найменшим числом координованих лігандів L (і = 0 для вільного М) віднести праву область; комплексам із зростаючим числом лігандів – області, що послідовно розташовані справа наліво; пропускаємо комплекси, що ніде не переважають.
3.6. Клд для систем із одноядерними комплексами
Крім головної змінної pX = pL (або pH чи pe), у гомогенних реакціях міняємо принаймні 2 інших змінних, логарифмів рівноважних концентрацій. Якщо більшість M перетворилася у переважаючий продукт MLi, то одна із залежних змінних є майже постійною, lg [MLі] lg t(M), де t(M) – загальна концентрація компонента M. Графік іншої змінної стає наближено лінійним. Умови наближення виконуються тим краще, чим глибше ми в області переважання MLі. В областях для різних MLк різними є наближені лінійні графіки lg [MLі], й увесь наближений графік є ламаною.
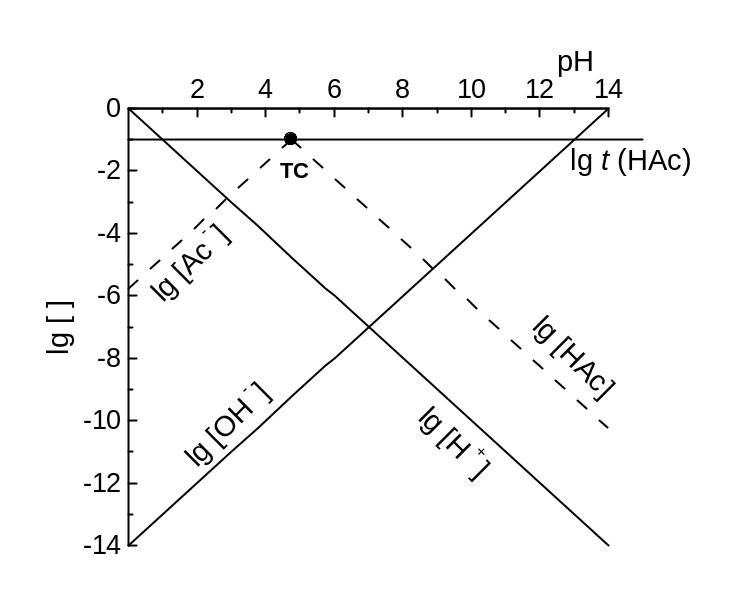
Приклад 3.7. КЛД для кислотно-основних перетворень ацетату, t(HAc) = t = 0,10 моль/л.
Розв’язок. Якщо pH < lg KН = 4,76, то HAc переважає, і ми вдаємося до наближення [HAc] t(Ac‑) = t. Тут наближений графік на КЛД – горизонтальний промінь (асимптота) lg [HAc] lg t від - до так званої точки системи (ТС), із абсцисою lg KН , границею областей переважання. У свою чергу, правіше за ТС переважає Ac‑, і ми вдаємося до наближення [Ac‑] t = 0,10 моль/л. Шукаючи рівняння для lg [HAc], розгляньмо реакцію і вираз ЗДМ для неї, H+ + Ac- HAc, lg [HAc] = lg KН + lg [Ac-] - pH lg KН + lg t – pH. При pH = lg KН маємо lg [HAc] lg t, і асимптота проходить через ТС як промінь вниз під кутом 45о (тангенс ‑1). Знак тангенса такий, що lg [HAc] зменшується, віддаляючись від ТС, бо графік не перевищує горизонтальної асимптоти – максимуму функції! КЛД (рис. 3.4а) доповнено графіком lg [H+], що йде через початок координат, та графіком lg [OH‑], що йде через точку (pH = ‑ lg Kw, 0). Тангенси для цих графіків відповідно дорівнюють (‑1) й 1.
На уточненому графіку зломи замінюємо плавними спряженнями. На границі областей, де найбільше порушуються наближення lg [HAc] lg t або lg [Ac‑] lg t, речовину із загальною концентрацією t поділено навпіл між НАс та Ac‑,
[HAc] = [Ac‑] = t / 2, lg [HAc] = lg [Ac‑] = lg t ‑ lg 2,
і згладжені графіки перетинаються на lg 2 0,3 нижче за ТС (рис. 3.4б).
Аналогічно розглядаємо асимптоти для графіка lg [Ac‑]. Тут горизонтальна асимптота – при pH > lg KН = 4,76, правіше за ТС, а лівіше за ТС йде асимптота вниз під кутом 45о (тангенс +1).
Алгоритм побудови КЛД для систем із одноядерними продуктами. У простих випадках реакції та ЗДМ можна не записувати. Тангенс кута нахилу є різницею стехіометричних індексів при X у формулах двох частинок – тієї, що відповідає графікові, й переважаючої у відповідній області. Так, у прикладі 3.7, там, де HAc переважає, lg [HAc] горизонтальний, а там, де Ac‑ переважає, тангенс за абсолютною величиною дорівнює 1 (Ac‑ відрізняється від HAc на 1 H+).
Якщо маємо більше двох областей переважання, для кожної – інше наближене рівняння, пов’язане із ЗДМ реакції перетворення продукту MLі, що переважає, у MLk, графік якого досліджуємо,
|
a |
|
b |
Рис. 3.4. КЛД для перетворень ацетату, t(HAc) = t = 0,10 моль/л: (a) ескіз перед побудовою спряжень; (b) КЛД. |
|
MLi + (k ‑ i) L MLk, lg k - lg i.
lg [MLk] = (lg k ‑ lg i) + lg [MLi] + (i ‑ k) pL
(lg k ‑ lg i) + lg t(M) + (i ‑ k) pL .
Щоб координати точок перетину відрізків не знаходити із рівнянь, зауважмо, що функція неперервна, а графік наближеної функції – ламана зі зломами на границях областей переважання. Почнімо його із горизонтального відрізка між ТС й продовжимо похилими в інші області переважання. Отже, алгоритм побудови КЛД:
1. Обчислити значення головної змінної pL на границях областей переважання окремих частинок.
2. Нанести на діаграму точки системи (ТС) із абсцисами, що обчислені на кроці 1, і ординатою lg t(M).
3. Наближений графік lg [MLk] почати із відрізка з кінцями у ТС на границях області переважання MLk; для частинки без області переважання – із ТС на границі областей переважання частинок, найближчих за складом до розглядуваної.
4. Графік продовжити в область переважання MLі ламаною. Тангенс кута нахилу її відрізків дорівнює (i - k), різниці стехіометричних індексів при L для частинки MLі, що переважає у відповідній області, та MLk. Кінці – на границях областей (під ТС).
5. Якщо точність графіків у околі ТС недостатня для розгляданої проблеми, то замінити зломи плавними спряженнями, точка перетину яких відхиляється від злому за ординатою на = ‑ lg j, де j – число сортів частинок, концентрації яких великі й майже рівні у ТС.
Алгоритм зручніший, ніж для гетерогенних систем. Графіки для найбільших концентрацій – горизонтальні відрізки та похилі, що безпосередньо від них відходять, відтворюємо (навіть в уяві!) за ступінчатими константами. Вирішуючи більшість проблем, обмежуємось найбільшими концентраціями, інформація про які міститься у верхній частині КЛД, і не проводимо спряжень, опускаючи 5-й крок.
Приклад 3.8. КЛД для Н2С2О4, t(Н2С2О4) = t = 0,10 моль/л, головна змінна pH.
Розв’язок. Для Н+ та С2О42‑ логарифми ступінчатих констант стійкості дорівнюють: lg KH1 = 4,266, lg KH2 = 1,256 [I = 0]. Це рН границь областей переважання (крок 1). На кроці 2 наносимо 2 ТС із округленими значеннями координат (1,3, ‑1) та (4,3, ‑1), де ордината lg t = ‑1. На кроці 3 будуємо наближені графіки. Графік lg [Н2С2О4] починаємо із горизонтального променя (ордината –1), від ‑ до лівої ТС, графік lg [НС2О4‑] – із відрізка між ТС, а lg [С2О42‑] – із променя від правої ТС на +. На кроці 4 продовжуємо графік lg [Н2С2О4] праворуч відрізком із тангенсом кута нахилу (‑1), бо в сусідній області переважає іон НС2О4‑, що відрізняється від Н2С2О4 на іон Н+. Напрямок ухилу є очевидним, бо графік порівняно із горизонтальним відрізком може лише спадати. Після правої ТС переважає С2О42‑, й графік продовжуємо променем із тангенсом кута нахилу (‑2). Аналогічно будуємо похилі ділянки графіків lg [НС2О4‑] та lg [С2О42‑], тут уже наявні ділянки зростання функцій. На кроці 5 спрягаємо зломи (рис. 3.5).
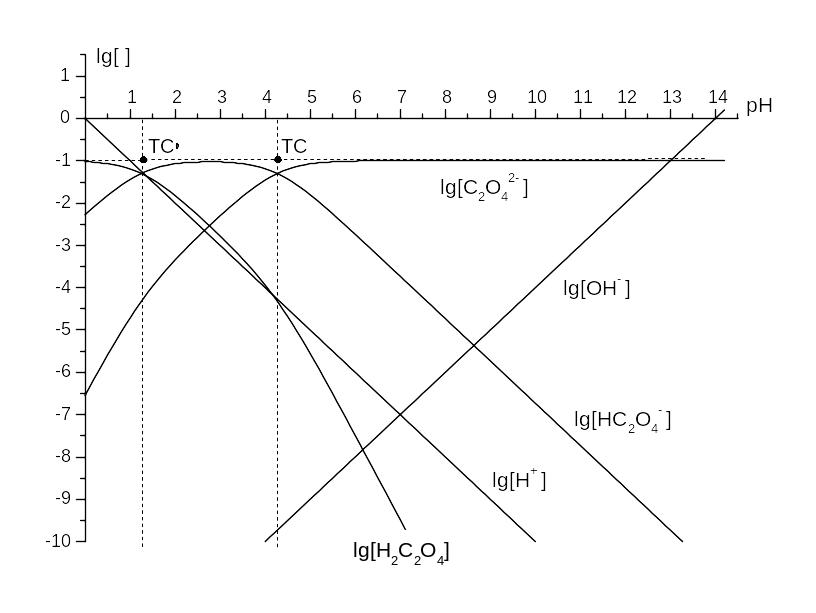
Рис. 3.5. КЛД для кислотно-основних перетворень оксалату, t(H2С2О4) = t = 0,10 моль/л.
Приклад 3.9. КЛД для Ag(I), t(Ag+) = t = 0,10 моль/л, головна змінна pNH3.
Розв’язок. За прикладом 3.6, лише Ag+ та Ag(NH3)2+ мають області переважання. На границі, pNH3 = (lg 2) / 2 = 3,61, горизонтальні відрізки наближених графіків lg [Ag(NH3)2+] та lg [Ag+] переходять у похилі із тангенсами 2, бо ці комплекси відрізняються на 2 ліганди NH3.
Асимптоти перетинають горизонтальну лінію lg [ ] = lg t у точках, абсциси яких – логарифми ступінчатих констант. Ці точки не збігаються із ТС. Спрощуючи побудову, зважимо, що експериментальні методи не дозволяють точно визначити різницю між близькими ступінчатими константи. Тому приймімо, що
lg K1 lg K2 (lg 2) / 2,
й на рис. 3.6 проведімо асимптоти графіка lg [AgNH3+] через ту саму ТС, двома променями із тангенсами 1. У ТС майже збігаються концентрації трьох частинок,
lg [Ag+] = lg [Ag(NH3)2+] lg [AgNH3+] lg (t / 3) = ‑ 1,5,
й спряження проводимо на lg 3 0,5 нижче за ТС.
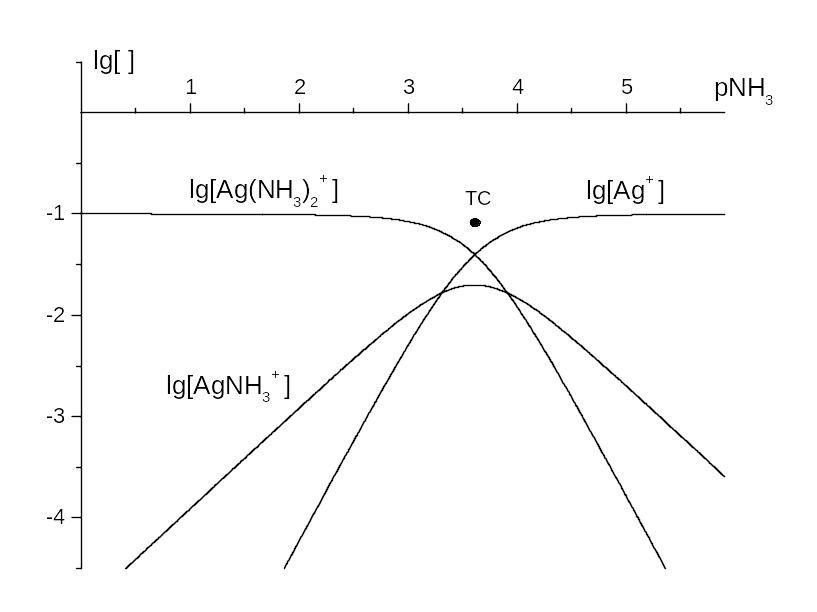
Рис. 3.6. КЛД для комплексів Ag+ із NH3, головна змінна pNH3, t(Ag+) = t = 0,10 моль/л.
Сполучення діаграм для гомогенних та гетерогенних систем. Із КЛД для гетерогенної системи оцінімо розчинність. Там, де вона перевищує концентрацію відповідного компонента, розчин є ненасиченим, і слід замінити КЛД для гетерогенної системи на фрагмент КЛД для гомогенної системи. Границями гетерогенної та гомогенної частин КЛД є точки перетину допоміжної горизонтальної лінії (її ордината – логарифм величини концентрації компонента) із графіком логарифма розчинності.