
- •Міністерство освіти і науки України Харківський національний університет імені в. Н. Каразіна Теоретичні основи та способи розв’язання задач з аналітичної хімії
- •Вступне слово
- •Основні позначення
- •1. Величини, що визначають склад
- •1.1. Хімічний склад
- •Розв’язок. Масова концентрація дорівнює
- •1.2. Стехіометричні розрахунки за рівнянням реакції
- •1.3. Вправи
- •2. Закон дії мас. Алгебра хімічних реакцій
- •2.1. Загальні співвідношення
- •2.2. Активності та рівноважні концентрації
- •Позначення констант рівноваг
- •2.3. Лінійні комбінації реакцій
- •2.4. У який бік зміщено рівновагу реакції?
- •2.5. Як записувати реакції у лабораторних журналах?
- •2.6. Вправи
- •3. Концентраційно-логарифмічні діаграми (клд)
- •3.1. Клд для гетерогенних систем
- •3.2. Графіки логарифмів розчинності
- •3.3. Вправи із гетерогенних систем
- •3.4. Умови переважання в гомогенних системах
- •3.5. Ускладнення у визначенні областей переважання
- •3.6. Клд для систем із одноядерними комплексами
- •3.7. Зміна ядерності реагентів
- •3.8. Вправи із гомогенних систем
- •4. Баланс компонентів
- •4.1. Загальні принципи
- •4.2. Підстановка рівнянь здм у рівняння балансу
- •4.3. Одноядерні продукти
- •4.4. Фази постійного складу
- •4.5. Вправи Гомогенні системи
- •5. Розрахунки за балансом компонентів
- •5.1. Буферні розчини
- •5.2. Стехіометричні співвідношення концентрацій
- •Кислотно-основні рівноваги
- •5.3. Ієрархія макро- та мікрокомпонентів
- •5.4. Гетерогенні системи
- •5.5. Кількісний вимір буферних властивостей
- •5.6. Вправи Буферні розчини
- •Стехіометричне співвідношення концентрацій
- •Гетерогенні системи
- •Буферні властивості
- •Системи із комплексами
- •6. Розрахунки за балансом реакції
- •6.1. Умови балансу
- •6.2. Прості розрахунки
- •Добуваючи квадратний корінь з обох частин, маємо
- •6.3. Методи розрахунків
- •6.4. Вправи
- •7. Умовні константи рівноваги
- •7.1. Класи реагентів
- •7.2. Умовні константи рівноваги
- •7.3. Умовні константи в розрахунках рівноваг
- •7.4. Графіки залежностей часток та їх логарифмів
- •7.5. Графіки логарифмів умовних констант
- •Параметри графіка залежності
- •7.6. Вправи
- •8. Декілька фаз змінного складу
- •8.1. Розподіл речовини між фазами
- •Відношення об’ємів порцій фаз дорівнює
- •Тангенси кутів нахилу асимптот для логарифма умовної константи екстракції оксинату плюмбуму від pH, приклад 8.4
- •8.2. Іонний обмін
- •8.3. Вправи
- •9. Утворення певної рівноважної концентрації, розчинності або ступеня екстракції
- •9.1. Метод балансу компонентів
- •На кроці 5 (непотрібному для уточнення клд) використовуємо
- •9.2. Метод балансу реакцій
- •9.3. Концентрація реагенту, що забезпечує задані умови для іншої речовини
- •9.4. Відокремлення компонентів Графічний розв’язок цієї проблеми показано на прикладі 3.3. Тут розгляньмо типові розрахункові методи.
- •9.5. Вибір величини умовної константи
- •9.6. Вправи
- •Варіанти завдання для вправи 9.1
- •10. Визначення компонентів. Гравіметрія
- •10.1. Стехіометричні співвідношення у гравіметрії
- •10.2. Розрахунок результату аналізу
- •10.3. Похибки у гравіметрії
- •10.4. Вправи
- •11. Титриметрія: стехіометричні розрахунки
- •11.1. Загальні відомості про титриметрію
- •11.2. Результат кислотно-основного титрування
- •Аліквотне відношення, {Vк/Vп}, безрозмірне, бо величини Vк та Vп виражено у однакових одиницях.
- •Виводячи формулу, маємо (у процентах)
- •11.3. Визначення концентрації розчину титранту за титруванням зразкової речовини
- •Для еквівалентів коефіцієнти вживаємо неявно,
- •Стехіометричний множник 2 приховуємо, застосовуючи еквівалент, (1/2)h2c2o4, або (1/2)h2c2o4·2h2o.
- •11.4. Оцінка наважок та аліквот
- •Бюретці відповідає оптимальна витрата титранту 20 мл, отже nst(oh‑) 2·10‑3 моль, n(н2с4н4о4) nst(oh‑) / 2 1·10‑3 моль.
- •11.5. Окреме визначення декількох аналітів
- •За двома рівняннями,
- •11.6. Зворотне титрування
- •Титруванню надлишку реагенту відповідає реакція
- •Дія 4. Масова частка CaCo3(s) у мінералі дорівнює
- •11.7. Визначення продукту, в який перетворено аналіт
- •Бо при зворотному титруванні здобутий po43‑ знову переходить у hpo42‑. Надлишок реагенту титруємо за реакцією
- •Дія 5. Масова частка p2o5 у мінералі дорівнює
- •11.8. Окисно-відновне титрування
- •11.9. Комплексометричне титрування
- •Дія 4. Масова частка kAl(so4)2 12 h2o у технічному галуні ‑
- •11.10. Вправи
- •Окисно-відновне титрування
- •Комплексонометричне титрування
- •12. Титриметрія: розбіжність точок –стехіометрії та кінцевої
- •12.1. Загальні уявлення
- •12.2. Дослідження титрування безпосередньо за клд
- •12.3. Різні методи титрування
- •12.4. Класи та умовні константи у титруванні
- •12.5. Вибір умов титрування за графіками залежностей логарифмів умовних констант
- •Параметри асимптот для прикладу 12.10
- •Із здм реакції
- •Параметри асимптот графіків (приклад 12.11)
- •Параметри асимптот графіків (приклад 12.12)
- •12.6. Вправи
- •Кислотно-основне титрування
- •Окисно-відновне титрування
- •Комплексонометричне титрування
- •Теоретичні проблеми титрування
- •Цитована література
- •Відповіді до вправ
- •61077, М.Харків, пл. Свободи, 4 Харківський національний університет ім. В.Н. Каразіна, Організаційно-видавничий відділ нмц
3. Концентраційно-логарифмічні діаграми (клд)
3.1. Клд для гетерогенних систем
Закон дії мас – одночленний алгебраїчний вираз, де показники ступеня при рівноважних концентраціях можуть бути різними. Тому графіки залежності між рівноважними концентраціями різні за формою, їх незручно будувати як допоміжний засіб досліджень. Але логарифми рівноважних концентрацій залежать один від одного лінійно, із множниками – стехіометричними коефіцієнтами. Графіки у подвійних логарифмічних координатах – прямі лінії – легко будувати й сприймати. Ще одна значна перевага таких координат: за ними можна вивчати як великі, так і малі рівноважні концентрації (а рівноважні концентрації змінюються на багато порядків!).
Концентраційно-логарифмічні діаграми (КЛД) – це сукупність графіків логарифмів рівноважних концентрацій продуктів реакцій, lg [Аі], як функцій так званої «головної змінної» – величини pX = ‑ lg [X]. Звичайно, X – або іон водню H+ (тоді pX = pH), або ліганд L у комплексах, або електрон, e‑, у відновленні,
pe = E / k,
де k – множник Нернста. Часто досить лише ескіза КЛД, без деталей, лише із частинами графіків для найбільших концентрацій. Графіки зручно будувати і сприймати зверху вниз та зліва направо – так, як ми пишемо тексти. Таким умовам відповідають згадані координати КЛД, вироблені скандинавською педагогічною школою. Деякі автори із замалим досвідом роботи із графіками вибирають незручні змінні рАі = ‑ lg [Аі], для яких ті частини КЛД, що нас найбільше цікавлять, доводиться будувати знизу вверх.
Звичайно у ЗДМ для гетерогенних систем дві змінні рівноважні концентрації, й графік взаємної залежності їх логарифмів є прямою.
Приклад 3.1. КЛД (головна змінна pCl) для комплексів у насиченому розчині AgCl(s).
Розв’язок. Логарифми констант – для 20оС та I = 4:
AgCl (s) Ag+ + Cl‑, lg Ks0 = ‑10,40, Ag+ + n Cl‑ AgCln1‑n, lg n = 3,45 (n=1), 5,57 (n=2), 6,0 (n=3).
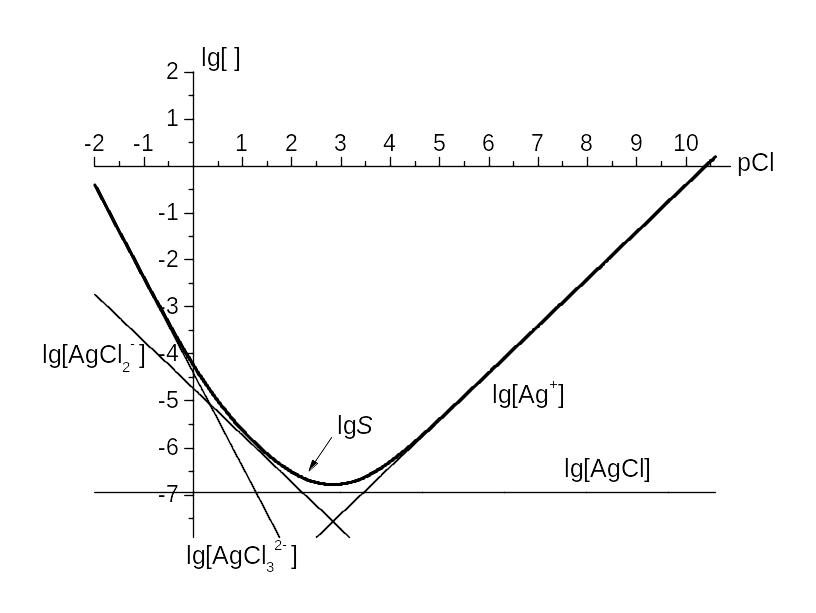
Рис. 3.1. КЛД для системи AgCl (s) – рCl (приклад 3.1). Плавна крива – логарифм розчинності AgCl (s), що обговорений у розділі 3.2.
Крок 1. Складімо лінійні комбінації реакцій, у яких із твердої фази, AgCl (s), та пов’язаного із головною змінною іона, Cl‑, утворювався комплекс та розрахуємо lg Ksn = lg Ks0 + lg n . Здобуваємо:
AgCl (s) - Cl- |
Ag+, |
lg Ks0 = -10,40, |
AgCl (s) |
AgCl, |
lg Ks1 = -6,95, |
AgCl (s) Cl‑ |
AgCl2-, |
lg Ks2 = -4,73, |
AgCl (s) + 2 Cl- |
AgCl32-, |
lg Ks3 = -4,40. |
Крок 2. Будуємо прямі (рис. 3.1), що відповідають логарифмічній формі ЗДМ цих реакцій,
lg [AgClі1‑і] = lg K sі + (1 ‑ і) pCl.
Ці рівняння можна й не записувати, уявляючи, що прямі перетинають вісь ординат у точках lg K sn, а тангенси їх кутів нахилу дорівнюють (з протилежним знаком) коефіцієнтові при Cl‑ у реакціях. Оскільки AgCl (s) незаряджений, а заряд Cl‑ дорівнює (‑1), то цей коефіцієнт (і відповідний тангенс) дорівнює зарядові продукту реакції (включаючи знак заряду!). Напрямок нахилу узгоджується з простими уявленнями про зміщення рівноваги: із зростом рCl зменшується [Cl‑], через зсув відповідних рівноваг зростає lg [Ag+], не змінюються lg [AgCl], зменшуються логарифми рівноважних концентрацій аніонних комплексів.
Будуючи пряму, обчислімо координати двох її точок. Точку на осі ординат ми уже маємо, а другу виберімо подалі від першої, зменшуючи похибки креслення, – наприклад, на осі абсцис.
Для графіка lg [Ag+] тангенс дорівнює 1, отже, зміна абсциси пов’язана з рівною їй зміною ординати. Графік проводимо через точки (0; ‑ 10,40) та (10,40; 0). Для графіка lg [AgCl32‑] тангенс дорівнює (‑2), і графік проводимо через точки (0; ‑ 4,40) та (‑ 4,40 / 2 = ‑ 2,2; 0). Аналогічно будуємо й інші графіки. Графіки перетинаються при абсцисах pCl, що дорівнюють логарифмам ступінчатих констант стійкості (дивись підрозділ 3.4).
Згідно ЗДМ для реакцій ступінчатого утворення комплексів,
AgClі-12‑і + Cl‑ AgClі1‑і, lg Kі,
концентрації [AgClі1‑і] = [AgClі-12‑і] при рCl = lg Kі. Це абсциса точки перетину графіків величин lg [AgClі1‑і] для комплексів, що відрізняються за складом на 1 ліганд Cl‑. Такі точки можуть бути зручними для побудови КЛД або для додаткового контролю її правильності. Так, на рис. 3.1 абсциси (значення рCl) точок перетину горизонтального графіка lg [AgCl] із похилими графіками lg [Ag+] та lg [AgCl2‑] дорівнюють lg K1 = lg 1 = 3,45 та lg K2 = lg 2 ‑ lg 1 = 5,57 ‑ 3,45 = 2,12.
Приклад 3.2. КЛД (головна змінна pH) для насиченого розчину Al(OH)3(s, аморфн.).
Розв’язок. Тут: lg Kw = -14,00, lg Ks0(Al(OH)3) = -32,34; для Al3+ та OH-: lg 1 = 9,03, lg 2 = 18,69, lg 3 = 26,99, lg 4 = 32,99, lg 22 = 20,30, lg 43 = 42,05.
Крок 1. Пов’язуючи логарифми рівноважних концентрацій гідроксокомплексів із рН, використовуємо ЗДМ реакцій, у яких беруть участь тверда фаза, іон Н+ та комплекс у розчині. Це реакції, обговорені у прикладі 2.11, для яких: lg *Ks0 = 9,66, lg *Ks1 = 4,69, lg *Ks2 = 0,35, lg *Ks3 = ‑5,35, lg *Ks4 = -13,35, lg *Ks22 = 11,64, lg *Ks43 = 15,03.
Крок 2. Будуємо прямі (рис. 3.2)
lg [Ali(OH)j3 i‑j] = lg *Ksji + (j ‑ 3 i) pH,
що перетинають вісь ординат у точках lg *Ksji. Тангенси кутів нахилу протилежні за знаком зарядові продукту реакції. Напрямок нахилу узгоджуємо із уявленнями про зсув рівноваг: із зростом рН зменшується [Н+], lg [Al3+] та відповідні величини для катіонних комплексів, не змінюється [Al(ОН)3], зростають концентрації аніонних комплексів.
Великі lg *Ksji не варто відкладати на осі ординат, бо відповідні концентрації нездійсненні, і КЛД невиправдано витягнеться вгору. Вибираймо інші точки, наприклад, точку перетину із віссю абсцис.
Так, неможливе значення [AlОН2+] = *Ks2 = 104,69 моль/л. Для графіка lg [AlОН2+] тангенс кута нахилу дорівнює (‑2), і спуск від точки (0; 4,69) до осі абсцис змінить абсциси на 4,69 / 2 2,3 (наближено, точніше не побудуєш!). На вісь абсцис наносимо точку (2,3; 0). Як другу візьмімо далеку точку, із абсцисою 10. Різниця цих абсцис є 10 – 2,3 = 7,7, а різниця ординат удвічі більша, тобто 2 7,7 = 15,4. Отже, координати другої точки (10; ‑15,4). Аналогічно будуємо інші графіки.
Концентрації [Al(OH)j3‑j] = [Al(OH)j+12‑j] при рН = ‑lg *Kj+1. Це – абсциса точки перетину графіків величин lg [Al(OH)j3‑j] для комплексів, що відрізняються за складом на 1 ліганд OH‑. Такі точки зручні для побудови КЛД або для додаткового контролю її правильності. Так, на рис. 3.1 абсциси (значення рН) точок перетину горизонтального графіка lg [Al(OH)3] із похилими графіками lg [Al(OH)2+] та lg [Al(OH)4‑] дорівнюють ‑lg *K3 = ‑lg 3 + lg 2 + Kw = 5,0 та ‑lg *K4 = ‑lg 4 + lg 3 + Kw = 8,0.
Як і на рис. 3.1, крім графіків для логарифмів концентрацій, побудовано логарифм розчинності. Щоб у розділі 3.2 було легше пов’язати між собою ці графіки, будуємо не логарифми концентрацій гідроксокомплексів, а логарифми концентрацій частинок, еквівалентних формульній одиниці осаду, Al(OH)3(s). Термін “формульна одиниця” розповсюджений в іноземній літературі, бо неможливо коректно виділити молекулу у твердій речовині.
Еквівалентність встановлюємо за стехіометричними коефіцієнтами реакцій. Наприклад, якщо реакцію
3 Al(OH)3(s) + 5 H+ Al3(OH)45+ + 5 H2O,
із “звичайними”, цілими коефіцієнтами, розділити на 3, стехіометричний коефіцієнт при формульній одиниці Al(OH)3(s), матимемо
Al(OH)3(s) + (5/3) H+ (1/3) Al3(OH)45+ + (5/3) H2O.
Еквівалент, (1/3) Al3(OH)45+, відповідає формульній одиниці Al(OH)3(s). Розраховуючи розчинність осаду (його витрати на утворення всіх видів частинок у розчині), зручно вживати концентрації еквівалентів, пов’язані із концентраціями продуктів очевидними співвідношеннями. Так, для розглядуваного комплексного іона маємо
[(1/3) Al3(OH)45+] = 3 [Al3(OH)45+].
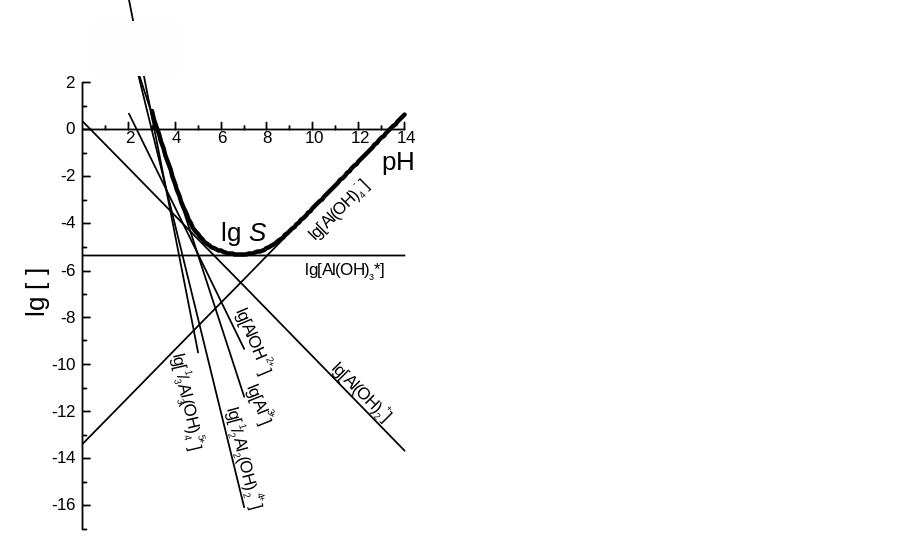
Рис. 3.2. КЛД для системи Al(OH)3 (s) – рH (приклад 3.2). Плавна крива – логарифм розчинності Al(OH)3 (s), що обговорений у розділі 3.2.
Це можна наочно порівняти з повсякденними уявленнями. Так, якщо ми розріжемо яблука, кожне на 3 частини, то число третин буде втричі більше, ніж вихідних яблук. Так само і кількість речовини (1/3) Al3(OH)45+, і концентрація еквівалента втричі більша, ніж у іона Al3(OH)45+. Ми повернемось до еквівалентів у главах 11 та 12. Графік для логарифма концентрації еквівалента йде паралельно графікові логарифма концентрації. В нашому прикладі
lg [(1/3) Al3(OH)45+] = lg 3 + lg [Al3(OH)45+] 0,5 + lg [Al3(OH)45+].
Це ми враховуємо, будуючи рис. 3.2. Величину так званого фактора еквівалентності, що показує, яку частку від формульної одиниці становить еквівалент, визначити легко. Так, коли еквівалент – це (1/3) Al3(OH)45+, то фактором еквівалентності є (1/3). Зв’язок фактора еквівалентності із стехіометричними коефіцієнтами реакції є дуже простим, потребуючи лише двох коефіцієнтів – при речовині у твердій фазі та при обговорюваній частинці у розчині. Розставляючи коефіцієнти у рівнянні реакції, ми перш за все урівняли число атомів Al у обох його частинах. По одному атомові Al наявні якраз у Al(OH)3(s) та (1/3) Al3(OH)45+, отже, останній є еквівалентом.
Алгоритм побудови КЛД. Узагальнюючи операції, розглянуті в прикладах 3.1 та 3.2, сформулюємо алгоритм із двох кроків:
1. Лінійними комбінаціями привести реакції до
(i / m) MmLn (s або g) + (j - i n / m) L MiLj, lg Ksji, (3.1)
і обчислити їх логарифми констант. У реакції можна включати й розчинник H2O, концентрація якого не входить у ЗДМ.
2. Побудувати прямі
lg [MiLj] = lg Ksji - (j - i n / m) pL (3.2a)
або
lg [MiLj] = lg Ksji - (j - i n / m) pL + (i / m) lg p(MmLn (g)), (3.2b)
де p(MmLn (g)) – заданий парціальний тиск газової фази. Прямі відсікають на осі ординат відрізки lg Ksji із нахилом до осі абсцис під кутом, тангенс якого дорівнює (j ‑ i n / m).
Якщо головною змінною є pX = pM у алгоритмі змінюються індекси у формулах (взаємна заміна i та j, m та n).
Не наслідуйте алгоритм наосліп, ще й намагаючись знайти відповідність між індексами у конкретних сполуках та у формулах (3.1) та (3.2). Краще вживайте лінійні комбінації реакцій для конкретної системи, обчислюючи як lg Ksji, так і стехіометричні коефіцієнти, що визначають нахил графіків. Якщо іон Х однозарядний, то тангенс кута нахилу – коефіцієнт (j ‑ i n / m) у рівняннях (3.1) та (3.2) – дорівнює абсолютній величині заряду продукту. Напрямок нахилу узгоджуємо із хімічними уявленнями, як у прикладах 3.1 та 3.2. Якщо Х багатозарядний, його заряд буде коєфіцієнтом пропорційності між зарядом продуктуі тагненсом кута нахилу.
