
- •Шкільний курс хімії та методика його викладання
- •Визначення номерів завдань самостійної роботи (інваріантна складова)
- •Зміст дисципліни
- •Модульна програма дисципліни модуль 1
- •Лабораторні заняття
- •Модуль 2
- •Лабораторні заняття
- •Модуль 3
- •Лабораторні заняття
- •Модуль 4
- •Лабораторні заняття
- •Модуль 5
- •Лабораторні заняття
- •Модуль 6
- •Лабораторні заняття
- •Матеріали для самостійної роботи
- •VII. Розв’язування розрахункових задач з хімії класифікація хімічних задач
- •Загальні правила розв’язування задач
- •Взаємозв’язок фізичних величин у хімії
- •Навчання учнів розв’язуванню задач
- •Способи розв’язання задач
- •Синтетичний шлях
- •Відомі величини
- •Аналітичний шлях
- •Тема 2. Концепція і стандарт шкільної хімічної освіти у 12-річній школі
- •Матеріали для самостійної роботи
- •Ключові групи компетентностей
- •Концепція загальної середньої освіти (12-річна школа)
- •Концепція загальної середньої освіти (12-річна школа) Вступ
- •I. Мета, завдання і засади діяльності школи
- •II. Структура 12-річної школи
- •III. Зміст загальної середньої освіти
- •IV. Навчально-виховний процес
- •V. Середня загальноосвітня школа в системі безперервної освіти
- •VI. Управління загальноосвітньою школою
- •VII. Підготовка вчителя і його професійне вдосконалення
- •Державний стандарт базової і повної середньої освіти
- •Загальна частина
- •Базовий навчальний план
- •Характеристика освітніх галузей
- •5. Освітня галузь «Природознавство»
- •Основна школа
- •Старша школа
- •Загальноприроднича компонента освітньої галузі
- •Додаток 1
- •Типовий навчальний план загальноосвітніх навчальних закладів з українською мовою навчання (основна школа у структурі 12-річної)
- •Додаток 5
- •Таблиця розподілу годин на навчальні предмети за рівнями змісту
- •Додаток 6
- •Типовий навчальний план загальноосвітніх навчальних закладів з українською мовою навчання (старша школа (без профільна) у структурі 12-річної)
- •Додаток 7
- •Додаток 8
- •Додаток 9
- •Додаток 10
- •Додаток 11
- •Додаток 12
- •Додаток 13
- •Додаток 14
- •Додаток 18
- •Додаток 22
- •Типовий навчальний план вечірньої (змінної) загальноосвітньої школи
- •Додаток 23
- •Типовий навчальний план вечірньої (змінної) загальноосвітньої школи
- •Додаток 24
- •Типовий навчальний план-схема спеціалізованих шкіл, гімназій, ліцеїв, колегіумів, класів з поглибленим вивченням окремих предметів
- •Концепція хімічної освіти 12-річної школи
- •Програми, підручники та посібники, рекомендовані Міністерством освіти і науки України для загальноосвітніх навчальних закладів у 2006-2007 н.Р.
- •Тема 3. Структура і зміст шкільної хімічної освіти
- •Матеріали для самостійної роботи
- •Тема 4. Методи навчання хімії.
- •Матеріали для самостійної роботи
- •Робота в малих групах
- •Результати роботи в малих групах
- •Лабораторні заняття Заняття 1
- •Правила з техніки безпеки при роботах в хімічній лабораторії Загальні положення
- •Вимоги безпеки перед початком роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в екстремальних ситуаціях
- •Заняття 2
- •Заняття 3
- •Модуль 2
- •Матеріали для самостійної роботи
- •Матеріали для самостійної роботи Засоби навчання
- •Засоби дистанційного навчання
- •Матеріали для самостійної роботи
- •Типи і структура уроків з хімії
- •Уроки засвоєння нових знань
- •Уроки-лекції
- •Уроки з використанням ігрових прийомів
- •Інтегровані (бінарні) уроки
- •Уроки узагальнення і систематизації знань
- •Уроки-семінари
- •Уроки-конференції
- •Урок «Мозкова атака»
- •Урок-аукціон
- •Біт-урок
- •Урок “круглий стіл”
- •Уроки контролю і корекції знань, умінь і навичок
- •Урок-гра
- •Урок-вікторина
- •Урок–конкурс
- •Урок–захист
- •Урок–квк (Клуб веселих та кмітливих)
- •Громадський огляд знань
- •Урок-залік
- •Урок удосконалення знань і вмінь
- •Урок перевірки знань і умінь
- •III. Вимоги до сучасного уроку
- •IV. Планування навчальної роботи та підготовка вчителя до уроку.
- •Лекційно-семінарська система навчання хімії
- •Сучасні освітні технології
- •Шкала переведення рейтингової оцінки в 5-бальну
- •Особливості методики:
- •Позакласна та позашкільна робота з хімії
- •Екскурсії
- •Позакласна робота з хімії
- •Хімічний вечір
- •Тиждень (декада, місячник) хімії
- •Хімічна олімпіада
- •Удосконалення класно-урочної системи
- •Нестандартні уроки
- •Матеріали для самостійної роботи
- •Хід уроку Ми продовжуємо вивчати властивості солей-електролітів. Давайте пригадаємо:
- •Компоненти солі повторення
- •Демонстрація
- •Демонстрація
- •Значення гідролізу.
- •Хід уроку:
- •1. Питання до класу:
- •II. Повторення матеріал
- •IV. Вивчення нового матеріалу:
- •V. Закріплення.
- •Урок-екскурсія
- •Хід уроку:
- •K Ca Se
- •У гостях у кислот
- •Хід уроку:
- •Лабораторні заняття Заняття 4
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 5
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Алгоритм
- •Модуль 3
- •Матеріали для самостійної роботи
- •Номенклатура неорганічних сполук
- •Хімічні сполуки
- •Катіони
- •Бінарні сполуки Оксигену (оксиди)
- •Основи, амфотерні гідроксиди
- •Кислоти
- •Солі та солеподібні сполуки
- •Координаційні сполуки
- •Органічні сполуки Алкани
- •Карбонові кислоти
- •Аміни і гетероциклічні сполуки
- •Лабораторні заняття Заняття 6
- •Семінарська частина
- •Практична частина
- •Аналіз уроку
- •Прийоми роботи учителя та учнів
- •Розподіл часу за етапами уроку і видами діяльності
- •Прийоми розвитку пізнавальних здібностей учнів
- •Характеристика особливостей даного уроку
- •Дотримання основних вимог до уроку і його результативність:
- •Самоаналіз уроку
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 7
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Визначте за хімічною формулою:
- •Заняття 8
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 4
- •Лабораторні заняття Заняття 9
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 10
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 11
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 5 Лекційний курс
- •Лабораторні заняття Заняття 12
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 13
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 6
- •Лабораторні заняття Заняття 14
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 15
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 16
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 7 (Проект) завдання №1
- •Завдання №2
- •Завдання №3
- •Завдання №4
- •Завдання №5
- •Завдання №6
- •Завдання №7
- •Завдання №8
- •Завдання №9
- •Завдання №10
- •Завдання №11
- •Завдання №12
- •Завдання №13
- •Завдання №14
- •Завдання №15
- •Завдання №16
- •Завдання №17
- •Завдання №18
- •Завдання №19
- •Завдання №20
- •Завдання №21
- •Завдання №22
- •Завдання №23
- •Завдання №24
- •Завдання №25
- •Завдання №26
- •Завдання №27
- •Завдання №28
- •Завдання №29
- •Завдання №30
- •Рекомендована література
Демонстрація
Визначення йонів Н+ за допомогою фіолетового лакмуса (білий фон).
Визначення йонів Zn2+.
3. Якщо сіль утворена сильною основою та сильною кислотою (NaCl, KNO3, Ba(NO3)2, CaCl2), гідролізу не піддіється. Розчини таких солей практично нейтральні, так як у них немає йона, який міг би зв’язати йон Н+ чи йон ОН– води. Значить ні один із згаданих йонів не накопичується, тобто С(Н+) = С(ОН–), рН=7.
Демонстрація
До розчинів солей додають фіолетовий лакмус (фон білий).
4. Якщо сіль утворена слабою основою і слабою кислотою, то проходить гідроліз по катіону та аніону:
CH3COO
NH4
+ HOH
![]() NH4OH
+ CH3COOH
NH4OH
+ CH3COOH
У залежності від порівняльної сили утворюваних основ та кислот розчини солей цього типу можуть мати слабокислу або слаболужну реакцію. Так, у випадку амоній ацетату рН ≈ 7, тому що сила утворених слабих електролітів приблизно однакова.
-
Кислота
%
Основа
%
Сіль
%
HCl, HBr, HI, HNO3
92
KOH, NaOH
91
KCl
86
H2SO4
90
Ba(OH)2
80
NH4Cl
85
H3PO4
29
NH4OH
1,3
NaCl
84
H2SO3
20
KNO3
83
HF
8,5
AgNO3
81
CH3COOH
1,3
ZnCl2
73
H2CO3
0,17
Na2SO4
69
H2S
0,07
ZnSO4
40
Якщо сіль утворена багатозарядним аніоном слабої кислоти чи катіоном слабої основи, то гідроліз відбувається ступінчасто. Наприклад:
![]()
NaOH – сильна, Н2СО3 – слабка
І ступінь
![]()
![]()
ІІ ступінь
![]()
![]()
Другий ступінь гідролізу виражений слабше, ніж перший. НСО3– – слабший електроліт ніж Н2СО3 (Кд(Н2СО3) = 3,6∙10–7). Крім того, в розчині накопичуються йони ОН–, що подавляють гідроліз, зміщуючи рівновагу вліво. Тому другим і наступними ступенями гідролізу можна знехтувати.
Кількісною характеристикою гідролізу є ступінь гідролізу:
![]()
Ступінь гідролізу – відношення числа молекул, що піддалися гідролізу, до загальної кількості молекул солі в розчині. Для солей, утворених сильною основою та сильною кислотою ступінь гідролізу практично рівний нулю.
Задача. При розчинені у воді 0,1 моль ціаніду калію, гідролізу піддалося 0,012 моль солі. Визначити ступінь гідролізу солі.
Розв’язання:
![]() (або 12%)
(або 12%)
Якщо в результаті гідролізу випадає осад або виділяється із сфери реакції газоподібний продукт, то гідроліз проходить лише в одному напрямку (є необоротним процесом).
Так, сульфіди, карбонати хрому(Ш) та алюмінію(Ш) не можуть існувати у водних розчинах, тому що піддаються повному гідролізу.
Фактори, що впливають на ступінь гідролізу солей
1. Хімічна природа солі.
Хімічна природа солі визначається силою компоненту: чим слабший компонент, тим більша ступінь гідролізу солі. Наприклад, ступінь гідролізу сульфіду натрію h(Na2S) = 4%, так як більш сильним компонентом є сульфід-іон S2– ((H2S) = 0,07%, а (H2CO3) = 0,17%).
Із двох солей – ферум хлоридів (Fе2+) та (Fе3+) сильніше піддається гідролізу FеСl3, оскільки ферум(ІІІ) гідроксид слабша основа, ніж ферум(ІІ) гідроксид.
Пояснюючи учням, що означає пропуск в таблиці розчинності, відповідно до деяких солей (алюміній сульфід Al2S3, алюміній карбонат Al2(CO3)3, ферум(ІІІ) карбонат Fe2(CO3)3 та ін.). Ці солі розкладаються повністю, і виділити їх із водного розчину неможливо. Наприклад:
![]()

2. Температура.
Гідроліз проходить з поглинанням теплоти, тому при підвищенні температури гідроліз посилюється. Це пояснюється збільшенням ступеня дисоціації води, у зв’язку з чим збільшується концентрація йонів Н+ та ОН–; а значить і можливість цих йонів сполучатися з слабим компонентом солі. Так, наприклад, ступінь гідролізу хром(ІІІ) хлориду збільшується з підвищенням температури:
|
t, C |
25 |
75 |
100 |
|
h, % |
9,4 |
28 |
40 |
Демонстрація: «Вплив температури на гідроліз натрій ацетату»
Пояснення: це сіль оцтової кислоти, де =1,3%, а й аніон СН3СОО– слабий компонент солі. Порівняємо реакцію середовища – фенолфталеїн забарвлюється лише в рожевий колір. При нагріванні розчину фенолфталеїн забарвлюється в малиновий колір, так як у розчині зросла концентрація йонів ОН–. При охолодженні розчину забарвлення фенолфталеїну слабшає, оскільки охолодження уповільнює процес гідролізу.
Запишемо:
1)
рівняння дисоціації: СН3СООNа![]() СН3СОО–
+ Nа+
СН3СОО–
+ Nа+
СН3СОО–
+ Н+ОН–![]() СНзСООН
+ OH–
СНзСООН
+ OH–
![]()
3. Концентрація солі.
При розбавленні розчину солі водою гідроліз посилюється, тому що збільшується ступінь дисоціації електроліту (солі); в зв’язку з цим збільшується і концентрація йонів слабого компоненту. Якщо до складу солі входять обидва слабі компоненти, то розбавлення не впливає не гідроліз такої солі.
4 Концентрація йонів Н+ та ОН–
Оскільки гідроліз – це зворотний процес, то додавання кислоти або лугу до розчинну солі викликає зміну швидкості прямої або зворотної реакції. Наприклад, якщо до розчину натрій карбонату (середовище лужне):
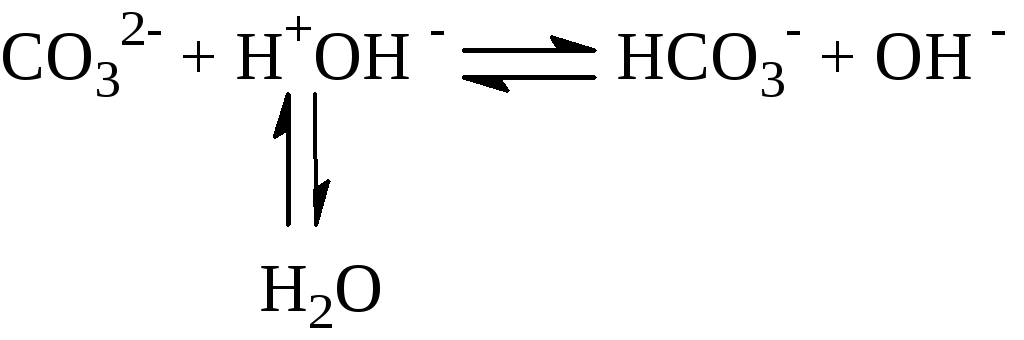
Додавання лугу, приведе до зв’язування йонів НСО3– і зросте швидкість зворотної реакції:
![]()
При додаванні кислоти до розчину натрій карбонату, відбуватиметься зв’язування йонів ОН–: ОН– + Н+ Н2О
і збільшується швидкість прямої реакції, в результаті чого буде утворюватися кислота Н2СО3, яка далі розкладається:
![]()
Висновок: Однойменні йони гідроліз подавляють, а різнойменні посилюють (однойменні – такі ж, як і один із йонів, що утворилися при гідролізі).
