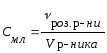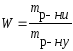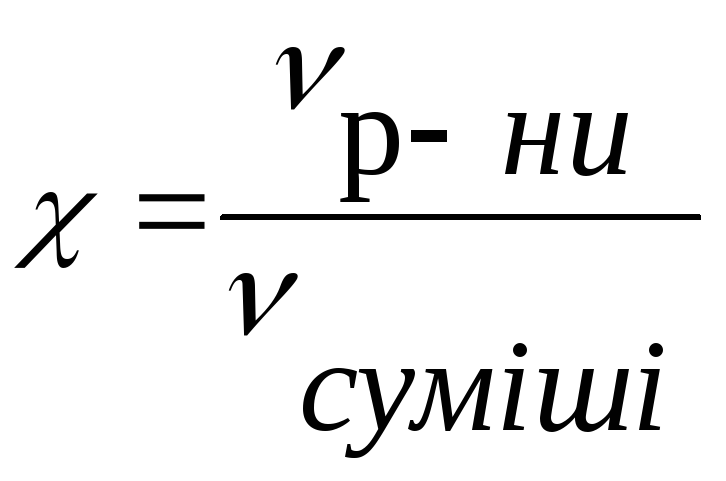- •Шкільний курс хімії та методика його викладання
- •Визначення номерів завдань самостійної роботи (інваріантна складова)
- •Зміст дисципліни
- •Модульна програма дисципліни модуль 1
- •Лабораторні заняття
- •Модуль 2
- •Лабораторні заняття
- •Модуль 3
- •Лабораторні заняття
- •Модуль 4
- •Лабораторні заняття
- •Модуль 5
- •Лабораторні заняття
- •Модуль 6
- •Лабораторні заняття
- •Матеріали для самостійної роботи
- •VII. Розв’язування розрахункових задач з хімії класифікація хімічних задач
- •Загальні правила розв’язування задач
- •Взаємозв’язок фізичних величин у хімії
- •Навчання учнів розв’язуванню задач
- •Способи розв’язання задач
- •Синтетичний шлях
- •Відомі величини
- •Аналітичний шлях
- •Тема 2. Концепція і стандарт шкільної хімічної освіти у 12-річній школі
- •Матеріали для самостійної роботи
- •Ключові групи компетентностей
- •Концепція загальної середньої освіти (12-річна школа)
- •Концепція загальної середньої освіти (12-річна школа) Вступ
- •I. Мета, завдання і засади діяльності школи
- •II. Структура 12-річної школи
- •III. Зміст загальної середньої освіти
- •IV. Навчально-виховний процес
- •V. Середня загальноосвітня школа в системі безперервної освіти
- •VI. Управління загальноосвітньою школою
- •VII. Підготовка вчителя і його професійне вдосконалення
- •Державний стандарт базової і повної середньої освіти
- •Загальна частина
- •Базовий навчальний план
- •Характеристика освітніх галузей
- •5. Освітня галузь «Природознавство»
- •Основна школа
- •Старша школа
- •Загальноприроднича компонента освітньої галузі
- •Додаток 1
- •Типовий навчальний план загальноосвітніх навчальних закладів з українською мовою навчання (основна школа у структурі 12-річної)
- •Додаток 5
- •Таблиця розподілу годин на навчальні предмети за рівнями змісту
- •Додаток 6
- •Типовий навчальний план загальноосвітніх навчальних закладів з українською мовою навчання (старша школа (без профільна) у структурі 12-річної)
- •Додаток 7
- •Додаток 8
- •Додаток 9
- •Додаток 10
- •Додаток 11
- •Додаток 12
- •Додаток 13
- •Додаток 14
- •Додаток 18
- •Додаток 22
- •Типовий навчальний план вечірньої (змінної) загальноосвітньої школи
- •Додаток 23
- •Типовий навчальний план вечірньої (змінної) загальноосвітньої школи
- •Додаток 24
- •Типовий навчальний план-схема спеціалізованих шкіл, гімназій, ліцеїв, колегіумів, класів з поглибленим вивченням окремих предметів
- •Концепція хімічної освіти 12-річної школи
- •Програми, підручники та посібники, рекомендовані Міністерством освіти і науки України для загальноосвітніх навчальних закладів у 2006-2007 н.Р.
- •Тема 3. Структура і зміст шкільної хімічної освіти
- •Матеріали для самостійної роботи
- •Тема 4. Методи навчання хімії.
- •Матеріали для самостійної роботи
- •Робота в малих групах
- •Результати роботи в малих групах
- •Лабораторні заняття Заняття 1
- •Правила з техніки безпеки при роботах в хімічній лабораторії Загальні положення
- •Вимоги безпеки перед початком роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в екстремальних ситуаціях
- •Заняття 2
- •Заняття 3
- •Модуль 2
- •Матеріали для самостійної роботи
- •Матеріали для самостійної роботи Засоби навчання
- •Засоби дистанційного навчання
- •Матеріали для самостійної роботи
- •Типи і структура уроків з хімії
- •Уроки засвоєння нових знань
- •Уроки-лекції
- •Уроки з використанням ігрових прийомів
- •Інтегровані (бінарні) уроки
- •Уроки узагальнення і систематизації знань
- •Уроки-семінари
- •Уроки-конференції
- •Урок «Мозкова атака»
- •Урок-аукціон
- •Біт-урок
- •Урок “круглий стіл”
- •Уроки контролю і корекції знань, умінь і навичок
- •Урок-гра
- •Урок-вікторина
- •Урок–конкурс
- •Урок–захист
- •Урок–квк (Клуб веселих та кмітливих)
- •Громадський огляд знань
- •Урок-залік
- •Урок удосконалення знань і вмінь
- •Урок перевірки знань і умінь
- •III. Вимоги до сучасного уроку
- •IV. Планування навчальної роботи та підготовка вчителя до уроку.
- •Лекційно-семінарська система навчання хімії
- •Сучасні освітні технології
- •Шкала переведення рейтингової оцінки в 5-бальну
- •Особливості методики:
- •Позакласна та позашкільна робота з хімії
- •Екскурсії
- •Позакласна робота з хімії
- •Хімічний вечір
- •Тиждень (декада, місячник) хімії
- •Хімічна олімпіада
- •Удосконалення класно-урочної системи
- •Нестандартні уроки
- •Матеріали для самостійної роботи
- •Хід уроку Ми продовжуємо вивчати властивості солей-електролітів. Давайте пригадаємо:
- •Компоненти солі повторення
- •Демонстрація
- •Демонстрація
- •Значення гідролізу.
- •Хід уроку:
- •1. Питання до класу:
- •II. Повторення матеріал
- •IV. Вивчення нового матеріалу:
- •V. Закріплення.
- •Урок-екскурсія
- •Хід уроку:
- •K Ca Se
- •У гостях у кислот
- •Хід уроку:
- •Лабораторні заняття Заняття 4
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 5
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Алгоритм
- •Модуль 3
- •Матеріали для самостійної роботи
- •Номенклатура неорганічних сполук
- •Хімічні сполуки
- •Катіони
- •Бінарні сполуки Оксигену (оксиди)
- •Основи, амфотерні гідроксиди
- •Кислоти
- •Солі та солеподібні сполуки
- •Координаційні сполуки
- •Органічні сполуки Алкани
- •Карбонові кислоти
- •Аміни і гетероциклічні сполуки
- •Лабораторні заняття Заняття 6
- •Семінарська частина
- •Практична частина
- •Аналіз уроку
- •Прийоми роботи учителя та учнів
- •Розподіл часу за етапами уроку і видами діяльності
- •Прийоми розвитку пізнавальних здібностей учнів
- •Характеристика особливостей даного уроку
- •Дотримання основних вимог до уроку і його результативність:
- •Самоаналіз уроку
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 7
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Визначте за хімічною формулою:
- •Заняття 8
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 4
- •Лабораторні заняття Заняття 9
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 10
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 11
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 5 Лекційний курс
- •Лабораторні заняття Заняття 12
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 13
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 6
- •Лабораторні заняття Заняття 14
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 15
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 16
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 7 (Проект) завдання №1
- •Завдання №2
- •Завдання №3
- •Завдання №4
- •Завдання №5
- •Завдання №6
- •Завдання №7
- •Завдання №8
- •Завдання №9
- •Завдання №10
- •Завдання №11
- •Завдання №12
- •Завдання №13
- •Завдання №14
- •Завдання №15
- •Завдання №16
- •Завдання №17
- •Завдання №18
- •Завдання №19
- •Завдання №20
- •Завдання №21
- •Завдання №22
- •Завдання №23
- •Завдання №24
- •Завдання №25
- •Завдання №26
- •Завдання №27
- •Завдання №28
- •Завдання №29
- •Завдання №30
- •Рекомендована література
Заняття 5
Тема: Форми організації навчання учнів хімії. Підготовка вчителя до уроку. Експеримент при вивченні води і розчинів.
Мета: Обговорити форми організації навчання хімії. Навчитися здійснювати тематичне планування. Провести структурно-логічний аналіз уроку і визначити взаємозв’язки його компонентів. Відпрацювати техніку і методику хімічного експерименту при вивченні води і розчинів.
Семінарська частина
Питання для самоконтролю
Типи і структура навчальних занять з хімії.
Структура та побудова уроку хімії.
Вимоги до сучасного уроку з хімії.
Які види самостійних робіт застосовують у викладанні хімії?
Назвіть прийоми активізації пізнавальної діяльності учнів на уроках хімії.
Особливості лекційно-семінарської системи навчання хімії (досвід Гузика М.П.).
Організаційні основи технології модульно-рейтингового навчання в сучасній загальноосвітній школі.
Напишіть план-конспект уроку вивчення нового матеріалу, лекції, семінару.
У чому полягає специфіка методів навчання, обліку знань і домашніх завдань на факультативних заняттях?
Які особливості мають навчальний план і програма з хімії для шкіл і класів з профільним рівнем вивченням хімії?
Дати загальну характеристику модульно-розвивальному навчанню (з досвіду Фурмана А.В.)
Практична частина
Завдання 1. Переглянути відеозапис фрагментів навчальних занять різних типів кращих учителів хімії. Висловити власне судження про особливості цих занять.
Завдання 2. Рольова гра. Провести фрагмент уроку хімії. (Один студент – учитель, один студент – інспектор райвно, а інші студенти підгрупи – учні класу).
Лабораторна частина
Приготування розчинів
|
|
Концентрація |
Частка | ||||
|
Характеристика |
Мо-лярна |
Молярна еквівалента |
Моляльна |
Масова |
Об’ємна |
Мольна |
|
Позначення |
С |
СN |
СМл |
W |
|
|
|
Формула |
|
|
|
|
|
|
Приготування розчинів ведуть за індивідуальним завданням викладача. Спочатку необхідно провести відповідні розрахунки, дати їх викладачеві на перевірку, а потім готують розчини.
Завдання для самостійної роботи
Інваріантна складова – обов’язкові завдання
Завдання 1. Використовуючи як приклад наведену нижче форму тематичного планування, спланувати вивчення теми “Періодичний закон і періодична система хімічних елементів Д.І. Менделеєва” (9 клас).
Зразок форми тематичного планування
|
№ |
Тема уроку |
Основні поняття |
Методи, засоби |
Домашнє завдання |
Примітка |
|
|
|
|
|
|
|
Завдання 2. Користуючись наведеним нижче алгоритмом, визначте мету, методи, тип, структуру і засоби одного з навчальних занять теми “Періодичний закон і періодична система хімічних елементів Д.І. Менделеєва” (9 клас).
Алгоритм
1. Сформулюйте тему уроку відповідно до програми.
2. Попередньо визначте освітню мету.
3. З’ясуйте зміст теми за підручником, додатковою літературою.
4. Проведіть корекцію освітньої мети і поставте виховну й розвиваючу.
5. Відповідно до освітньої мети визначте тип уроку чи іншого навчального заняття.
6. Обрати методи, адекватні змісту уроку.
7. Підібрати ТЗН, обладнання і засоби наочності. Здійснити структурування уроку.
Завдання 3. Розробити сценарій позакласного заходу з хімії.
Завдання 4. Розв’язати задачі:
Визначте маси 10%-них розчинів фосфатної кислоти та натрій гідроксиду, необхідні для добування розчину, в якому міститься 9,6 г натрій дигідрогенфосфату та 2,84 г динатрій гідроген фосфату.
При спалюванні 10 л газової суміші, що складається з пропану (С3Н8) та бутану (С4Н10) утворилося 38 л карбон(IV) оксиду (всі виміри зроблені за однакових умов). Визначити об’єми газів у вихідній суміші.
У результаті спалювання 80 мл суміші водню з киснем об’єм газової суміші зменшився на 20 мл. В утвореній після реакції газовій суміші тліюча скіпка яскраво спалахує. Визначити склад вихідної та утвореної сумішей за умови, що вода перебуває в пароподібному стані.
На шальках терезів зрівноважили дві однакові посудини, в одній з яких містився карбон(IV) оксид, а в другій – карбон(ІІ) оксид. Обчислити масу та об’єм карбон(ІІ) оксиду (н.у.), якщо об’єм карбон(IV) оксиду становить 3,36 л (н.у.).
Скласти рівняння реакції перетворення озону О3 в кисень. Обчислити об’єм кисню, який утвориться, якщо в результаті реакції об’єм газової суміші збільшиться на 10 л.
Колба об’ємом 150 мл заповнена озоном О3 і врівноважена на терезах. У колбу такого ж об’єму і маси зібрали сульфур(IV) оксид і поставили на шальку терезів замість колби з озоном. Яку різноважку і на яку шальку слід покласти, щоб знову зрівноважити терези.
Спалили 42 мл суміші кисню з воднем. Після реакції залишився газ, в якому тліюча скіпка яскраво спалахує, а об’єм газової суміші зменшився на 30 мл. Визначити об’єми газів у вихідній суміші, якщо всі виміри зроблені за однакових умов, а вода за цих умов – рідина.
На шальках терезів зрівноважили дві однакові посудини в одній з яких міститься нітроген(IV) оксид, а в другій – нітроген(І) оксид. Обчислити масу та об’єм нітроген(IV) оксиду (н.у.), якщо об’єм нітроген(I) оксиду становить 7,84 л (н.у.).
У результаті спалювання в евдіометрі 40 мл суміші водню з киснем об’єм газової суміші зменшився до 28 мл. В утвореній суміші тліюча скіпка яскраво спалахує. Визначте склад вихідної та утвореної сумішей за умови, що вода перебуває в пароподібному стані.
Визначте формулу речовини, до складу якої входять Гідрогену та Сульфур. Відносна густина парів речовини за киснем 1,0625.
Реакція відбувається за схемою: О2 О3. Скласти рівняння реакції й обчислити об’єм озону (О3), який утвориться, якщо у результаті реакції об’єм газової суміші зменшиться на 4 л.
Обчислити масу водню, що прореагує з 15,78 л кисню. Вважати, що всі виміри роблять за нормальних умов.
На шальках терезів зрівноважили дві однакові посудини, в одній з яких містився озон (О3), а в другій – азот (N2). Обчислити масу та об’єм азоту (н.у.), якщо об’єм озону за н.у. становить 26,88 л.
Колба об’ємом 200 мл заповнена нітроген(IV) оксидом і врівноважена на терезах. Потім у таку ж колбу зібрали карбон(ІІ) оксид. Яку гирьку і на яку шальку треба покласти, щоб знову зрівноважити терези?
Обчислити відносну молекулярну масу невідомого газу, якщо густина його 2,857 г/л. Запропонуйте формулу цього газу.
Спалили 25 мл суміші кисню і водню. Після реакції залишилося 7 мл кисню, що не прореагував. Визначити об’єм кисню у вихідній суміші.
Визначити густину за воднем газової суміші, що складається з аргону об’ємом 56 л і азоту об’ємом 28 л. Об’єми газів приведені до нормальних умов.
До 5 л суміші вуглеводню (СхНу) й карбон(IV) оксиду додали 16 л кисню (н.у.) і суміш підпалили. Після реакції об’єм суміші складав 24 л, а після конденсації води – в два рази менше. Після цього її пропустили через розчин лугу і об’єм зменшився до 1 л. Визначте формулу вуглеводню.
Для повного згоряння етану (С2Н6) з етеном (С2Н4) об’ємом 30 л потрібно 100 л кисню. Знайдіть об’єми газів у вихідній суміші.
Після вибуху 200 мл суміші водню та кисню і приведення її до нормальних умов залишилося ще 20 мл газу, який підтримує горіння. Знайдіть об’єми газів у вихідній суміші.
Після вибуху 200 мл суміші водню та кисню і приведення її до нормальних умов залишилося ще 20 мл газу, що підтримує горіння. Знайдіть об’єми газів у вихідній суміші.
У результаті перетворення кисню в озон (О3) об’єм газової суміші зменшився на 5 мл. Який об’єм кисню було взято для реакції? Який об’єм озону утворився?
У результаті спалювання в евдіометрі 40 мл суміші водню і кисню об’єм зменшився до 28 мл. В утвореній суміші тліюча скіпка яскраво спалахує. Визначити склад початкової та утвореної суміші за умови, що вода перебуває в пароподібному стані а всі виміри зроблені за однакових умов.
При спалюванні суміші карбон(ІІ) оксиду і кисню об’єм суміші зменшився до 75 мл. Визначити об’єми газів у вихідній суміші. Всі виміри зроблено за однакових умов, а реакція відбувається за схемою: СО + О2 СО2.
Спалили 25 мл суміші кисню і водню. Після реакції залишилося 7 мл кисню, що не прореагував. Визначте об’єм кисню у вихідній суміші. Всі виміри зроблено за однакових умов.
Під час розкладу озону (О3) утворюється кисень. Об’єм кисню, що утворився в результаті такої реакції, більший від об’єму озону на 4,48 л. Визначити початковий об’єм озону, якщо відомо, що всі виміри проводилися за однакових умов.
До 200 г 5,3%-ного розчину натрій карбонату додали 300 г 3,36%-ного розчину нітратної кислоти. Визначте склад утворених продуктів та їх масову частку (%) в утвореному розчині.
До 300 мл 0,6 М розчину нітратної кислоти додали 200 мл 0,6 М розчину натрій карбонату. Визначте склад утворених продуктів та їх молярну концентрацію в утвореному розчині, якщо припустити, що об’єм його не зменшився при виділенні утвореного вуглекислого газу.
Суміш 2,8 л водню і 2,8 л азоту (об’єми газів виміряні за н.у.) пропустили над каталізатором за певних умов. Для нейтралізації добутого амоніаку витратили 24 мл розчину хлоридної кислоти (W=8%, =1,04 г/мл). Обчислити об’ємну частку компонентів у суміші 9 (н.у.) після проходження її над каталізатором.
Обчислити масу осаду, який утворився при зливанні 100 мл розчину з масовою часткою барій хлориду 9,45% і густиною 1,1 г/см3 та 200 мл розчину з масовою часткою сульфатної кислоти 4,76% і густиною 1,03 г/см3. Практичний вихід солі становить 95%.
5 г суміші калій хлориду і амоній хлориду прожарили до припинення виділення пару. У залишку виявилося 4 г речовини. Визначити склад суміші (в % за масою).
Зразок ферум(ІІ) сульфіду обробили надлишком хлоридної кислоти. Газ, що утворився, прореагував з 26,25 мл розчину калій гідроксиду, в якому масова частка КОН становить 25% (=1,28 г/мл). При цьому утворилася кисла сіль. Яка маса зразка ферум(ІІ) сульфіду була взята, якщо в ньому 5% домішок?
До сульфатної кислоти масою 200 г з масовою часткою 51,7% додали олеум масою 40 г з масовою часткою SO3 40%. Яку масу барій хлориду необхідно взяти осадження всіх сульфат-іонів?
Який об’єм сульфур(IV) оксиду (н.у.) утвориться, якщо натрій сульфат(IV) масою 26 г помістити у хлоридну кислоту масою 150 г з масовою часткою гідроген хлориду 15%?
При взаємодії суміші міді і цинку масою 20 г із надлишком розбавленої сульфатної кислоти виділилося 5,6 л газу (н.у.). Визначити масу міді в суміші.
До розчину, який містить алюміній сульфат масою 68,4 г долили розчин, що містить барій нітрат масою 182,7 г. Осад відфільтрували. Визначити маси речовин, що містяться у фільтраті.
Яку масу цинк сульфіду випалили, якщо одержали сульфур діоксид об’ємом 10,08 л (н.у.) при виході 90%?
Сірку масою 8 г перетворили в сульфур(IV) оксид, який пропустили крізь розчин калій гідроксиду, в якому містилося 0,5 моль лугу. Визначити масу солі, що при цьому утворилася.
Визначити склад і масу солі, що утворилася в результаті пропускання амоніаку об’ємом 280 мл (н.у.) через 25 г розчину, у якому масова частка ортофосфатної кислоти 4,9% (вважати, що амоніак прореагував повністю).
Визначити склад та масу солі, що утворилася в результаті пропускання амоніаку об’ємом 250 мл (н.у.) через 25 г розчину, в якому масова частка ортофосфатної кислоти 4,9% (вважати, що амоніак повністю прореагував).
Визначити склад та масу солі, що утворилася в результаті пропускання амоніаку об’ємом 224 мл (н.у.) через 10 г розчину, в якому масова частка ортофосфатної кислоти 4,9% (вважати, що амоніак повністю прореагував).
Через 200 г розчину амоній дигідрогенортофосфату з масовою часткою солі 23% пропустили газ, який одержали взаємодією 10,7 г амоній хлориду з надлишком калій гідроксиду. Які речовини і якої маси залишаться в розчині після його випарювання при помірній температурі?
Через 3 л 3М розчину оцтової кислоти пропустили 44,8 л (н.у.) амоніаку. Обчислити масу кальцій карбонату, яка може прореагувати з розчином кислоти після пропускання через нього амоніаку?
Із азоту об’ємом 67,2 л (н.у.) і водню об’ємом 224 л (н.у.) утворюється амоніак. Використовуючи цей амоніак, одержали розчин об’ємом 400 мл з масовою часткою нітратної кислоти 40% з густиною 1,25 г/см3. Визначити вихід амоніаку в реакції.
Який об’єм амоніаку (н.у.), що містить 10% домішок, необхідно пропустити через 200 г розчину сульфатної кислоти з масовою часткою кислоти 9,8%, щоб утворилася кисла сіль?
При взаємодії калій гідроксиду масою 25 г (масова частка домішок становить 3%), з амоній хлоридом масою 156 г одержали 4,00 л амоніаку. Який вихід продукту реакції (в %)?
На одному заводі колона синтезу дає за добу близько 60 т амоніаку. Який об’єм водню (н.у.), що містить 2% домішок, вступає в реакцію, якщо вихід амоніаку становить 96%?
Змішали 5 г амоніаку і 5 г гідроген хлориду. Що взято в надлишку і яка маса цього надлишку? Яку масу амоній хлориду було одержано, якщо вихід продукту реакції становить 95%?
До 24%-ного розчину амоній нітрату (=1,1 г/мл) об’ємом 45,45 мл додали 80 г 10%-ного розчину натрій гідроксиду. Одержаний розчин швидко прокип’ятили (втратами парів води знехтувати). Визначте, які речовини залишилися в розчині й обчисліть їх масові частки.
Фосфор масою 3,1 г розчинили в надлишку концентрованої нітратної кислоти. Для нейтралізації одержаного розчину витратили 50,4 г розчину калій гідроксиду з масовою часткою лугу 20%. Визначити маси речовин в утвореному розчині.
Фосфор, виділений з 31 г калій ортофосфату, окиснили при нагріванні розчином нітратної кислоти об’ємом 27,9 мл з масовою часткою кислоти 70% (=1,4 г/см3). Після закінчення реакції до одержаного розчину додали 65,3 мл розчину натрій гідроксиду (=1,225 г/см3) з масовою часткою лугу 20%. Які речовини і якої маси будуть міститися в одержаному розчині.
Фосфін, одержаний при повному гідролізі кальцій фосфіду масою 145,6 г, спалили. Фосфор(V) оксид, що утворився, розчинили в 200 мл розчину натрій гідроксиду з масовою часткою лугу 25% (=1,28 г/см3). Визначити формулу солі, що утворилася, та її масову частку в одержаному розчині.
Визначити масу сульфур(IV) оксиду, яку потрібно розчинити в розчині масою 400 г з масовою часткою 15%, щоб добути розчин з масовою часткою кислоти 49%.
Склянку з розчином сульфатної кислоти (W=90%) залишили на деякий час відкритою. Маса розчину при цьому збільшилася з 200 до 220 г. Густина одержаного розчину становила 1,74 г/см3. Визначити молярну концентрацію кислоти в одержаному розчині.
Сульфід лужного металу масою 4,60 г обробили надлишком розведеної сірчаної кислоти. Газ, що виділився, спалили в умовах недостачі кисню, при цьому утворилося 1,60 г твердого залишку і 1,12 л (н.у.) газу. Встановіть склад сульфіду.
На суміш купрум(ІІ) оксиду та міді подіяли стехіометричною кількістю гарячої концентрованої сульфатної кислоти. При цьому виділилося 5,6 л газу (н.у.). При доливанні до одержаного розчину надлишку барій хлориду випало 174,75 г осаду. Визначити масовий склад вихідної суміші.
Сульфід металу MeS масою 132 г повністю прореагував з хлоридною кислотою. Газ, що утворився, об’ємом 33,6 л (н.у.) пропустили через 0,4 дм3 розчину натрій гідроксиду з масовою часткою лугу 25% (=1,28 г/см3). Визначити метал, що входив до складу сульфіду, та маси речовин в одержаному розчині.
Знайти масу солі, яка утвориться в результаті зливання 0,5 л розчину з масовою часткою натрій гідроксиду 20% (=1,22 г/см3) і 0,5 кг розчину з масовою часткою сульфатної кислоти 19,6%.
Обчислити масу осаду, який утвориться при зливанні 100 мл розчину з масовою часткою барій хлориду 9,45% і густиною 1,1 г/см3 та 200 мл розчину з масовою часткою сульфатної кислоти 4,76% і густиною 1,03 г/см3.
Зразок ферум(ІІ) сульфіду обробили надлишком хлоридної кислоти. Газ, що утворився, прореагував з 26,25 мл розчину калій гідроксиду, в якому масова частка калій гідроксиду дорівнює 25% (=1,28 г/см3). При цьому утворилася кисла сіль. Яка маса зразка ферум(ІІ) сульфіду?
Визначити маси розчину сульфатної кислоти з масовою часткою H2SO4 98% і води, необхідних для приготування 500 г розчину сульфатної кислоти з масовою часткою H2SO4 25%?
Скільки грамів води з’єднається з 284 г натрій сульфату для утворення кристалогідрату Na2SO410H2O?
Кристалогідрат барій хлориду містить 14,8% кристалізаційної води. Визначте формулу цього кристалогідрату.
Кристалогідрат калій гідроксиду містить 39,1% води за масою. Визначити формулу цього кристалогідрату.
Кристалогідрат натрій карбонату містить 62,9% води за масою. Визначити формулу цього кристалогідрату.
Скільки грамів води виділиться при прожарюванні глауберової солі Na2SO410H2O кількістю речовини 3,5 моль?
Скільки грамів мідного купоросу CuSO45H2O необхідно для отримання 4,2 моль безводного купрум(ІІ) сульфату?
Скільки грамів безводного натрій сульфату можна отримати з 1,5 моль глауберової солі Na2SO410H2O?
Скільки грамів води з’єднається з 3,2 моль безводного натрій сульфату при утворенні кристалогідрату складу Na2SO410H2O?
Скільки грамів води з’єднається з 4,5 моль безводного ферум(ІІ) сульфату при утворенні кристалогідрату складу FeSO47H2O?
Скільки грамів кристалогідрату FeSO47H2O необхідно для отримання 6,5 моль безводного ферум(ІІ) сульфату?
Випарюванням 2 л насиченого при 10С водного розчину натрій хлориду добуто 526,4 г солі. Чому дорівнює розчинність натрій хлориду у воді при 10С?
Розчинність натрій нітрату при 10С дорівнює 805 г Обчислити масу цієї солі, що утворює насичений розчин у воді об’ємом 250 мл при 10С.
Розчинність бертолетовоої солі KClO3 при 10С дорівнює 60 г Обчислити масу цієї солі, що утворює насичений розчин уводі об’ємом 500 мл при 10С.
Розчинність калій нітрату при 20С дорівнює 380 г Обчислити масу калій нітрату, яка міститься в 750 мл розчину, насиченого при 20С.
У 200 мл при 20С розчинили натрій бромід масою 181 г і добули насичений розчин. Визначте розчинність натрій броміду при 20С у воді.
Розчинність бертолетової солі KClO3 при 60С дорівнює 220 г Обчислити масу солі, яка міститься в 600 мл розчину, насиченого при 60С.
Варіативна складова – творчі завдання:
Завдання 1. Скласти плани-конспекти занять з хімії з використанням активних форм і методів навчання учнів, якщо:
а) учні класу мають високий рівень пізнавальної активності;
б) учні класу мають низький рівень пізнавальної активності.
Завдання 2. Розв’язати задачі:
Два юних хіміки визначали концентрацію розчину нітратної кислоти. Один із них відміряв 10 мл розчину і добавив до нього надлишок металічної міді. При цьому він одержав 746 мл газу.
Другий попередньо розбавив 10 мл розчину кислоти в 10 разів і добавив надлишок порошку свинцю. При цьому він одержав 560 мл газу (об’єми газів приведені до нормальних умов).
Визначте молярну концентрацію нітратної кислоти і приблизну масову частку кислоти в розчині й поясніть кількісну різницю в результатах дослідів.
Газ, одержаний при прожарюванні 4,9 г бертолетової солі (калій триоксохлорат(V)), змішали в посудині місткістю 4 л з газом, одержаним при взаємодії 6,0 г кальцію з водою. Визначте склад (в % за об’ємом) і тиск газової суміші в посудині (температуру вважати рівною 0С, тиском водяної пари знехтувати).
При дії надлишку хлоридної кислоти на 8,24 г суміші манган(IV) оксиду з невідомим оксидом ЕО2, який не реагує з хлоридною кислотою, одержано 1,344 л газу (н.у.). В ході другого досліду встановлено, що мольне відношення манган(IV) оксиду до невідомого оксиду дорівнює 3:1. Установіть формулу невідомого оксиду і обчисліть його масову частку в суміші.
При повному окисленні 7,83 г сплаву двох металів утворилося 14,23 г оксидів, при обробці яких лугом залишилося нерозчинним 4,03 г осаду. Визначте якісний склад сплаву, якщо катіони металів мають ступені окислення +2 і +3 відповідно, а молярні відношення оксидів 1:1 (вважати, що гідроксид металу зі ступенем окислення +3 має амфотерні властивості).
Література: 4, 5, 6, 11*, 15, 20, 21, 27, 29, 33, 34, 40*, 42*, 45*, 46, 50, 56, 62, 63, 67, 71*, 74, 77, 94*, 95*, 96*, 97*, 104, 110, 113*
Підсумковий контроль: контрольно-екзаменаційна робота № 2