
МНХ (Шиян Н.І.) / лек № 9. Автор Шиян Н.І
..docЛекція № 9. поняття про найважливіші класи неорганічних сполук
Завдання вивчення теми. Згідно програм для загальноосвітніх і спеціалізованих шкіл, поняття про класи неорганічних сполук формується під час вивчення конкретних речовий: кисню, водню і води на рівні атомно-молекулярного вчення: кисень → оксиди, водень → кислоти → солі, вода → основи.
Стає зрозумілим, що опорними знаннями для формування даних понять є знання про властивості окремих речовин і початкові хімічні поняття. Таким чином, йдеться не тільки про формування нових знань, але й про розвиток раніше набутих.
Навчально-методичні завдання вивчення матеріалу про класи неорганічних сполук такі:
-
Конкретизувати і збагатити початкові хімічні поняття і закони хімії. На типових прикладах розкрити взаємозв'язки між складом і властивостями оксидів, основ, кислот і солей, генетичні зв'язки між цими речовинами.
-
Вдосконалювати хімічну мову учнів, знання хімічної символіки, номенклатури, термінології.
-
Виробляти в учнів практичні вміння і навички поводження з хімічними речовинами, розпізнавання кислот і основ.
-
Формувати активну пізнавальну діяльність учнів, розвивати логічне мислення на основі порівняння різних об'єктів, узагальнення і систематизації знань.
-
Формувати елементи наукового світогляду учнів, зокрема уявлення про матеріальну єдність світу, його різноманітність.
Реалізація цих завдань спрямована на підготовку учнів до сприйняття періодичного закону хімічних елементів.
Методичні рекомендації щодо формування понять про класи неорганічних сполук
У темі «Кисень. Оксиди. Горіння» формується поняття про оксиди через накопичення чуттєвих і образних уявлень, що зумовлює індуктивний шлях до набуття знань.
Перш ніж почати вивчати оксиди, необхідно визначити, які знання про них повинні набути учні.
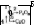 Опорним
є поняття про хімічні властивості кисню.
Для відтворення знань учні виконують
завдання: 1. Здійсніть перетворення:
Опорним
є поняття про хімічні властивості кисню.
Для відтворення знань учні виконують
завдання: 1. Здійсніть перетворення:
Напишіть відповідні хімічні рівняння. Назвіть продукти реакцій. Визначте їх тип.
-
Напишіть рівняння реакцій окислення складних речовий: сірководню Н2S, фосфіну РН3, метану СН4, ацетилену С2Н2. Продуктами кожної реакції є оксид відповідного неметалу і вода.
-
Зробіть висновок про добування оксидів. Пригадайте досліди, виконані на минулих уроках, і назвіть ознаки утворення оксиду сірки (IV) SO2, оксиду вуглецю (IV) СO2, оксиду заліза (III) Fе2Оз. Яке визначення можна дати оксидам?
Учні роблять висновок про те, що оксиди утворюються внаслідок реакцій окиснення як простих, так і складних речовин. Вони самостійно дають визначення оксидам.
Таким чином, на першому етапі учні одержують знання про добування оксидів.
На другому етапі висловлюється думка про необхідність класифікації оксидів. Основне питання, яке розв'язують учні, таке: За якою ознакою виділяють оксиди серед інших сполук і як можна класифікувати оксиди? Яку класифікаційну ознаку можна взяти за основу?
Відповіді передує виконання вправ:
-
Проаналізуйте формули речовин і випишіть з них формули оксидів: Н2О, НС1, SO2, SO3, NаСl, NaOH, Сu2O, СuО.
-
Як можна класифікувати оксиди, формули яких ви виписали?.
3. Випишіть оксиди неметалів в один стовпчик, оксиди металів – у другий. Що спільного в їх формулах і в чому різниця? Зробіть припущення про класифікацію оксидів за їх складом, відобразіть це у схемі.
Учні роблять висновок про те, що основною класифікаційною ознакою оксидів є наявність в молекулі двох елементів, один з яких кисень, а ознакою поділу оксидів за складом молекул є наявність елемента металу чи неметалу. Як наслідок обговорення даного питання вони складають узагальнюючу схему:

Потім учні виконують вправи на складання формул оксидів за валентністю елементів, у тому числі елементів із змінною валентністю, навчаються номенклатурі оксидів. Закріплюють знання про склад оксидів, виконуючи лабораторний дослід «Ознайомлення із зразками оксидів».
В узагальнюючому висновку вчитель підкреслює, що всі різноманітні оксиди об'єднуються в один клас – клас оксидів, бо всі вони мають подібний склад молекул. Це дає змогу відрізнити їх від інших класів неорганічних сполук. Таке співвідношення порівнюють з класифікацією у біології, коли окремі особини об'єднуються у вид, вид – у рід, рід – у родину і т. д.
У темі «Водень. Кислоти. Солі» учні відразу знайомляться з двома новими класами неорганічних сполук – кислотами і солями.
Розглядаючи способи добування водню в лабораторії, учні ознайомилися з реакціями цинку з соляною і сірчаною кислотами. їм відомо, що до складу молекул кислот обов'язково входять атоми водню. За цією ознакою вони відрізняють формули кислот від формул інших речовин. Ось чому вивчення кислот можна розпочати з виконання завдання на розпізнавання їх формул. Виходячи зі складу молекул, учням пропонують дати визначення кислотам. Визначення на цьому етапі може бути таким: кислоти – складні речовини, до складу молекул яких входять атоми водню, здатні заміщуватись на метал, і кислотний залишок. Далі, як і під час вивчення оксидів, розглядають класифікацію кислот. Учитель пропонує учням самостійно знайти основні ознаки класифікації кислот. Насамперед учні звертають увагу на наявність елемента кисню в молекулах деяких кислот і разом з учителем класифікують кислоти за складом на кисневмісні і безкисневі. Записують відповідні приклади.
На класифікацію кислот за основністю учні здебільшого виходять після навідного запитання: Чи може кількість атомів водню у молекулі кислоти бути класифікаційною ознакою? Після обговорення роблять узагальнюючий висновок про класифікацію кислот на одно-, двох- і трьохосновні за кількістю атомів водню, здатних заміщуватися на метал, і наводять приклади.
Для вивчення фізичних властивостей кислот використовують знання учнів про кислоти з побуту: оцтову, лимонну, молочну, яблучну, соляну та ін. Бесіду спрямовують таким чином, щоб виявити таку загальну властивість, як кислий смак їхніх розчинів. Учитель попереджає, що пробувати на смак кислоти не можна, і пояснює чому. Демонструючи кислоти, зауважують, що багато які кислоти (НС1, Н2SO4, НNО3) – безбарвні рідини. Відомі тверді кислоти – Н3РО4, НРO3. Майже всі кислоти, крім Н2SіО3, розчиняються у воді.
Із загальних хімічних властивостей кислот розглядають їх дію на індикатори. З Цією метою проводять лабораторний дослід «Дія розчинів кислот на індикатори». Встановлюють, що розчини кислот змінюють забарвлення індикаторів. Записують у зошити, якого кольору набувають лакмус і метиловий оранжевий у розчинах кислот. Далі розглядають таку характерну властивість кислот, як їх здатність взаємодіяти з деякими металами. Учні виконують лабораторні досліди «Відношення кислот (соляної, сірчаної) до металів (заліза, цинку, міді)». (Для дослідів беруть розчини кислот.) Перед виконанням лабораторних дослідів увагу учнів спрямовують на такі запитання: 1. Чи всі метали взаємодіють з кислотами? 2. Чи однаково активно відбуваються реакції між кислотами і металами?
Спостереження за дослідами учні заносять у таку таблицю:
|
Метал |
Кислота |
Рівняння реакції |
Тип реакції |
|
|
соляна |
сірчана |
|||
|
Zn Fe Сu |
|
|
|
|
Знаком « + » позначається перебіг реакції, знаком «—» – її відсутність. Поряд записується ознака реакції. Учні разом з учителем розміщують метали у ряд за їх активністю по відношенню до кислот: Zn, Fе, Сu, формулюють висновки у відповідності з поставленими запитаннями. Не всі метали з однаковою активністю взаємодіють з кислотами. Для пояснення цього положення формується поняття про витискувальний ряд металів. Можна коротко розповісти про те, хто його склав і як ним користуватися для визначення тих металів, які можуть заміщати водень у кислотах. Зауважують, що від активності металу і властивостей кислоти залежить активність перебігу реакції між ними. На прикладі взаємодії кислот з металами закріплюються знання учнів про реакції заміщення.
Вивчення взаємодії кислоти з оксидами металів також починається з виконання відповідного лабораторного досліду. Особливість цієї реакції в тому, що вона належить до реакції обміну. Цей тип реакцій іде не вивчали. Тому вчитель шляхом бесіди обговорює з учнями, які речовини за складом реагують між собою і які при цьому утворюються. Формулюється визначення реакцій обміну. Учні самостійно складають відповідне рівняння, після чого вчитель пропонує виразити його у загальному вигляді.
Зіставляють реакції кислот з металами і з оксидами металів спочатку на конкретних прикладах, а потім на загальних схемах. Для конкретних прикладів доцільно брати метал і відповідний йому оксид, напри» клад метал магній і оксид магнію. Обговорюють при цьому такі питания:
1. Що спільне у цих реакціях? 2. Чим різняться між собою реакції? 3. Яке визначення кислот можна було б дати на основі їх взаємодії з металами або оксидами металів? 4. З якою властивістю оксиду металу ви ознайомилися?
Завершують вивчення кислот на цьому етапі узагальненням знань про загальні і особливі властивості кислот складанням узагальнюючої схеми:

2. Покажіть за допомогою рівнянь реакцій, як можна реалізувати наведену схему:
Метал → Оксид металу → Сіль
На прикладі реакцій кислот з металами і оксидами формується поняття про солі. Хімічні властивості солей поки ще не розглядають. Зупиняються на визначенні солей, виходячи з їх складу (якісна характеристика), та відпрацьовують уміння складати формули кислот за валентністю металів та кислотних залишків, ознайомлюються з номенклатурою солей. Інформацію про формули і назви кислот і солей записують у таблицю, самостійне складання якої полегшує усвідомлення учнями матеріал:
|
Кислоти |
Солі |
||||
|
Формула |
Кислотний залишок |
Назва |
Формула |
Кислотний залишок |
Назва |
|
|
|
|
|
|
|
Контроль знань і вмінь учнів і самоперевірка за складанням формул кислот і солей за їх назвами або навпаки можуть бути здійснені за допомогою відповідних дидактичних карток або знакових моделей на магнітній основі. Відомо, що уміння складати формули виробляється системою вправ.
Поняття про основи учні дістають під час вивчення теми «Вода. Розчини. Основи». Опорними для введення поняття «основи» є знання про взаємодію води з активними металами і основними оксидами активних металів, внаслідок якої утворюються розчинні основи (луги). Від визначення поняття «луги» переходять до написання формул основ і їх назв, а потім до вивчення властивостей основ. Спочатку розглядають фізичні властивості окремих основ, виконуючи лабораторний дослід «Ознайомлення з властивостями гідроксидів натрію, кальцію, міді (II) або заліза (III)» Поряд з агрегатним станом, кольором, запахом досліджують розчинність їх у воді. Проводять класифікацію основ за розчинністю у воді.
Складання таблиці допомагає учням установити, фенолфталеїн е специфічним реактивом на луг. Для закріплення знань учитель проводить лабораторну спробу на розпізнавання кислот і лугів за допомогою індикаторів. Результати дослідів обговорюються з учнями. Учитель запитує: 1. Чи можна дію індикаторів на луги вважати їх загальною властивістю? 2, Чому всі луги змінюють однаково забарвлення індикаторів? Відповідь на перше запитання показує, як учні засвоюють різницю між загальними і особливими (специфічними) властивостями, на друге - як вміють виділяти головне, саме те, що наявність гідроксогрупи в усіх лугах зумовлює подібність у їхніх властивостях.
Учитель продовжує: у складі лугів і нерозчинних основ є гідроксогрупа. Тому луги і нерозчинні основи повинні мати і спільні властивості. Запитує, чи згодом з цим учні. Як доказ пропонує учням провести два лабораторних досліди: «Взаємодія лугів з кислотами» 1 «Взаємодія нерозчинних основ з кислотами» і зробити відповідні конкретні висновки, записавши рівняння реакцій, в тому числі і в загальному вигляді:
Хімічні властивості основ вивчають, порівнюючи між собою луги і нерозчинні основи. Насамперед розглядають їх відношення до індикаторів. Лабораторним шляхом перевіряють дію лугів на фенолфталеїн, індикатор, ще не відомий учням. Крім того, випробовують дію лугу на фіолетовий лакмус і метиловий оранжевий. Особливо наочно ці досліди відбуваються під час демонстрування їх через графопроектор. Порівнюють дію одних і тих самих індикаторів на розчини кислот і лугів і результати записують у таку таблицю:
|
Індикатори |
Нейтральне середовище |
Класи речовин |
|
|
кислоти |
основи (луги) |
||
|
Лакмус Метиловий оранжевий Фенолфталеїн |
Фіолетовий Оранжевий Безбарвний |
Червоний Рожевий Безбарвний |
Синій Жовтий Малиновий |
Визначають тип реакції — це реакція обміну. Потім характеризують реакцію обміну між основами і кислотами як реакцію нейтралізації, розкриваючи суть терміна «нейтралізація».
Переходять до розгляду реакцій між лугами і кислотними оксидами. Можна висловити припущення про можливість такої реакції. Для доказу проводять – демонстраційний дослід «Взаємодія оксиду вуглецю (IV) з розчином гідроксиду кальцію і твердим гідроксидом натрію». Учні переконуються, що луги, як у розчині, так і в твердому стані, реагують з оксидами неметалів, утворюючи сіль і воду. Нерозчинні основи не вступають в реакцію обміну з кислотними оксидами. Тому реакція між лугами і кислотними оксидами належить до специфічних, бо вона не характерна для всіх основ.
Після розгляду цих реакцій пригадують, що основні оксиди взаємодіють з кислотами. Продуктами реакцій в обох випадках є сіль і вода. Таким чином, початкові уявлення про оксиди завдяки вивченню властивостей кислот і основ розвиваються. За наслідками порівняння взаємодії оксидів з кислотами і лугами учні складають схему:
![]()
Нарешті розглядають відношення основ до нагрівання. З цією метою проводять лабораторний дослід «Розклад гідроксиду міді (II) під час нагрівання» і перевіряють дію нагрівання на кристалічний гідроксид натрію або кальцію. Зіставляючи досліди, роблять висновок про те, що лише нерозчинні основи розкладаються під час нагрівання. Тому ця властивість основ також є особливою, а не загальною. Закріплюючи знання учнів, складають узагальнюючу схему (див. схему 13).
Завершують вивчення основ відомостями про їх добування. Для цього пропонують учням відповісти на таке запитання: Які хімічні властивості води можна використати для добування основ? Називають дві властивості – взаємодію активних металів (К, Nа, Са) та їх оксидів з водою. Роблять висновок, що згідно з цим існують два способи добування лугів. Підкреслюють, що не всі оксиди металів реагують з водою, а лише ті, яким відповідають розчинні основи – луги.
Систематизація і закріплення знань учнів про основи, а разом з ними і про оксиди і кислоти, відбувається на семінарському занятті. Завдання передбачають різний рівень розвитку пізнавальної діяльності учнів, тому можна виділити 3 групи завдань.
Перша група – завдання, спрямовані на репродуктивну діяльність учнів: дати визначення основ (оксидів, кислот, солей), записати загальні формули, навести конкретні приклади, класифікувати їх за складом, назвати основні властивості певного класу речовин.
Друга група – завдання, що передбачають продуктивну діяльність учнів: виділити загальні і специфічні властивості основ (оксидів, кислот) і пояснити, чим вони зумовлені, розкрити на конкретних прикладах, як склад речовин впливає на їх властивості, здійснити перетворення у межах певного класу, наприклад (у загальному вигляді):

Третя група – завдання творчого характеру, розраховані на застосування знань у нестандартних умовах. Наприклад, здійснити перетворення і висловити припущення про взаємозв'язок між речовинами:
![]()
Завершити узагальнення знань про основи можна відповіддю на таке запитання: Чому всі речовини поділяються на класи і яка їх основна класифікаційна ознака? Це запитання є перехідним до узагальнення відомостей про найважливіші класи неорганічних сполук.
Формування поняття про взаємозв'язок між класами неорганічних сполук. У процесі узагальнення матеріалу про класи неорганічних сполук головна увага спрямовується спочатку на характеристику кожного окремого класу, а потім на засвоєння їх у певній системі, взаємозв'язку і взаємозумовленості на рівні атомно-молекулярного вчення. Це необхідно для того, щоб підготувати учнів до свідомого засвоєння періодичного закону і періодичної системи елементів Д. І. Менделєєва. Досягти поставленої мети можна шляхом розв'язання таких задач:
-
Узагальнити і систематизувати знання про кожний із класів неорганічних сполук.
-
Закріпити знання про групи речовин у межах кожного класу неорганічних сполук на основі їх складу і властивостей.
-
Розкрити генетичний взаємозв'язок між речовинами різних класів.
-
Показати практичне значення знань про взаємозв'язок речовин для добування нових сполук і матеріалів.
Особливості узагальнення знань про основні класи неорганічних сполук полягають в організації самостійної роботи учнів на встановлення взаємозв'язку між сполуками різних класів. Звернення учнів до складених ними таблиць і схем дасть їм змогу швидко відновити у пам'яті набуті знання, а виконання вправ, дослідів, розв'язування експериментальних задач допоможе їм ці знання конкретизувати.
З'ясувавши з учнями питання про необхідність класифікувати усі речовини і про те, що на рівні атомно-молекулярного вчення основною класифікаційною ознакою є склад речовин, систематизують знання про склад і номенклатуру неорганічних сполук. Найкраще це зробити шляхом виконання тренувальних вправ. Завдання можуть бути такого типу:
1. Розпізнавання і групування речовин за їх формулами або назвами. Тут можна виділити два види завдань:
а) Випишіть окремо формули оксидів, кислот, основ, солей і назвіть їх (декілька прикладів).
Поясніть, за якою ознакою ви їх класифікуєте.
б) Проведіть класифікацію речовин за назвами на етикетках, розділіть їх на групи, опишіть представника кожної групи. Назвіть ті класифікаційні ознаки, за якими ви розділили речовини на групи.
2. Порівняння між собою речовин різних класів.
Користуючись загальними формулами речовин, порівняйте їх між собою і визначте, що у них спільного і чим вони різняться (декілька прикладів). На які дві групи можна поділити всі ці речовини і за якою ознакою?
Наведені рекомендації стануть вчителю у пригоді під час підготовки учнів до тематичного заліку.
Після обговорення усіх питань ще раз підкреслюють, що підставою для класифікації речовин є їх хімічний склад.
Знання про класифікацію речовин поглиблюються під час узагальнення відомостей про властивості оксидів, кислот, основ і солей. Певними знаннями учні володіють, але вони ще розрізнені і неповні.
Насамперед ще раз звертаються до класифікації оксидів за властивостями і згадують визначення оксидів основних і кислотних, підтверджуючи конкретними властивостями окремих оксидів. При необхідності проводять або демонстраційний, або лабораторний експеримент. Враховуючи, що знання про властивості оксидів не були сконцентровані під час їх вивчення, пропонують відобразити їх у таких схемах:

Підходять до відповіді на запитання: Чи всі оксиди металів належать тільки до основних оксидів?
Звертають увагу на валентність елементів-металів у основних і кислотних оксидах і пропонують учням запам'ятати, що в основних оксидах валентність елементів-металів, як правило, І – II, у кислотних – V – VII. Особливо це стосується елементів із змінною валентністю. Пропонують учням визначити, які властивості виявлятимуть такі оксиди: Na2О, MgO, MnO, Mn2O7, SO3, V2O5, СrО3, виходячи з валентності елемента.
Учитель повідомляє, що основні й кислотні оксиди належать до солетворних. Але існують ще і несолетворні оксиди, які за звичайних умов не утворюють солей. До них належать оксид азоту (І) n2o, оксид азоту (II) NО, оксид вуглецю (II) СО тощо.
Для закріплення знань про властивості оксидів виконують різні вправи, розраховані як на репродуктивну, так і продуктивну діяльність учнів. Слід також включати завдання на генетичні зв'язки між сполуками різних класів.
Виконання таких вправ дає змогу зрозуміти учням, що існує генетичний зв'язок, або зв'язок за походженням, між сполуками одного і того самого хімічного елемента. Ці знання мають практичне значення, бо за даними рядами можна зробити висновок про добування одного класу речовин з іншого. Слід зазначити, що існують переходи не тільки від простої речовини до складної, а й навпаки. Учні переконуються в цьому, виконавши такі перетворення:
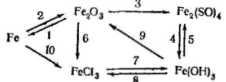
Після того як учні добре засвоїли матеріал про оксиди, зрозуміли суть генетичного зв'язку у рядах металів і неметалів, з'ясовують, чи може між цими рядами існувати зв'язок. Варто розглянути схему:
![]()
За схемою можна виконати досліди, взявши як вихідні речовини магній і сірку. У загальному вигляді цей взаємозв'язок можна зобразити схемою:
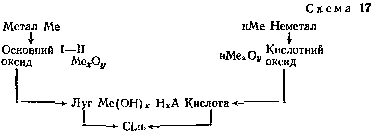
Під час узагальнення знань про кислоти і основи спочатку розглядають їх загальні властивості, а потім специфічні.
Завершується узагальнення знань виконанням практичної роботи з розв'язування експериментальних задач. Саме тут виявляються рівень розвитку пізнавальної діяльності учнів, глибина і логічність їх мислення, вміння переносити здобуті знання в нові ситуації, перевіряються уміння порівнювати і робити узагальнюючі висновки, творчий рівень мислення. Доцільно комбінувати для кожного учня завдання різних типів: на репродуктивну діяльність, пошукові, «творчі. Для проведення даної практичної роботи можна скористатися рекомендаціями, що є в методичній літературі, або тими завданнями, що наведені в підручнику.
Поняття про класи неорганічних сполук, поглиблюючись протягом усього вивчення неорганічної хімії, проходить чотири етапи формування згідно з різними теоретичними рівнями вивчення навчального матеріалу.
Перший етап – формування поняття про класи неорганічних сполук здійснюється на рівні атомно-молекулярного вчення.
Другий етап – на рівні періодичного закону і періодичної системи елементів Д.І. Менделєєва, вчення, про хімічний зв'язок та будову речовини.
Третій етап – на рівні теорії електролітичної дисоціації.
Четвертий – на рівні набутих на цей час теоретичних знань, які конкретизуються і розвиваються далі під час вивчення хімії елементів та їх сполук.
На якому б етапі не відбувався розвиток знань учнів про основні класи неорганічних сполук, учитель завжди повинен розвивати знання про залежність властивостей речовин від їх складу і будови, пояснювати застосування речовин залежно від їхніх властивостей. Програма профільного навчання дає змогу урізноманітнювати форми узагальнення знань і ввести поняття про амфотерні сполуки. Доцільно, наприклад, узагальнювати знання про речовини у формі таблиці:
-
Речовина
(назва)
Формула
Фізичні властивості
Хімічні властивості, на яких засноване використання сполуки
Застосування
Добування
Виконання такого завдання підносить пізнавальну діяльність учнів на вищий рівень, сприяє вдосконаленню їхніх умінь висловлювати свої думки коротко, зосереджуючи увагу на головному.
Перевірка знань учнів під час узагальнення відомостей про основні класи неорганічних сполук здійснюється систематично завдяки виконанню коротких самостійних робіт і завершується контрольною роботою. Практичну допомогу у підборі вправ надасть система навчальних завдань з даної теми, запропонована у посібнику для вчителя.
