
МНХ (Шиян Н.І.) / Лек № 8. Автор Шиян Н.І
..docЛекція № 8. початкові хімічні поняття і уявлення
Завдання вивчення теми. Тема “Початкові хімічні поняття” – перша у шкільному курсі хімії. Тому до її вивчення ставляться особливі вимоги. Від того, як учитель введе учнів у світ хімії – нової для них навчальної дисципліни, як вони навчаться оволодівати хімічними знаннями, залежатиме успіх засвоєння курсу хімії і розуміння ними закономірностей розвитку природознавства. Адже поняття “природознавство“ є збірним, воно інтегрує в собі ряд конкретних понять з фізики, біології, хімії. Отже, відносно природознавства хімія є його диференціальною частиною.
Важливо, починаючи з першої теми, так організувати процес навчання, щоб учнів поступово підводити до розуміння основного завдання хімії – добування речовин з необхідними властивостями. Досягти такого рівня розуміння хімії можна лише тоді, коли учні матимуть міцні й усвідомлені знання про початкові поняття цієї науки. Такі міркування обумовлюють основні завдання вивчення теми.
Освітні завдання – на основі емпіричних відомостей, набутих учнями з курсів природознавства, біології, фізики, дати їм початкові уявлення і поняття про об'єкти і явища хімії, про речовини, їх властивості і перетворення; формувати початкові поняття про хімічний елемент і хімічну реакцію, розкрити зміст законів сталості складу і збереження маси речовин та закріпити за допомогою хімічної мови знання про основні поняття і закони хімії; ознайомити учнів з деяким лабораторним обладнанням і найпростішими прийомами роботи в хімічній лабораторії, вимогами техніки безпеки.
За допомогою системного аналізу змісту теми можна визначити основні хімічні поняття і уявлення даної теми, а також опорні поняття міжпредметного характеру, на підставі яких формуються основні, починаючи з перших уроків хімії (табл. 1).
Таблиця 1
|
Поняття і уявлення |
|
|
опорні (міжпредметні) |
основні, що формуються |
|
Суміші. Розчини Властивості мінералів та гірських порід Фізичне тіло Маса тіла Молекули і атоми Молекулярна будова речовин Фізичні явища Внутрішня енергія тіла Молекулярно-кінетична теорія |
Речовина. Властивості речовини Чисті речовини і суміші Способи очищення речовин Хімічні реакції Молекулярна і не молекулярна будова речовин Хімічний елемент Відносна атомна маса Прості і складні речовини Хімічні формули Відносна молекулярна маса Масова частка Маса речовини Кількість речовини Молярна маса Валентність Атомно-молекулярне вчення Закон збереження маси речовин Хімічні рівняння Типи хімічних реакцій |
Як показує аналіз таблиці, провідними є поняття про речовину, хімічний елемент і хімічну реакцію. Boни починають формуватися в учнів на основі атомно-молекулярного вчення і далі конкретизуються під час вивчення властивостей окремих речовин – оксигену, гідрогену, води, оксидів, кислот, основ, солей та ін. Водночас ці поняття можна вважати перспективними, бо протягом подальшого вивчення курсу вони розвиватимуться за обсягом і змістом на вищому теоретичному рівні.
Виховні завдання – на основі використання міжпредметних зв'язків сприяти формуванню в учнів елементів наукового світогляду, усвідомленню реального існування молекул і атомів, показувати обумовленість перетворень речовин за дією законів природи, стверджувати діалектико-матеріалістичні погляди на природу; на прикладі відкриття M.В. Ломоносовим закону збереження маси речовин показувати, як здійснювалися відкриття в науці, як виникали і розв'язувалися при цьому наукові протиріччя, який внесок у розвиток наукових знань зробили видатні вчені-хіміки, у тому числі вітчизняні, формувати у них інтерес до вивчення хімії.
Розвиваючі завдання – сприяти розумовій діяльності учнів, удосконалювати логічні прийоми порівняння, аналізу, синтезу; розвивати уміння спостерігати, розмірковувати, виділяти головне, робити висновки, а також розвивати експериментальні вміння.
Формування поняття про речовину. Процес формування поняття про речовину має три особливості (H.Є. Кузнецова). Перша особливість пов'язана з тим, що поняття про речовину пізнається в динаміці, у взаємозв'язку з іншими речовинами. Друга особливість полягає в тому, що речовина залишається предметом вивчення як неорганічної, так і органічної хімії, і процес формування поняття про речовину пов'язується з вивченням інших понять. Третя особливість зумовлена складністю визначення цього поняття.
Зазначені особливості зумовили етапи формування поняття про речовину.
Перший етап – емпіричний. Для створення в учнів початкових уявлень про речовину вчитель використовує багаж емпіричних опорних понять і уявлень з курсів природознавства, біології і фізики. Вони і становлять базу для дальшого поглиблення знань про речовину.
Другий і третій етапи – теоретичні. На другому етапі розвиток понять про речовину базується на положеннях атомно-молекулярного вчення. Вони дають змогу дати якісну і кількісну характеристику речовини. Поглиблення знань про речовину на цьому етапі пов'язане з введенням нового поняття про хімічний елемент.
На третьому етапі відбувається розвиток поняття про речовину під час вивчення конкретних простих і складних речовин на рівні атомно-молекулярного вчення. При цьому необхідно розкрити взаємозв'язок склад – будова – властивості речовини. Учні повинні зрозуміти, що властивості речовини – це наслідок її складу і будови. Конкретизується ця думка під чає розгляду речовин молекулярної і немолекулярної будови та ознайомлення з їхніми властивостями (у порівнянні), ідеєю про зумовленість застосування речовин їхніми властивостями. Дальший розвиток знань про речовину відбуватиметься на основі електронних уявлень.
Розглянемо деякі особливості формування поняття про речовину на першому етапі.
Щоб розкрити хімічну суть цього поняття, необхідно відновити в пам'яті учнів уявлення про речовину з курсу фізики і зіставити його з поняттям «фізичне тіло» на основі знань основних положень молекулярно-кінетичної теорії. З цією метою учні виконують лабораторні досліди – розглядають і характеризують речовини з різними фізичними властивостями – воду, сірку, мідь, залізо, алюміній, хлорид натрію, оцтову кислоту, випробовують твердість речовин за допомогою колекції «Шкала твердості».
Можна використати й інший варіант самостійної роботи учнів, запропонувавши їм розглянути фізичні тіла – кусок льоду, сірки, графітовий стержень, гранули алюмінію, а потім визначити, з яких речовин вони складаються, який агрегатний стан цих речовин та які фізичні властивості для них характерні. Спостереження слід записати в таблицю 2, форму якої вчитель креслить на дошці.
Таблиця 2
|
Фізичне тіло |
Хімічна речовина |
Фізичні властивості речовини |
|
|
|
|
При цьому варто нагадати учням, що до фізичних властивостей речовин належать такі ознаки, як колір, блиск, запах, твердість, температура плавлення і кипіння, густина, розчинність у воді тощо. При необхідності учні можуть користуватися відповідними довідниками.
Доцільно запропонувати завдання на порівняння двох речовин, наприклад алюмінію і вуглецю (графіту) або хлориду натрію і сірки, попередивши учнів про те, що, порівнюючи речовини, треба звертати увагу не тільки на подібні ознаки, а й на відмінні. Результати спостережень слід обговорити з учнями, з'ясувавши, за якими ознаками здійснювалося порівняння.
Такий підхід дає можливість підвести учнів до узагальнюючого висновку про суть поняття «Фізичні властивості речовини». Учні переконуються в тому, що їх можна виявити за допомогою наших органів чуття або приладами. Зазначають, що речовини мають не тільки фізичні, а й хімічні властивості, які виявляються у процесах перетворення одних речовин в інші.
Доцільно дати загальне визначення поняття «властивості речовини» – ознак, за допомогою яких встановлюються подібність і відмінність між речовинами. При цьому слід підкреслити, що для вивчення властивостей тієї чи іншої речовини недостатньо встановити тільки одну ознаку, треба мати їх кілька і тільки після цього можна робити висновок про властивості даної речовини. і, нарешті, необхідно показати практичне значення знань про властивості речовини. Для цього на конкретних прикладах переконують учнів у тому, що на властивостях речовин засноване їх використання.
Розвиток знань про речовину продовжується під час розгляду сумішей. Цьому сприяє звернення до уявлень учнів, набутих з курсу природознавства. З цією метою порівнюють речовину і суміш речовин, розглядаючи як приклади повітря, воду, скло, алюміній, сталь, пластмасу, крохмаль тощо. На основі порівняння складу даних об'єктів підводять учнів до висновку: найважливішою ознакою речовини є її сталий склад. Якщо склад змінити, то зміниться і сама речовина. Таким чином, вже з перших уроків учні готуються до сприймання закону сталості складу
Для наочності учитель демонструє модель молекул води, вуглекислого газу, кисню і пояснює, що склад речовин, утворених цими молекулами, завжди сталий, де б ці речовини не знаходилися, де б і як вони не були добуті.
У той же час у сумішах речовин можна змінювати якісний склад і кількісне співвідношення компонентів. Наслідком бесіди є висновок про те, що у хімічних речовин сталий склад, а в сумішей – довільний.
За допомогою демонстраційних дослідів учитель доводить різницю між речовиною і сумішшю. Можна показати суміш крейди з водою, а потім змінити її склад, додавши піску тощо. На цьому досліді учні побачать, що склад суміші можна змінювати як за рахунок якісного складу, так і кількісного – збільшити або зменшити масу того чи іншого компонента або співвідношення компонентів. Далі проводять лабораторні досліди на розділення сумішей.
На дослідах, які проводив учитель, або окремих прикладах,, які обговорювались на уроці, з'ясовують, що вивчає хімія. З цією метою учні відповідають на запитання: Які досліди і висновки з них можна пояснити на основі знань з фізики? Який дослід не можна пояснити за допомогою знань з фізики і чому? Внаслідок бесіди учні висловлюють припущення, що фізика не розглядає здатність речовин перетворюватися у нові речовини, бо при фізичних явищах речовина зберігає свій склад. Отже, учні здатні зробити самостійний висновок про предмет хімії як науки. При цьому учитель повідомляє, що перетворення одних речовин в інші називається хімічним явищем, або хімічною реакцією. Демонструє приклади хімічних явищ. Учні під керівництвом учителя виконують лабораторні досліди – приклади фізичних і хімічних явищ.
Поряд з хімічним експериментом важливо залучати і міжпредметні зв'язки. Можна згадати, наприклад, як відбуваються процеси дихання і фотосинтезу, і під час бесіди з учнями з'ясувати, до яких явищ вони належать. Наслідком цієї бесіди може бути діалектичний висновок про те, що речовина – це предмет вивчення природознавства, зокрема фізики, хімії, біології. Кожна з цих наук вивчає ті властивості речовини, які підкоряються її законам.
Другий етап у формуванні первісного уявлення про речовину починається з ознайомлення з поняттям «хімічний елемент».
Формування поняття про хімічний елемент. Хімічний елемент – одне з основних понять хімії.
Воно пов'язане з поняттями «атом», «речовина». Ось чому знання про речовину, її склад на рівні атомно-молекулярної теорії є базою для. формування знань про хімічний елемент. Це поняття далі розвивається і поглиблюється під час вивчення електронної будови атома. Звертаємо увагу вчителя, що формувати знання про хімічний елемент значно складніше, ніж про речовину, бо дане поняття абстрактне.
Отже, завдання полягає в тому, щоб довести реальність існування хімічних елементів і схарактеризувати їх як з якісного, так і з кількісного боку.
Для формування поняття про хімічний елемент можна використати пошуковий підхід, бо учні на перших уроках уже підтвердили і закріпили знання про речовину. їм відомо, що речовини мають різні фізичні властивості залежно від їх складу. Демонструють розклад води електричним струмом і наголошують, що в результаті цього утворилося дві нові речовини – водень і кисень. Вчитель показує модель молекули води, відому учням з курсу фізики. За її допомогою учні усвідомлюють, що відбувається з молекулами води під впливом електричного струму: молекули розпадаються на два види атомів. З цих атомів виникають нові речовини – один вид атомів утворюють молекули кисню, другий – молекули водню. Отже, до складу молекул води входять два різні види атомів, або хімічних елементів. Відомо 118 видів атомів, або 118 хімічних елементів. Робиться висновок, що хімічний елемент – це складова частина речовини, яка являє собою певний вид атомів. Вони поєднуються у різних сполученнях і утворюють усю різноманітність речовин, яка спостерігається у природі і в лабораторії. Важливо підкреслити, що хімічний елемент – це не один окремий атом, а всі атоми одного виду. Через поняття «хімічний елемент» уточнюють визначення атома: атом – це найдрібніша частинка хімічного елемента.
Вчитель повідомляє, що для зручності хіміки домовилися позначати кожний хімічний елемент певним знаком (символом). Практика свідчить, що запам'ятати символи хімічних елементів допомагає використання періодичної системи як довідкової таблиці, з якої можна дізнатися про символ і назву хімічного елемента. Крім того, велике значення має написання хімічних диктантів.
Перш ніж розкрити суть хімічного символу, необхідно ознайомити учнів з кількісною характеристикою хімічного елемента. З цією метою учитель розповідає про масу атомів і відносну атомну масу. У класах хіміко-біологічного або хіміко-технологічного профілю доцільно навести математичний вираз відносної атомної маси.
У шкільних умовах краще сказати, що значення відносної атомної маси виражається абстрактним числом або «просто» числом. Слід показати, що точні значення відносних атомних мас наведені в таблиці «Періодична система хімічних елементів Д.І. Менделєєва», яка вивішена в хімічному кабінеті, і зазначити, що при хімічних розрахунках найчастіше використовують заокруглені, як правило, до цілих чисел значення відносних атомних мас хімічних елементів.
Тепер є всі підстави для узагальнення набутих знань про символ хімічного елемента. Допоможе в цьому схема 1:
Схема 1:
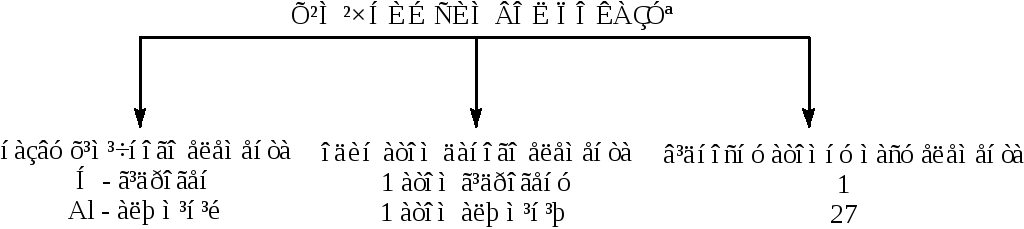
На закріплення знань учні виконують вправи різного ступеня складності.
На основі засвоєння поняття про хімічний елемент учнів ознайомлюють з поділом речовин за складом на прості і складні. Звертають увагу на те, що прості речовини в свою чергу за властивостями поділяють на метали і неметали. Під час пояснення вчитель демонструє набір деяких металів і неметалів, потім учні виконують лабораторні досліди «Ознайомлення із зразками простих і складних речовин, металів і неметалів». Шляхом бесіди спільними зусиллями з'ясовують агрегатний стан металів і неметалів, виділяють їхні основні фізичні властивості. Як наслідок обговорення в зошитах учнів з'являється схема 2:
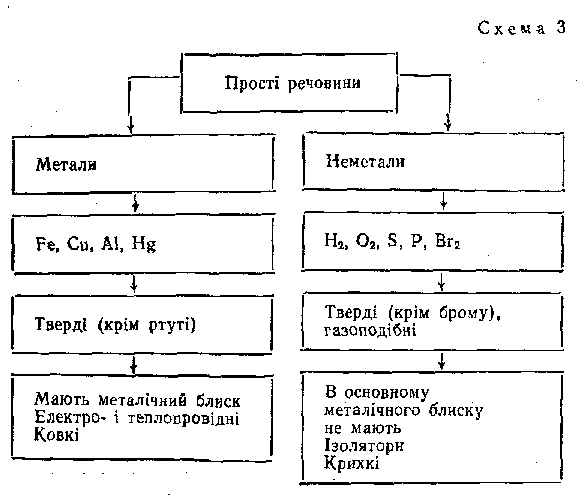
Під час відпрацювання знань на спеціально виділеному семінарському занятті або повторення і закріплення матеріалу на звичайному уроці звертають увагу на необхідність розмежування понять «хімічний елемент» і «проста речовина». З цією метою можна використати знання учнів з курсу природознавства про склад повітря і поставити, наприклад, таке проблемне запитання: Чи можна стверджувати, як на ваш погляд, що до складу повітря входять хімічні елементи нітроген і оксиген? Практика свідчить, коли учні вважають, що так стверджувати не можна, бо повітря – це суміш простих речовин азоту і кисню, то деякі вчителі погоджуються з цим. Насправді ж тут відбувається протиставлення двох понять – «хімічний елемент» і «проста речовина».
Щоб навчити учнів розрізняти ці поняття, потрібно проробити з ними тренувальні вправи. При цьому важливо навести такий приклад, щоб учні порівнювали просту речовину і складну, до складу якої входить хімічний елемент, що утворює просту речовину, наприклад проста речовина – кисень і складна речовина – вода. Далі варто запропонувати складніші завдання, наприклад: висловіть своє судження, в якому випадку йдеться про оксиген як хімічний елемент, а в якому – як про просту речовину, проаналізувавши формули таких речовин: кисень – O2, вода – H2O; озон – О3, пероксид водню – H2O2; вуглекислий газ – CO2, суміш газів – O2, CO2.
Судження має бути таким: атоми одного і того самого хімічного елемента оксигену можуть входити до складу як простих, так і складних речовин. У даному разі в усіх випадках оксиген входить до складу названих речовин і суміші газів як хімічний елемент, а коли зустрічається формула O2, про нього можна сказати і як про просту речовину, і як про хімічний елемент у вільному стані одночасно.
Розвитком знань про хімічний елемент є повідомлення про форми його існування у вигляді простих і складних речовин, а також поодиноких атомів, які можуть утворитися при високих температурах (схема 4).
Для закріплення цього матеріалу учні виконують систему завдань різного рівня складності.
