
- •Шкільний курс хімії та методика його викладання
- •Визначення номерів завдань самостійної роботи (інваріантна складова)
- •Зміст дисципліни
- •Модульна програма дисципліни модуль 1
- •Лабораторні заняття
- •Модуль 2
- •Лабораторні заняття
- •Модуль 3
- •Лабораторні заняття
- •Модуль 4
- •Лабораторні заняття
- •Модуль 5
- •Лабораторні заняття
- •Модуль 6
- •Лабораторні заняття
- •Матеріали для самостійної роботи
- •VII. Розв’язування розрахункових задач з хімії класифікація хімічних задач
- •Загальні правила розв’язування задач
- •Взаємозв’язок фізичних величин у хімії
- •Навчання учнів розв’язуванню задач
- •Способи розв’язання задач
- •Синтетичний шлях
- •Відомі величини
- •Аналітичний шлях
- •Тема 2. Концепція і стандарт шкільної хімічної освіти у 12-річній школі
- •Матеріали для самостійної роботи
- •Ключові групи компетентностей
- •Концепція загальної середньої освіти (12-річна школа)
- •Концепція загальної середньої освіти (12-річна школа) Вступ
- •I. Мета, завдання і засади діяльності школи
- •II. Структура 12-річної школи
- •III. Зміст загальної середньої освіти
- •IV. Навчально-виховний процес
- •V. Середня загальноосвітня школа в системі безперервної освіти
- •VI. Управління загальноосвітньою школою
- •VII. Підготовка вчителя і його професійне вдосконалення
- •Державний стандарт базової і повної середньої освіти
- •Загальна частина
- •Базовий навчальний план
- •Характеристика освітніх галузей
- •5. Освітня галузь «Природознавство»
- •Основна школа
- •Старша школа
- •Загальноприроднича компонента освітньої галузі
- •Додаток 1
- •Типовий навчальний план загальноосвітніх навчальних закладів з українською мовою навчання (основна школа у структурі 12-річної)
- •Додаток 5
- •Таблиця розподілу годин на навчальні предмети за рівнями змісту
- •Додаток 6
- •Типовий навчальний план загальноосвітніх навчальних закладів з українською мовою навчання (старша школа (без профільна) у структурі 12-річної)
- •Додаток 7
- •Додаток 8
- •Додаток 9
- •Додаток 10
- •Додаток 11
- •Додаток 12
- •Додаток 13
- •Додаток 14
- •Додаток 18
- •Додаток 22
- •Типовий навчальний план вечірньої (змінної) загальноосвітньої школи
- •Додаток 23
- •Типовий навчальний план вечірньої (змінної) загальноосвітньої школи
- •Додаток 24
- •Типовий навчальний план-схема спеціалізованих шкіл, гімназій, ліцеїв, колегіумів, класів з поглибленим вивченням окремих предметів
- •Концепція хімічної освіти 12-річної школи
- •Програми, підручники та посібники, рекомендовані Міністерством освіти і науки України для загальноосвітніх навчальних закладів у 2006-2007 н.Р.
- •Тема 3. Структура і зміст шкільної хімічної освіти
- •Матеріали для самостійної роботи
- •Тема 4. Методи навчання хімії.
- •Матеріали для самостійної роботи
- •Робота в малих групах
- •Результати роботи в малих групах
- •Лабораторні заняття Заняття 1
- •Правила з техніки безпеки при роботах в хімічній лабораторії Загальні положення
- •Вимоги безпеки перед початком роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в екстремальних ситуаціях
- •Заняття 2
- •Заняття 3
- •Модуль 2
- •Матеріали для самостійної роботи
- •Матеріали для самостійної роботи Засоби навчання
- •Засоби дистанційного навчання
- •Матеріали для самостійної роботи
- •Типи і структура уроків з хімії
- •Уроки засвоєння нових знань
- •Уроки-лекції
- •Уроки з використанням ігрових прийомів
- •Інтегровані (бінарні) уроки
- •Уроки узагальнення і систематизації знань
- •Уроки-семінари
- •Уроки-конференції
- •Урок «Мозкова атака»
- •Урок-аукціон
- •Біт-урок
- •Урок “круглий стіл”
- •Уроки контролю і корекції знань, умінь і навичок
- •Урок-гра
- •Урок-вікторина
- •Урок–конкурс
- •Урок–захист
- •Урок–квк (Клуб веселих та кмітливих)
- •Громадський огляд знань
- •Урок-залік
- •Урок удосконалення знань і вмінь
- •Урок перевірки знань і умінь
- •III. Вимоги до сучасного уроку
- •IV. Планування навчальної роботи та підготовка вчителя до уроку.
- •Лекційно-семінарська система навчання хімії
- •Сучасні освітні технології
- •Шкала переведення рейтингової оцінки в 5-бальну
- •Особливості методики:
- •Позакласна та позашкільна робота з хімії
- •Екскурсії
- •Позакласна робота з хімії
- •Хімічний вечір
- •Тиждень (декада, місячник) хімії
- •Хімічна олімпіада
- •Удосконалення класно-урочної системи
- •Нестандартні уроки
- •Матеріали для самостійної роботи
- •Хід уроку Ми продовжуємо вивчати властивості солей-електролітів. Давайте пригадаємо:
- •Компоненти солі повторення
- •Демонстрація
- •Демонстрація
- •Значення гідролізу.
- •Хід уроку:
- •1. Питання до класу:
- •II. Повторення матеріал
- •IV. Вивчення нового матеріалу:
- •V. Закріплення.
- •Урок-екскурсія
- •Хід уроку:
- •K Ca Se
- •У гостях у кислот
- •Хід уроку:
- •Лабораторні заняття Заняття 4
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 5
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Алгоритм
- •Модуль 3
- •Матеріали для самостійної роботи
- •Номенклатура неорганічних сполук
- •Хімічні сполуки
- •Катіони
- •Бінарні сполуки Оксигену (оксиди)
- •Основи, амфотерні гідроксиди
- •Кислоти
- •Солі та солеподібні сполуки
- •Координаційні сполуки
- •Органічні сполуки Алкани
- •Карбонові кислоти
- •Аміни і гетероциклічні сполуки
- •Лабораторні заняття Заняття 6
- •Семінарська частина
- •Практична частина
- •Аналіз уроку
- •Прийоми роботи учителя та учнів
- •Розподіл часу за етапами уроку і видами діяльності
- •Прийоми розвитку пізнавальних здібностей учнів
- •Характеристика особливостей даного уроку
- •Дотримання основних вимог до уроку і його результативність:
- •Самоаналіз уроку
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 7
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Визначте за хімічною формулою:
- •Заняття 8
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 4
- •Лабораторні заняття Заняття 9
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 10
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 11
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 5 Лекційний курс
- •Лабораторні заняття Заняття 12
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 13
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 6
- •Лабораторні заняття Заняття 14
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 15
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Заняття 16
- •Семінарська частина
- •Практична частина
- •Лабораторна частина
- •Завдання для самостійної роботи
- •Модуль 7 (Проект) завдання №1
- •Завдання №2
- •Завдання №3
- •Завдання №4
- •Завдання №5
- •Завдання №6
- •Завдання №7
- •Завдання №8
- •Завдання №9
- •Завдання №10
- •Завдання №11
- •Завдання №12
- •Завдання №13
- •Завдання №14
- •Завдання №15
- •Завдання №16
- •Завдання №17
- •Завдання №18
- •Завдання №19
- •Завдання №20
- •Завдання №21
- •Завдання №22
- •Завдання №23
- •Завдання №24
- •Завдання №25
- •Завдання №26
- •Завдання №27
- •Завдання №28
- •Завдання №29
- •Завдання №30
- •Рекомендована література
Заняття 15
Тема: Методичні принципи вивчення оксигеновмісних органічних сполук. Досліди при вивченні оксигеновмісних органічних сполук.
Мета: Провести структурно-логічний аналіз технології модульно-рейтингового навчання та елективного профільного навчання на прикладі вивчення алкенів. Відпрацювати методику проведення уроків за комбінованою системою. Закріпити вміння створювати проблемні ситуації. Відпрацювати техніку і методику хімічного експерименту при вивченні вуглеводнів.
Семінарська частина
Питання для обговорення
У чому особливість різнорівневого змісту освіти в технології модульно-рейтингового навчання?
Що таке додаткові модулі в технології модульно-рейтингового навчання?
Що таке елективні модулі в технології модульно-рейтингового навчання?
Яка структура модуля в технології модульно-рейтингового навчання?
Які організаційні форми навчання передбачає технологія модульно-рейтингового навчання?
Яка структура міні-модуля в технології модульно-рейтингового навчання?
У чому суть кожного етапу міні-модуля та яка їх структура?
Форми й методи роботи школярів на міні-модулі.
Що таке тьюторські заняття?
Методика формування рейтингової оцінки школяра.
У чому особливість проектної технології навчання?
Практична частина
Підібрати завдання для модульної контрольної роботи (“Оксигеновмісні органічні сполуки”).
Лабораторна частина
Дослід 1. Взаємодія спирту з натрієм. У пробірку з 1-2 мл абсолютного етилового спирту вкидають невеликий кусочок натрію, закривають пробірку пробкою з прямою газовідвідною трубкою і після витіснення повітря з пробірки підпалюють водень. Після того, як весь натрій прореагує, у пробірку капають фенолфталеїну. Чи зміниться забарвлення розчину?
Дослід 2. Кількісний дослід витіснення водню із спирту.
Зберіть прилад, як показано на малюнку. Коли прилад зібраний, виймають пробку із колби 1 і наливають із бюретки 3мл спирту, колбу повертають горизонтально, кладуть 2,5-3г дрібно нарізаних кусочків натрію. Колбу закріпляють у штативі і закривають пробкою. Натрій падає в спирт – починається реакція. Водень, що виділяється давить на воду в колбі 2 і витісняє її в колбу 3. Коли в колбу 3 перестає поступати вода, реакція вважається закінченою. Необхідно почекати декілька хвилин, щоб охолодилась колба 1. Внаслідок стиснення газу частина води з колби 3 знову перейде в колбу 2. За допомогою мірної посудини вимірюють об’єм води і колбі 3. Він дорівнює об’єму витісненого водню.
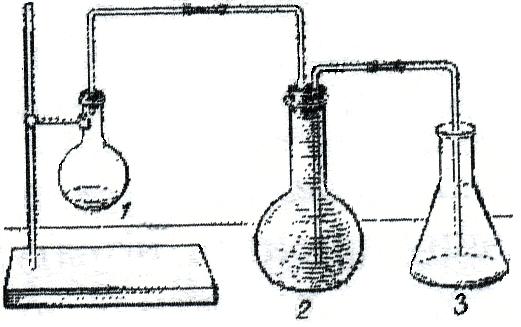
Об’єм витісненого водню доводять до нормальних умов за формулою:
![]()
Розрахуємо кількість моль водню, що витісняється з 1 моль спирту.
Створити проблемну ситуацію при виведенні структурної формули етилового спирту.
Дослід 3. Взаємодія гліцерину з натрієм. У пробірку з 2-3мл гліцерину кидають маленький кусочок натрію. Для початку реакції гліцерин можна злегка нагріти, після чого реакція йде досить енергійно. Гліцерин при цьому обвуглюється, а інколи й загорається.
Дослід 4. Утворення купрум(ІІ) гліцерату. У пробірку наливають 2-3 краплі розчину купрум(ІІ) сульфату, додають таку ж кількість розчину лугу до утворення осаду. До одержаного осаду купрум(ІІ) гідроксиду додають по краплях гліцерин до повного розчинення осаду. Для того, щоб одержати темно-синій розчин, слід брати невеликий надлишок лугу.
Дослід 5. Якісна реакція на альдегіди. а). У пробірку наливають 4-5 мл 2%-ного розчину аргентум нітрату, додають по краплях 2%-ний розчин амоній гідроксиду до розчинення утвореного спочатку коричневого осаду аргентум оксиду. До одержаного аміачного розчину аргентум оксиду доливають рівний об’єм формаліну (розчину метаналю) чи етаналю й обережно нагрівають на водяній бані. На стінках пробірки з’являється дзеркальний наліт.
б). У пробірку поміщають 2-3 краплі розчину купрум(ІІ) сульфату і стільки ж розчину натрій гідроксиду. При додаванні альдегіду та нагріванні купрум(ІІ) гідроксид відновлюється до купрум(І) оксиду – утворюється осад червоного кольору.
Дослід 6. Окиснення етилового спирту. Мідну спіраль добре прожарюють в полум’ї пальника і вносять у пробірку з етиловим спиртом. Спіраль знову стає жовтою, а з пробірки чути запах альдегіду.
Дослід 7. Основність оцтової кислоти. У невелику колбу чи хімічний стакан наливають 10 мл розчину оцтової кислоти (С=1моль/л) з 2-3 каплями фенолфталеїну. До кислоти поступово із бюретки доливають розчину натрій гідроксиду (С=1моль/л) до появи малинового забарвлення. Зробивши необхідні обчислення , визначають основність оцтової кислоти.
Дослід 8. Виявлення альдегідної групи в молекулі глюкози. Дослід проводять як з альдегідом. (Дослід 4).
Дослід 9. Виявлення спиртових груп у молекулі глюкози. (Дивись дослід 3).
Дослід 10. Добування складних ефірів. Налийте в суху пробірку 2 мл ізоамілового спирту, 2 мл льодяної оцтової кислоти і 1 краплю концентрованої сульфатної кислоти. Пробірку закривають пробкою із зворотним холодильником і нагрівають у киплячій водяній бані 8-10хв., після чого охолоджують реакційну суміш і виливають у пробірку з холодною водою. Складний ефір спливає на поверхні води. Пари ізоамілового (грушева есенція) подразнюють дихальні шляхи, можуть викликати кашель, тому нюхати його слід обережно.
Література: 6, 12*, 21, 27*, 28*, 43*, 45, 62, 72*, 89, 102*, 104, 107*, 113*, 104, 107*, 113*.
