
- •Содержание
- •Предисловие
- •Предисловие ко 2-му изданию
- •Введение
- •Этапы развития биотехнологии
- •Биотехнология сегодня
- •Биотехнологическое производство пищевых продуктов
- •Алкогольные напитки
- •Пивоварение
- •Ферментация в пищевой промышленности
- •Пищевые продукты и молочнокислое брожение
- •Этиловый спирт
- •1-Бутанол, ацетон
- •Уксусная кислота
- •Лимонная кислота
- •Молочная и глюконовая кислоты
- •Аминокислоты
- •L-Глутаминовая кислота
- •D,L-Метионин, L-лизин и L-треонин
- •Антибиотики
- •Антибиотики: источники, применение и механизмы действия
- •Антибиотики: получение. Устойчивость к антибиотикам
- •β-Лактамные антибиотики: промышленное получение
- •Гликопептидные, полиэфирные и нуклеозидные антибиотики
- •Аминогликозидные антибиотики
- •Тетрациклины, хиноны, хинолоны и другие ароматические антибиотики
- •Поликетидные антибиотики
- •Получение новых антибиотиков
- •Специальные продукты
- •Витамины
- •Нуклеозиды и нуклеотиды
- •Биодетергенты и биокосметика
- •Микробные полисахариды
- •Биоматериалы
- •Биотрансформация
- •Биотрансформация стероидов
- •Ферменты
- •Ферменты
- •Ферментативный катализ
- •Ферменты в клинических анализах
- •Тесты с помощью ферментов
- •Применение ферментов в промышленных технологиях
- •Ферменты в производстве моющих средств
- •Ферменты, расщепляющие крахмал
- •Ферментативное расщепление крахмала в промышленности
- •Ферментативное превращение сахаров
- •Утилизация целлюлозы и полиозы
- •Использование ферментов в целлюлозно-бумажной промышленности
- •Пектиназы
- •Ферменты в производстве молочных продуктов
- •Использование ферментов в хлебобулочной и мясоперерабатывающей промышленности
- •Ферменты в кожевенной и текстильной промышленности
- •Перспективы получения ферментов для промышленных технологий
- •Белковая инженерия
- •Пекарские и кормовые дрожжи
- •Пекарские и кормовые дрожжи
- •Белки и жиры из одноклеточных организмов
- •Аэробная очистка сточных вод
- •Анаэробная очистка сточных вод и переработка ила
- •Биологическая очистка газовых выбросов
- •Биологическая очистка почв
- •Микробиологическое выщелачивание руд и биокоррозия
- •Инсулин
- •Гормон роста и другие гормоны
- •Гемоглобин, сывороточный альбумин и лактоферрин
- •Факторы свертывания крови
- •Антикоагулянты и тромболитики
- •Ингибиторы ферментов
- •Иммунная система
- •Стволовые клетки
- •Тканевая инженерия
- •Интерфероны
- •Интерлейкины
- •Эритропоэтин и другие факторы роста
- •Другие белки, имеющие медицинское значение
- •Вакцины
- •Рекомбинантные вакцины
- •Антитела
- •Моноклональные антитела
- •Рекомбинантные и каталитические антитела
- •Методы иммуноанализа
- •Биосенсоры
- •Биотехнология в сельском хозяйстве
- •Животноводство
- •Перенос эмбрионов и клонирование животных
- •Картирование генов
- •Трансгенные животные
- •Генетическая ферма и ксенотрансплантация
- •Растениеводство
- •Культивирование растительных клеток: поверхностные культуры
- •Культивирование растительных клеток: суспензионные культуры
- •Трансгенные растения: методы получения
- •Трансгенные растения
- •Вирусы
- •Бактериофаги
- •Микроорганизмы
- •Бактерии
- •Некоторые бактерии, важные для биотехнологии
- •Грибы
- •Дрожжи
- •Усовершенствование штаммов микроорганизмов
- •Основы биотехнологических методов
- •Микроорганизмы: рост в искусственных условиях
- •Кинетика образования продуктов метаболизма и биомассы в культуре микроорганизмов
- •Технология ферментации
- •Промышленные процессы ферментации
- •Культивирование животных клеток
- •Биореакторы для культивирования животных клеток
- •Биореакторы с иммобилизованными ферментами и клетками
- •Очистка биотехнологических продуктов
- •Очистка биотехнологических продуктов: хроматографические методы
- •Экономические аспекты биотехнологического производства
- •Методы генетической инженерии
- •Структура ДНК
- •Функции ДНК
- •Эксперимент в генетической инженерии
- •Методы выделения ДНК
- •Ферменты, модифицирующие ДНК
- •ПЦР: лабораторная практика
- •ДНК: химический синтез и определение размера молекул
- •Секвенирование ДНК
- •Введение ДНК в живые клетки (трансформация)
- •Идентификация и клонирование генов
- •Экспрессия генов
- •Выключение генов
- •Геном прокариот
- •Геном эукариот
- •Геном человека
- •Функциональный анализ генома человека
- •ДНК-анализ
- •Белковые и ДНК-чипы
- •Маркерные группы
- •Тенденции развития
- •Генная терапия
- •Поиск биологически активных веществ
- •Протеомика
- •Обмен веществ
- •Метаболомика и метаболическая инженерия
- •Системная биология
- •«Белая» биотехнология
- •Сертификация биотехнологической продукции
- •Этические аспекты генетической инженерии
- •Патентование в биотехнологии
- •Биотехнология в разных странах
- •Биотехнология в разных странах
- •Литература
- •Источники иллюстраций
- •Указатель микроорганизмов
Техника безопасности, этические и экономические аспекты
Сертификация биотехнологической продукции
ВВЕДЕНИЕ. Производство и использование биотех- |
СЕРТИФИКАЦИЯ ПИЩЕВЫХ ПРОДУКТОВ. Из много- |
|||
нологических продуктов строго контролируется в |
численных продуктов питания, полученных методами |
|||
соответствии с Законом о защите прав потребителя. |
генетической инженерии, приведем лишь несколько |
|||
Правила сертификации в разных странах основаны |
примеров: трансгенные овощи, фрукты, мясо и рыба, |
|||
на одних и тех же принципах. Остановимся на сети- |
обладающие измененными свойствами по сравнению |
|||
фикации а) биофармацевтической продукции и |
с природными; мука и сахар, полученные с использо- |
|||
б) продуктов питания. |
|
|
ванием генетически модифицированных микроорга- |
|
ПРОЦЕДУРА СЕРТИФИКАЦИИ БИОФАРМАЦЕВТИЧЕС- |
низмов; пищевые добавки (декстрины и ксантан) – |
|||
КИХ ПРЕПАРАТОВ. Сертификация фармацевтиче- |
вещества, обнаруженные в природе и полученные в |
|||
ских продуктов находится в компетенции организа- |
виде рекомбинантных продуктов. В США такие проду- |
|||
ций здравоохранения: в США – Управление по |
кты используются с 1996 г., и ни разу не возникало |
|||
контролю качества пищевых продуктов и лекарств |
никаких осложнений. В странах ЕС, согласно дирек- |
|||
(FDA), в Германии – Государственный институт |
тиве о «новых пищевых продуктах», производитель |
|||
лекарственных средств и медицинской промышлен- |
обязан указывать на упаковке товара, что продукт |
|||
ности Министерства здравоохранения (BMG). На |
был получен методами генетической инженерии. Ис- |
|||
общеевропейском уровне координацию националь- |
ключение составляют природные или рекомбинант- |
|||
ных экспертиз осуществляет Европейское агентство |
ные ферменты (например, химозин). |
|||
по контролю за оборотом лекарственных средств |
ТРАНСГЕННЫЕ ОРГАНИЗМЫ В ПРИРОДЕ. В США с |
|||
(EMEA) в Лондоне. Получению сертификата пред- |
1995 г. законодательно разрешено нахождение |
|||
шествуют: а) тщательное изучение механизма дей- |
в природной среде трансгенного организма после |
|||
ствия и возможных побочных эффектов; б) состав- |
20-летнего наблюдения в лабораторных условиях, |
|||
ление |
подробной документации, |
касающейся |
однако это требует обязательного информирования |
|
метода получения; в) полноценный контроль каче- |
организаций, контролирующих экологическую без- |
|||
ства. В процедуре сертификации выделяют не- |
опасность. Этот закон касается трансгенных микро- |
|||
сколько этапов. В доклинических исследованиях |
организмов, растений и животных (в том числе их |
|||
проверяется биохимическая активность препарата и |
распространения через торговую сеть или иным об- |
|||
проводятся испытания на лабораторных животных с |
разом). В США использование трансгенных семян не |
|||
целью контроля его безопасности. В случае поло- |
имеет ограничений. В Европе с 2004 г. разрешено |
|||
жительных результатов доклинических исследова- |
использование генетически модифицированных (ГМ) |
|||
ний вещество получает статус «препарата, допущен- |
растений и произведенных из них пищевых продуктов |
|||
ного к клиническим испытаниям». На первой (I) |
и кормов. Использование ГМ-растений и продуктов, |
|||
фазе клинических испытаний препарат назначается |
полученных с применением ГМ-организмов, строго |
|||
небольшой группе здоровых добровольцев (конт- |
регламентируется, при этом требуется обязательная |
|||
роль безопасности), на второй (II) фазе – сравни- |
маркировка – ГМО. Научная экспертиза осуществ- |
|||
тельно большей группе пациентов (контроль безо- |
ляется Европейским ведомством безопасности пище- |
|||
пасности и действия), на заключительной третьей |
вых продуктов (EFSA) в Парме. В Германии законода- |
|||
(III) фазе – массовые испытания в крупных кли- |
тельство о ГМО, введенное с февраля 2005 г., |
|||
никах. Затраты на проведение клинических испыта- |
соответствует европейскому, например это касается |
|||
ний обычно превышают 100 млн долларов США, об- |
требований к методам идентификации ГМО-продук- |
|||
щая продолжительность |
клинических испытаний |
тов, сертификации, ограничений на гены, устойчивые |
||
при сертификации синтетических препаратов (хими- |
к антибиотикам, и сроков допуска ГМО-продукции, |
|||
ческих соединений) составляет 11 лет, а для био- |
которые установлены в 10 лет. Контроль за выполне- |
|||
фармацевтических препаратов – 9 лет. После тща- |
нием Закона возложен на Федеральное ведомство |
|||
тельного анализа всех полученных данных |
по защите прав потребителей (BVL), представитель- |
|||
принимается решение о выдаче сертификата. По |
ства которого есть в Берлине, Бонне и Брауншвейге. |
|||
статистике, из 5000 препаратов, успешно прошед- |
|
|||
ших доклинические исследования, лишь один пре- |
|
|||
парат получает сертификат. Параллельно с прове- |
|
|||
дением |
клинических |
испытаний |
создается |
|
подробная документация, относящаяся к получению препарата. При этом особое внимание уделяется очистке продукта от загрязнений химической, микробиологической или генетической природы.
286

|
Уровень продаж фармацевтической продукции (2004 г., некоторые предприятия Германии) |
|||||||
«Малые молекулы» |
|
|
|
37 |
|
|
|
|
(синтетические препараты) |
|
|
|
|
|
|||
Антитела и фрагменты антител |
|
18 |
Благодаря коротким срокам получения допуска |
|||||
Рекомбинантные белки |
|
|
17 |
прослеживается тенденция на применение биопрепаратов |
||||
|
|
|
|
|
||||
Прочее |
|
|
|
28 |
|
|
|
|
В 2004 г. в ЕС и США были допущены к употреблению около 60 биопрепаратов |
|
|||||||
|
Сертификация фармацевтических препаратов |
1 |
Открытие |
|||||
|
|
|
|
|
|
|
||
|
Этап 1 |
|
|
|
|
Этап 2 |
2 |
Испытания на животных |
|
Открытие |
|
|
|
|
|
3 |
I фаза клинических испытаний; |
|
|
|
|
|
Внедрение |
|
проверка безопасности препарата |
|
|
Клинические испытания |
|
|
|
||||
|
|
|
в производство |
|
на группе здоровых добровольцев |
|||
|
Получение |
|
|
|
|
|
|
(20–30 человек) |
|
|
|
|
|
|
|
4 |
II фаза клинических испытаний; |
|
|
|
|
|
|
|
|
проверка действия препарата на больных |
|
|
|
|
|
|
|
|
(100–300 пациентов) |
|
|
|
|
|
|
|
5 |
III фаза клинических испытаний; |
|
|
|
|
|
|
|
|
массовые испытания в крупных клиниках |
|
|
|
|
|
|
|
|
(1000–5000 пациентов) |
|
|
|
|
|
|
|
6 |
Разработка технологического |
|
|
|
|
|
|
|
|
процесса |
|
|
|
|
|
|
|
7 |
Конструирование оборудования |
|
|
|
|
|
|
|
8 |
Проверка на соответствие GMP |
|
|
|
|
|
|
|
9 |
Инспектирование |
|
|
|
|
|
|
|
Этап 1 Регистрация препарата в качестве |
|
|
|
|
|
|
|
|
|
«препарат, допущенный к клиническим |
|
|
|
|
|
|
|
|
испытаниям» |
|
|
|
|
|
|
|
Этап 2 Передача технологии на предприятие |
|
0 |
2 |
4 |
годы |
6 |
8 |
10 |
|
Авторское право действует 22 года |
|
|
|
|
|
|
|
|
|
|
Критерии для выдачи сертификата |
|
|
|
||||
Действие |
Действие медицинского препарата должно быть доказано, препарат не должен |
|
представлять опасности для общества* |
Безопасность |
По результатам доклинических и клинических испытаний оцениваются возможные |
применения |
побочные эффекты, они должны быть менее значительными, |
|
чем терапевтическое действие препарата |
Безопасность |
Процесс производства должен соответствовать принятым стандартам, |
производства |
степень очистки препарата – очень высокая. Продукт должен быть очищен |
|
от пирогенов, вирусной и бактериальной ДНК |
Другие критерии |
Цена продукта должна быть приемлемой |
|
|
* Исключение – наркотические вещества, применяемые при лечении некоторых заболеваний
Ферменты в качестве пищевых добавок
Рекомендации JECFA (объединенный экспертный комитет по пищевым добавкам при ВОЗ)
Ферменты из животных и растительных тканей |
Нет необходимости в проведении |
|
токсикологического исследования |
Ферменты из непатогенных микроорганизмов |
Проведение нескольких |
|
токсикологических тестов |
Ферменты из других микроорганизмов |
Продолжительное токсикологическое |
|
тестирование |
Ферменты из патогенных микроорганизмов |
Запрещены к применению |
287
аспекты |
Этические аспекты генетической инженерии |
||
ВВЕДЕНИЕ. Стремительное развитие генетической |
ных, как правило, не делают различия между целя- |
||
экономические |
инженерии в последние годы вызвало бурную общест- |
ми, для которых планируется получить трансгенное |
|
вых клеток; 3) клонирование эмбрионов человека; |
идентичных донору, – овцы, мыши, свиньи, коровы и |
||
|
венную реакцию, касающуюся перспектив этого раз- |
животное: для повышения выхода определенного |
|
|
вития, а также этические аспекты. К активно обсуж- |
продукта, экспрессии гетерологичного белка или для |
|
|
даемым этическим проблемам относятся следующие: |
изучения действия лекарственных препаратов (моде- |
|
|
1) изменение генетической информации любого ин- |
лирование наследственных заболеваний). |
|
|
дивидуума (организма); 2) использование генной те- |
КЛОНИРОВАНИЕ ЖИВОТНЫХ И ЧЕЛОВЕКА. Появле- |
|
|
рапии, в особенности с использованием зародыше- |
ние первых клонированных животных, полностью |
|
и |
4) терапия с использованием стволовых клеток; |
козы – вызвало бурное обсуждение этических вопро- |
|
этические |
женерия принята общественностью, однако дискуссии |
новесия (например, планируемый выбор пола |
|
|
5) генетические манипуляции с лабораторными |
сов, в особенности, в свете очевидной возможности |
|
|
животными, их клонирование; 6) опасность использо- |
клонирования человека (репродуктивное клонирова- |
|
|
вания генной инженерии в военных целях. В связи с |
ние). Клонирование человека может иметь неожи- |
|
|
явными практическими результатами генетическая ин- |
данные последствия для общего популяционного рав- |
|
безопасности, |
вокруг некоторых областей ее применения не утихают. |
ребенка). Группа исследователей из Кореи в 2004 г. |
|
ГЕНЕТИЧЕСКАЯ ИНФОРМАЦИЯ. Развитие генной ди- |
осуществила клонирование эмбриона человека и вы- |
||
|
|||
|
агностики, прежде всего связанные с успешным |
делила из него стволовые клетки. |
|
|
секвенированием генома человека, позволяют пред- |
ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ СТВОЛОВЫХ КЛЕТОК. |
|
|
положить, что в не столь отдаленном будущем пред- |
При обсуждении этических аспектов этой технологии |
|
|
сказание генетических болезней станет обычной |
прежде всего встает вопрос о том, начиная с какого |
|
|
процедурой, в частности, при пренатальном исследо- |
момента зародыша можно считать членом общества, |
|
Техника |
вании. В связи с этим возникает вопрос о том, как |
и, следовательно, у него появляются права, как у всех |
|
пациент, врач и общество должны распоряжаться по- |
граждан. В настоящее время активно изучаются воз- |
||
|
|||
|
лученной информацией. Должен ли плод быть уда- |
можности использования стволовых клеток взрослого |
|
|
лен, если исследование показало наличие генных де- |
человека для терапии тяжелых заболеваний. |
|
|
фектов и высок риск возникновения неизлечимой |
ИСПОЛЬЗОВАНИЕ В ВОЕННЫХ ЦЕЛЯХ. Современные |
|
|
болезни? Разъяснения также требует вопрос о том, |
методы биотехнологии позволяют получать большие |
|
|
в какой мере данные генетического анализа должны |
количества различного биологического материала, |
|
|
быть доступны общественности (например, в случае |
который может применяться как биологическое ору- |
|
|
использования генетического анализа для борьбы |
жие. Примером могут служить споры таких патоген- |
|
|
с преступностью), страховым компаниям и работо- |
ных микроорганизмов, как Bacillus anthrax. Сейчас |
|
|
дателям (оценка вероятности возникновения забо- |
уровень развития генетической инженерии настолько |
|
|
левания). |
высокий, что можно получать биологически активные |
|
|
ГЕННАЯ ТЕРАПИЯ. Для проведения генной терапии |
вещества, не вызывающие иммунной реакции. Так, |
|
|
с использованием соматических клеток требуется |
интерлейкин-4, ген которого экспрессируется виру- |
|
|
согласие пациента, поэтому очевидна необходимость |
сом оспы мышей, полностью нарушает функциониро- |
|
|
подробного разъяснения пациенту всех аспектов |
вание иммунной системы мыши. Несмотря на запрет |
|
|
лечения, в том числе и рисков. В случае генной тера- |
на распространение биологического оружия, согласно |
|
|
пии зародыша, естественно, изменение его генетиче- |
Женевской конвенции, в некоторых странах его про- |
|
|
ского материала осуществляется без его согласия. |
изводство до сих пор не прекращено. |
|
|
Многие методы генной терапии успешно применяются |
ОБЩЕСТВЕННАЯ РЕАКЦИЯ. Во всех развитых странах |
|
|
на лабораторных животных. |
использование в медицинских целях препаратов, |
|
|
ГЕНЕТИЧЕСКИЕ МАНИПУЛЯЦИИ. В отличие от генети- |
полученных генно-инженерным путем, принято обще- |
|
|
ческих манипуляций с микроорганизмами – проду- |
ственностью и широко распространено. Такая же си- |
|
|
центами ценных соединений, распространенных и |
туация наблюдается с генетически модифицирован- |
|
|
признанных практически повсеместно, использова- |
ными микроорганизмами, продуцирующими важные |
|
|
ние генетической инженерии в растениеводстве |
для промышленности ферменты. В то же время по- |
|
|
вызывает определенный общественный протест, свя- |
лучение и применение трансгенных животных |
|
|
занный с опасениями по поводу риска распростране- |
и растений вызывает бурный протест общественно- |
|
|
ния трасгенных растений, а также по поводу их |
сти, особенно если речь идет об их использовании |
|
|
применения в пищу. Создание трансгенных сельско- |
в пищевой промышленности. |
|
288 |
хозяйственных животных критикуется еще больше. |
|
|
При этом противники создания трансгенных живот- |
|
||
Научные и философские аргументы
Запрет
Некоторые поступки человека предосудительны: так, проводя генно-инженерные эксперименты, он пытается выступить в роли Бога. При этом человек разрушает природу.
 Прагматический подход
Прагматический подход 
Избавить больных людей от страданий – вот основная цель генетической инженерии. Безусловно, используемый для этого метод должен быть безопасен, и решение об осуществлении генетической диагностики и применении генной терапии должно приниматься пациентом после подробного разъяснения ему всех положительных и отрицательных сторон.
 Общественное мнение
Общественное мнение
Социальные последствия развития генетической инженерии абсолютно непредсказуемы. Медицинские применения методов генной терапии имеет ложные цели: значительно важнее профилактика заболеваний, чем их лечение. Негуманное использование достижений генетической инженерии неизбежно, и это может привести к безответственному отношению к человеческой жизни.
|
Вопросы, вызвающие наибольший протест общественности |
|
|
|
|
|||||
Тема |
|
|
|
Состояние развития |
Регуляция |
|
|
|
|
|
Клонирование |
|
|
|
Успешное клонирование |
Запрещено в большинстве государств |
|
||||
человека и животных |
|
|
|
|
|
|
|
|
||
Эксперименты |
|
|
|
Используется |
Разрешено с ограничениями |
|
|
|||
с эмбриональными |
|
|
в животноводстве |
|
|
|
|
|
||
стволовыми клетками |
|
|
|
|
|
|
|
|
||
Искусственное оплодотворение, |
Используется |
Искусственное оплодотворение разрешено, |
||||||||
выбор пола ребенка, использо- |
|
в животноводстве |
выбор пола ребенка запрещен |
|
||||||
вание суррогатной матери |
|
|
|
|
|
|
|
|||
Пренатальная диагностика |
|
Цитологические методы |
Разрешено, прерывание беременности только |
|||||||
|
|
|
|
|
используются, анализ |
по медицинским показаниям |
|
|
||
|
|
|
|
|
ДНК – значительно реже |
|
|
|
|
|
Оценка риска возникновения |
|
Возможно в случае |
Активно обсуждается, достаточно ли наличия |
|||||||
заболевания на основе |
|
моногенных заблеваний |
генного дефекта для предсказания болезни, |
|||||||
генетического анализа |
|
|
|
и насколько достоверен поставленный диагноз. |
||||||
|
|
|
|
|
|
Необходимо строгое установление сроков |
||||
|
|
|
|
|
|
прогноза, важных для работодателей |
|
|||
|
|
|
|
|
|
и страховых обществ |
|
|
|
|
Трансгенные животные |
|
|
Используется |
Принято, однако обсуждаются аспекты |
|
|||||
для получения |
|
|
|
|
защиты животных |
|
|
|
||
фармакологических продуктов |
|
|
|
|
|
|
|
|||
Получение продуктов питания |
|
Многие методы уже |
Обсуждаются аспекты защиты животных, |
|||||||
с использованием трансгенных |
|
используются |
защиты прав потребителей и экологических |
|||||||
растений и животных |
|
|
|
последствий |
|
|
|
|
||
Биотехнологическое получение |
Используется |
Повсеместно принято |
|
|
||||||
фармакологических продуктов |
|
|
|
|
|
|
|
|||
|
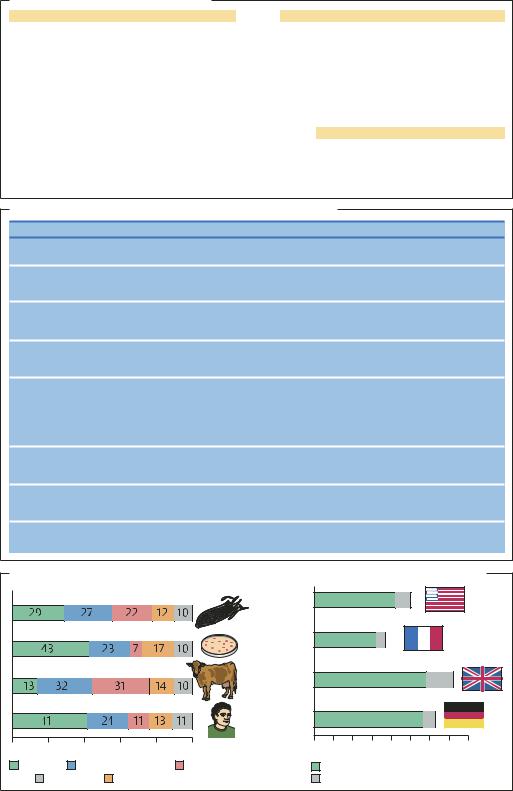
Общественная реакция на использование биотехнологии в различных областях (2001 г.) |
|||||||||
|
Сельскохозяйственные растения |
|
|
|
|
|
|
|||
|
Бактерии |
|
|
|
|
|
|
|
|
|
|
Сельскохозяйственные животные |
|
|
|
|
|
|
|||
|
Человек |
|
|
|
|
|
|
|
|
|
0 |
20 |
40 |
60 |
80 |
100 % |
0 |
20 |
40 |
60 |
80 % |
|
Согласие |
Частичное согласие |
Несогласие |
Положительный ответ |
|
|
||||
|
Нет ответа |
Мнение отсутствует |
Отрицательный ответ |
|
289 |
|||||
|
|
|
|
|
|
|
|
|
|
|
