
- •Содержание
- •Предисловие
- •Предисловие ко 2-му изданию
- •Введение
- •Этапы развития биотехнологии
- •Биотехнология сегодня
- •Биотехнологическое производство пищевых продуктов
- •Алкогольные напитки
- •Пивоварение
- •Ферментация в пищевой промышленности
- •Пищевые продукты и молочнокислое брожение
- •Этиловый спирт
- •1-Бутанол, ацетон
- •Уксусная кислота
- •Лимонная кислота
- •Молочная и глюконовая кислоты
- •Аминокислоты
- •L-Глутаминовая кислота
- •D,L-Метионин, L-лизин и L-треонин
- •Антибиотики
- •Антибиотики: источники, применение и механизмы действия
- •Антибиотики: получение. Устойчивость к антибиотикам
- •β-Лактамные антибиотики: промышленное получение
- •Гликопептидные, полиэфирные и нуклеозидные антибиотики
- •Аминогликозидные антибиотики
- •Тетрациклины, хиноны, хинолоны и другие ароматические антибиотики
- •Поликетидные антибиотики
- •Получение новых антибиотиков
- •Специальные продукты
- •Витамины
- •Нуклеозиды и нуклеотиды
- •Биодетергенты и биокосметика
- •Микробные полисахариды
- •Биоматериалы
- •Биотрансформация
- •Биотрансформация стероидов
- •Ферменты
- •Ферменты
- •Ферментативный катализ
- •Ферменты в клинических анализах
- •Тесты с помощью ферментов
- •Применение ферментов в промышленных технологиях
- •Ферменты в производстве моющих средств
- •Ферменты, расщепляющие крахмал
- •Ферментативное расщепление крахмала в промышленности
- •Ферментативное превращение сахаров
- •Утилизация целлюлозы и полиозы
- •Использование ферментов в целлюлозно-бумажной промышленности
- •Пектиназы
- •Ферменты в производстве молочных продуктов
- •Использование ферментов в хлебобулочной и мясоперерабатывающей промышленности
- •Ферменты в кожевенной и текстильной промышленности
- •Перспективы получения ферментов для промышленных технологий
- •Белковая инженерия
- •Пекарские и кормовые дрожжи
- •Пекарские и кормовые дрожжи
- •Белки и жиры из одноклеточных организмов
- •Аэробная очистка сточных вод
- •Анаэробная очистка сточных вод и переработка ила
- •Биологическая очистка газовых выбросов
- •Биологическая очистка почв
- •Микробиологическое выщелачивание руд и биокоррозия
- •Инсулин
- •Гормон роста и другие гормоны
- •Гемоглобин, сывороточный альбумин и лактоферрин
- •Факторы свертывания крови
- •Антикоагулянты и тромболитики
- •Ингибиторы ферментов
- •Иммунная система
- •Стволовые клетки
- •Тканевая инженерия
- •Интерфероны
- •Интерлейкины
- •Эритропоэтин и другие факторы роста
- •Другие белки, имеющие медицинское значение
- •Вакцины
- •Рекомбинантные вакцины
- •Антитела
- •Моноклональные антитела
- •Рекомбинантные и каталитические антитела
- •Методы иммуноанализа
- •Биосенсоры
- •Биотехнология в сельском хозяйстве
- •Животноводство
- •Перенос эмбрионов и клонирование животных
- •Картирование генов
- •Трансгенные животные
- •Генетическая ферма и ксенотрансплантация
- •Растениеводство
- •Культивирование растительных клеток: поверхностные культуры
- •Культивирование растительных клеток: суспензионные культуры
- •Трансгенные растения: методы получения
- •Трансгенные растения
- •Вирусы
- •Бактериофаги
- •Микроорганизмы
- •Бактерии
- •Некоторые бактерии, важные для биотехнологии
- •Грибы
- •Дрожжи
- •Усовершенствование штаммов микроорганизмов
- •Основы биотехнологических методов
- •Микроорганизмы: рост в искусственных условиях
- •Кинетика образования продуктов метаболизма и биомассы в культуре микроорганизмов
- •Технология ферментации
- •Промышленные процессы ферментации
- •Культивирование животных клеток
- •Биореакторы для культивирования животных клеток
- •Биореакторы с иммобилизованными ферментами и клетками
- •Очистка биотехнологических продуктов
- •Очистка биотехнологических продуктов: хроматографические методы
- •Экономические аспекты биотехнологического производства
- •Методы генетической инженерии
- •Структура ДНК
- •Функции ДНК
- •Эксперимент в генетической инженерии
- •Методы выделения ДНК
- •Ферменты, модифицирующие ДНК
- •ПЦР: лабораторная практика
- •ДНК: химический синтез и определение размера молекул
- •Секвенирование ДНК
- •Введение ДНК в живые клетки (трансформация)
- •Идентификация и клонирование генов
- •Экспрессия генов
- •Выключение генов
- •Геном прокариот
- •Геном эукариот
- •Геном человека
- •Функциональный анализ генома человека
- •ДНК-анализ
- •Белковые и ДНК-чипы
- •Маркерные группы
- •Тенденции развития
- •Генная терапия
- •Поиск биологически активных веществ
- •Протеомика
- •Обмен веществ
- •Метаболомика и метаболическая инженерия
- •Системная биология
- •«Белая» биотехнология
- •Сертификация биотехнологической продукции
- •Этические аспекты генетической инженерии
- •Патентование в биотехнологии
- •Биотехнология в разных странах
- •Биотехнология в разных странах
- •Литература
- •Источники иллюстраций
- •Указатель микроорганизмов
медицине |
Интерфероны |
|
||
личными клетками иммунной системы и служат сиг- |
||||
|
ВВЕДЕНИЕ. |
Интерфероны (IFN) секретируются раз- |
||
в |
нальными |
веществами: иммунный |
ответ клетки |
|
Биотехнология |
||||
обусловлен связыванием молекул |
интерферонов |
|||
|
||||
|
с INF-рецепторами. У млекопитающих выделяют |
|||
|
интерфероны трех типов: IFN-α, IFN-β и IFN-γ. Эти |
|||
|
молекулы вовлечены в регуляцию 20–30 генов и об- |
|||
|
ладают широким спектром иммунорегуляторных, |
|||
|
противовирусных и антипролиферативных (препятст- |
|||
|
вующих делению клеток) свойств. Молекулы IFN-α |
|||
|
и IFN-β стабильны при рН 5 и обладают сродством |
|||
|
к одному и тому же рецептору (IFN-рецептор I типа). |
|||
|
В отличие от IFN-α и IFN-β молекулы IFN-γ неустой- |
|||
|
чивы в кислой среде и связываются с рецепторами |
|||
|
другого типа (IFN-рецептор II типа). |
|
||
|
СВОЙСТВА И ПРИМЕНЕНИЕ. α-Интерфероны (IFN-α) |
|||
|
образуются в лейкоцитах. Их гены составляют семей- |
|||
|
ство из более 20 неаллельных генов, проявляющих |
|||
|
высокую степень гомологии. Молекулярная масса |
|||
|
этого полипептида –16 кДа, а гликозилированного до |
|||
|
26 кДа. В настоящее время IFN-α успешно применя- |
|||
|
ют для лечения гепатитов В и С, а также некоторых |
|||
|
злокачественных опухолей – рака мочевого пузыря, |
|||
|
меланомы, лейкемии и лимфомы. Объем мирового |
|||
|
рынка IFN-α в 2004 г. составил 3,2 млрд долл. США. |
|||
|
Синтез β-интерферона (IFN-β) происходит в фиб- |
|||
|
робластах. Полипептидная цепь IFN-β состоит из |
|||
|
166 аминокислотных остатков, а после гликозилиро- |
|||
|
вания ~20 кДа. IFN-β применяют при лечении рассе- |
|||
|
янного склероза. Объем рынка IFN-β достигает |
|||
|
1 млрд долл. США. Источником γ-интерферона слу- |
|||
|
жат активированные Т-лимфоциты. В свою очередь |
|||
|
IFN-γ активирует макрофаги. Белковая цепь содер- |
|||
|
жит 143 аминокислотных остатка, и в зависимости |
|||
|
от степени гликозилирования имеет молекулярную |
|||
|
массу 15–25 кДа. IFN-γ используют при лечении хро- |
|||
|
нического гранулематоза. Объем рынка IFN-γ состав- |
|||
|
ляет ~200 млн долл. США. В настоящее время ве- |
|||
|
дутся клинические испытания интерферонов в |
|||
|
терапии злокачественных опухолей (IFN-α, -β и -γ), |
|||
|
аутоиммунных заболеваний (IFN-α и -β), вирусных |
|||
|
инфекций (IFN-α и -β), ревматоидного артрита и ас- |
|||
|
тмы (IFN-γ). |
|
||
|
КЛОНИРОВАНИЕ И ЭКСПРЕССИЯ ГЕНОВ ИНТЕРФЕРО- |
|||
|
НОВ. Возможность терапевтического применения ин- |
|||
|
терферонов обсуждалась давно, однако традицион- |
|||
|
ный способ их получения путем фракционирования |
|||
|
донорской крови оказался неприменим для произ- |
|||
|
водства лекарственных препаратов. Лишь в 1986 г. с |
|||
|
помощью методов генетической инженерии удалось |
|||
|
наладить промышленное производство препаратов |
|||
|
интерферонов для клинического использования. |
|||
140 |
Клонирование генов этих белков, содержащихся в |
|||
крови в очень малых концентрациях, оказалось слож- |
||||
ной задачей, решение которой для IFN-α было найдено в 1982 г.. Процедура клонирования включала в себя следующие этапы. 1. Из лейкоцитов человека выделили мРНК, затем провели обратную транскрипцию и полученной кДНК трансформировали клетки Escherichia coli. Было получено 6000 клонов, которые разделили на группы. 2. Провели гибридизацию каждой группы клонов с неочищенным препаратом IFN-α-мРНК. 3. Осуществили трансляцию гибридных мРНК в бесклеточной системе и измерили противовирусную активность полученных белковых продуктов. 4. Провели экспрессию выбранных кДНК. Так как биологическая активность интерферона не зависит от степени его гликозилирования, для получения больших количеств белка часто используют клетки E. coli. В промышленных технологиях интерферонов используются и другие хозяева: Saccharomyces cerevisiae, Pichia pastoris, культуры животных клеток или молоко трансгенных животных.
ПОЛУЧЕНИЕ. В промышленности IFN-α начали получать с 1978 г. В качестве источника IFN-α использовали клетки лимфобластомы человека, индуцированные вирусом Сендай (клеточная линия Nawalma), в которых синтезировались по меньшей мере восемь различных изоформ IFN-α. В настоящее время почти все интерфероны получают из клеток рекомбинантных штаммов E. coli. Исключение – IFN-β1а, который получают из рекомбинантных клеток СНО. В клетках E. coli удается получать высокий выход продукта, затем белок очищают методами хроматографии. Так, фирма Roche производит интерферонα2а (Roferon A®) в рекомбинантных клетках E. coli К12. После выращивания клетки разрушают методом низкотемпературного замораживания, удаляют клеточные фрагменты центрифугированием, а белок очищают хроматографическими методами.

Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
Препараты интерферонов, допущенные к применению
Интерферон |
Назначение |
Фирма-производитель |
ПЭГ-IFN-α |
Гепатит В и С (ПЭГ: полиэтиленгликоль) |
Roche, Schering-Plough |
IFN-α2b |
Лейкоз, меланома, миелома |
Biogen, Yamanoochi, Enzon |
IFN-β |
Карцинома горла/носа, |
Rentschler |
|
вирусный энцефалит |
|
IFN-β1a |
Рассеянный склероз |
Biogen, Serono |
IFN-β1b |
Рассеянный склероз |
Berlex, Schering AG |
IFN-γ1a |
Ревматоидный артрит |
Rentschler |
IFN-γ1b |
Хронический гранулематоз |
Genentech, Boehringer-Ingelheim |
|
|
|
IFN-β1a производится с использованием культуры животных клеток СНО, остальные интерфероны синтезируются в рекомбинантных клетках E. coli
Структура молекулы |
Cтруктура молекулы |
|
Структура молекулы IFN-γ (IDC9) |
|
IFN-α (IITF) человека |
IFN-β (IA4I) свиньи; |
человека. Рентгеноструктурный |
||
по данным ЯМР |
рентгеноструктурный анализ, |
анализ, разрешение 0,3 нм |
||
|
разрешение 0,28 нм |
|
|
|
Получение |
|
|
|
|
IFN-α2a (Roche) |
|
IFN-γ1b (Boehringer-Ingelheim) |
IFN-γ |
|
Клетки E. coli |
|
Культура клеток СНО |
Трансгенные |
|
Рекомбинантные штаммы, различные |
Промотор SV40 |
козы |
||
|
||||
промоторы и сигнальные последовательности |
|
|
Вектор, несущий |
|
|
|
|
|
промотор |
Биореактор |
|
|
Биореактор |
β-лактоглобулина |
|
|
и ген IFN-γ |
||
Ферментация в среде |
|
Суспензия культуры |
человека |
|
|
|
|||
с высоким содержанием клеток |
|
|
|
|
Выделение |
|
|
Выделение |
|
Выделение телец включения, |
|
4–5 хроматографических |
|
|
методы обычной и иммунохроматографии |
разделений |
|
||
До 10 мг/л после 24 ч ферментации, |
До 1 мг/л жидкой культуры |
До 500 мг/л молока |
||
реализация с ПЭГ |
|
|||
|
|
|
|
|
|
Контроль качества продукта |
|
||
Иммунный анализ, пептидное картирование, НДС-ПЭГ-электрофорез, обращенно-фазовая ВЭЖХ, |
||||
спектрофотометрический анализ, масс-спектроскопия MALDI-TOF, проверка биологической активности |
||||
|
|
|
|
141 |
Биотехнология в медицине
142
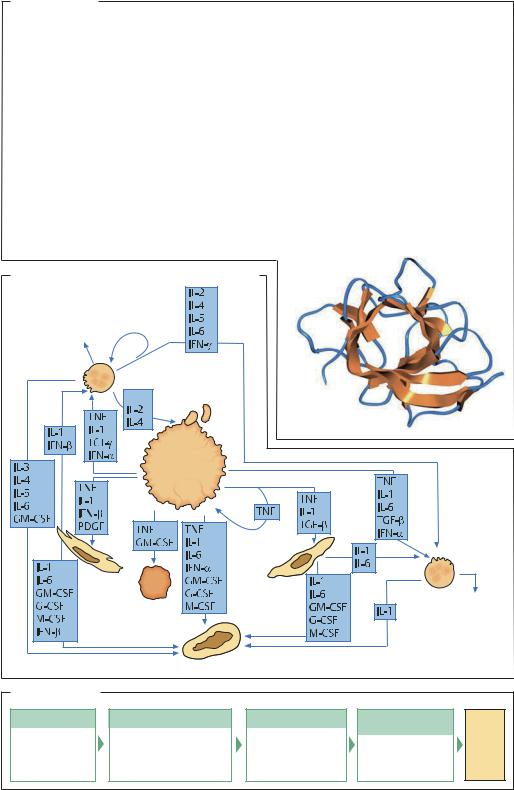
Интерлейкины
ВВЕДЕНИЕ. Интерлейкины (IL) – сигнальные вещест- |
Действие интерлейкина-6 (IL-6) аналогично эффекту |
||
ва, которые вырабатываются одними клетками им- |
IL-1 и IL-2, кроме того, он активирует экспрессию раз- |
||
мунной системы и служат для регуляции активности |
личных белков (так называемых белков острой фазы) |
||
других клеток. Поэтому их часто называют «гормона- |
в гематоцитах и, вероятно, задействован в развитии |
||
ми иммунной системы». У человека охарактеризова- |
аутоиммунных заболеваний. Интерлейкин-10 (IL-10) |
||
ны более 20 типов интерлейкинов (IL-1–IL-23). Из |
является ингибитором синтеза других цитокинов. Ин- |
||
них IL-2 уже применяется в медицине, а другие ин- |
терлейкин-12 (IL-12) стимулирует синтез γ-интерфе- |
||
терлейкины находятся на стадии исследования. |
рона Т-лимфоцитами и NK-клетками и, как предпола- |
||
СВОЙСТВА И ПРИМЕНЕНИЕ. Интерлейкин-1 существу- |
гают, играет важную роль в осуществлении и |
||
ет в двух формах (IL-1α и IL-1β). Он синтезируется |
регуляции иммунного ответа. Подавляющее большин- |
||
фагоцитирующими клетками иммунной системы (ма- |
ство исследований, направленных на изучение воз- |
||
крофагами и моноцитами) в виде предшественника |
можности терапевтического применения рекомби- |
||
(молекулярная масса 31 кДа), который в результате |
нантных интерлейкинов, связано с терапией рака. |
||
протеолитического |
расщепления |
превращается |
Кроме того, интерлейкины могли бы применяться для |
в зрелую форму (молекулярная масса 17,5 кДа). |
заживления ран, активации иммунитета у больных |
||
Биологическая функция IL-1 заключается в стимуля- |
СПИДом и супрессии иммунной системы при транс- |
||
ции роста лимфоцитов, фибробластов, гематопоэти- |
плантации костного мозга и развитие многочисленных |
||
ческих клеток и тимоцитов. Обнаружены рецепторы |
антагонистов интерлейкинов. |
||
IL-1 двух типов: рецепторы I типа находятся на поверх- |
ПОЛУЧЕНИЕ ИНТЕРЛЕЙКИНОВ. Для осуществления |
||
ности Т-клеток и |
фибробластов, |
а рецепторы |
биологической функции IL-2 и для медицинских |
II типа – на В-лимфоцитах. Вероятный механизм дей- |
целей неважно, гликозилирован белок или нет, |
||
ствия IL-1 следующий: после того как макрофаг |
поэтому рекомбинантный IL-2 получают из клеток |
||
встретился с антигеном и осуществил его протеолити- |
Escherichia coli. В культурах со средней или повы- |
||
ческое расщепление, он начинает секретировать |
шенной плотностью клеток значительная часть экс- |
||
IL-1, который стимулирует пролиферацию и размно- |
прессированного белка оказывается в составе телец |
||
жение клеток иммунной системы. На следующей ста- |
включения, которые сначала очищают методом |
||
дии развития иммунного ответа решающая роль при- |
гель-хроматографии, затем солюбилизируют в вос- |
||
надлежит IL-2 – так называемому «фактору роста |
станавливающих условиях, а потом белок осаждают |
||
Т-клеток». IL-2 охарактеризован лучше других типов |
в окислительных условиях. Дальнейшую очистку |
||
интерлейкинов. Он вырабатывается активированными |
проводят методом ВЭЖХ, осаждением и гель- |
||
Т-клетками и стимулирует деление и рост Т- и В-кле- |
фильтрацией. Активность определяют по включению |
||
ток. Активированные Т-клетки секретируют IL-2, а так- |
Н3-меченого тимидина в IL-2-зависимые T-клетки |
||
же рецепторы, которые находятся на поверхности кле- |
мыши и развитию многочисленных антагонистов ин- |
||
ток, таким образом процесс пролиферации Т-клеток |
терлейкинов. |
||
может идти непрерывно. Другое действие IL-2 заклю- |
|
||
чается в стимуляции клеток-киллеров (NK-клеток – от |
|
||
англ. natural killer) и моноцитов с помощью рецепторов IL-2 на поверхности этих клеток. В настоящее время уже получены рентгеноструктурные данные для IL-2 – гидрофильного гликопротеина, МR 15,5 (133 аминокислотных остатка). В медицине IL-2 используют в терапии опухолей, в частности почечно-клеточного рака. IL-3 представляет собою гликопротеин, состоящий из 133 аминокислот. Он синтезируется активированными Т-лимфоцитами и действует на плюрипотентные стволовые клетки в костном мозге, стимулируя созревание лимфоцитов (нейтрофилов и макрофагов) и других клеток-предшественников иммунной системы. По этой причине IL-3 еще называют мультипотентным колониестимулирующим фактором. Ин- терлейкин-4 (IL-4) – гликопротеин, МR 20, который действует на В-клетки, активируя их дифференцировку с преимущественной продукцией IgG и IgE, а также способствует презентации антигенов моноцитами.
Интерлейкины
|
Клиническое применение |
Производитель |
Фаза испытаний |
IL-1 |
Гематопоэз |
Roche/Immunex |
Допущен к применению |
IL-1R |
Астма |
Immunex |
Допущен к применению |
IL-1RA |
Ревматоидный артрит |
Amgen |
Допущен к применению |
IL-2PEG |
ВИЧ |
Chiron |
Допущен к применению |
IL-2 |
Рак почек |
Chiron |
Допущен к применению |
IL-3 |
Трансплантация стволовых клеток |
Sandoz |
Фаза III |
IL-4 |
Рак легких |
Schering-Plough |
Фаза II |
IL-6 |
Тромбоцитопения |
Serono |
Фаза I/II |
IL-8RA |
Воспалительные процессы |
Repligen |
Последние стадии клинических испытаний |
IL-10 |
Злокачественные опухоли, |
Schering-Plough |
Последние стадии клинических испытаний |
|
аутоиммунные заболевания |
|
|
IL-11 |
Тромбоцитопения |
Genetics Institute, |
Фаза III |
|
|
Schering-Plough |
|
IL-12 |
ВИЧ, карциномы |
Genetics Institute, |
Фаза I/II |
|
|
Wyeth-Ayerst |
|
IL-15 |
Инфекционные болезни, |
Immunex |
Последние стадии клинических испытаний |
|
мукозит |
|
|
|
|
|
|
Система взаимодействий в иммунной системе
Стимуляция или подавление других Т- и В-клеток, макрофагов, уничтожение инфицированных клеток
Т-клетки
Бактерии, несущие специфические
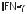 липополисахариды
липополисахариды
Макрофаги
Структура
IL-1α (2/1А). Рентгеноструктурный анализ, разрешение 0,20 нм
Клетки |
В-клетки |
|
эндотелия |
||
|
Фибробласты
Полиморфно- |
Пролиферируют |
|
и приобретают |
||
ядерные |
||
способность |
||
лейкоциты |
||
к образованию |
||
|
||
|
антител |
|
Костный мозг синтезирует новые клетки крови |
|
|
|
Получение IL-2 |
|
|
|
|
E. coli |
Биореактор |
Выделение |
Контроль |
|
|
|
|
качества продукта |
|
Рекомбинантный |
Объем до 1000 л, |
Получение фракции |
SDS-электрофорез, |
Чистый |
штамм, |
ферментация в среде |
телец включения, |
пептидное |
IL-2 |
устойчивый |
со средним или высоким |
хроматографические |
картирование, |
|
к тетрациклину |
содержанием клеток |
методы |
ELISA и т. д. |
|
|
|
|
|
143 |
