
- •Содержание
- •Предисловие
- •Предисловие ко 2-му изданию
- •Введение
- •Этапы развития биотехнологии
- •Биотехнология сегодня
- •Биотехнологическое производство пищевых продуктов
- •Алкогольные напитки
- •Пивоварение
- •Ферментация в пищевой промышленности
- •Пищевые продукты и молочнокислое брожение
- •Этиловый спирт
- •1-Бутанол, ацетон
- •Уксусная кислота
- •Лимонная кислота
- •Молочная и глюконовая кислоты
- •Аминокислоты
- •L-Глутаминовая кислота
- •D,L-Метионин, L-лизин и L-треонин
- •Антибиотики
- •Антибиотики: источники, применение и механизмы действия
- •Антибиотики: получение. Устойчивость к антибиотикам
- •β-Лактамные антибиотики: промышленное получение
- •Гликопептидные, полиэфирные и нуклеозидные антибиотики
- •Аминогликозидные антибиотики
- •Тетрациклины, хиноны, хинолоны и другие ароматические антибиотики
- •Поликетидные антибиотики
- •Получение новых антибиотиков
- •Специальные продукты
- •Витамины
- •Нуклеозиды и нуклеотиды
- •Биодетергенты и биокосметика
- •Микробные полисахариды
- •Биоматериалы
- •Биотрансформация
- •Биотрансформация стероидов
- •Ферменты
- •Ферменты
- •Ферментативный катализ
- •Ферменты в клинических анализах
- •Тесты с помощью ферментов
- •Применение ферментов в промышленных технологиях
- •Ферменты в производстве моющих средств
- •Ферменты, расщепляющие крахмал
- •Ферментативное расщепление крахмала в промышленности
- •Ферментативное превращение сахаров
- •Утилизация целлюлозы и полиозы
- •Использование ферментов в целлюлозно-бумажной промышленности
- •Пектиназы
- •Ферменты в производстве молочных продуктов
- •Использование ферментов в хлебобулочной и мясоперерабатывающей промышленности
- •Ферменты в кожевенной и текстильной промышленности
- •Перспективы получения ферментов для промышленных технологий
- •Белковая инженерия
- •Пекарские и кормовые дрожжи
- •Пекарские и кормовые дрожжи
- •Белки и жиры из одноклеточных организмов
- •Аэробная очистка сточных вод
- •Анаэробная очистка сточных вод и переработка ила
- •Биологическая очистка газовых выбросов
- •Биологическая очистка почв
- •Микробиологическое выщелачивание руд и биокоррозия
- •Инсулин
- •Гормон роста и другие гормоны
- •Гемоглобин, сывороточный альбумин и лактоферрин
- •Факторы свертывания крови
- •Антикоагулянты и тромболитики
- •Ингибиторы ферментов
- •Иммунная система
- •Стволовые клетки
- •Тканевая инженерия
- •Интерфероны
- •Интерлейкины
- •Эритропоэтин и другие факторы роста
- •Другие белки, имеющие медицинское значение
- •Вакцины
- •Рекомбинантные вакцины
- •Антитела
- •Моноклональные антитела
- •Рекомбинантные и каталитические антитела
- •Методы иммуноанализа
- •Биосенсоры
- •Биотехнология в сельском хозяйстве
- •Животноводство
- •Перенос эмбрионов и клонирование животных
- •Картирование генов
- •Трансгенные животные
- •Генетическая ферма и ксенотрансплантация
- •Растениеводство
- •Культивирование растительных клеток: поверхностные культуры
- •Культивирование растительных клеток: суспензионные культуры
- •Трансгенные растения: методы получения
- •Трансгенные растения
- •Вирусы
- •Бактериофаги
- •Микроорганизмы
- •Бактерии
- •Некоторые бактерии, важные для биотехнологии
- •Грибы
- •Дрожжи
- •Усовершенствование штаммов микроорганизмов
- •Основы биотехнологических методов
- •Микроорганизмы: рост в искусственных условиях
- •Кинетика образования продуктов метаболизма и биомассы в культуре микроорганизмов
- •Технология ферментации
- •Промышленные процессы ферментации
- •Культивирование животных клеток
- •Биореакторы для культивирования животных клеток
- •Биореакторы с иммобилизованными ферментами и клетками
- •Очистка биотехнологических продуктов
- •Очистка биотехнологических продуктов: хроматографические методы
- •Экономические аспекты биотехнологического производства
- •Методы генетической инженерии
- •Структура ДНК
- •Функции ДНК
- •Эксперимент в генетической инженерии
- •Методы выделения ДНК
- •Ферменты, модифицирующие ДНК
- •ПЦР: лабораторная практика
- •ДНК: химический синтез и определение размера молекул
- •Секвенирование ДНК
- •Введение ДНК в живые клетки (трансформация)
- •Идентификация и клонирование генов
- •Экспрессия генов
- •Выключение генов
- •Геном прокариот
- •Геном эукариот
- •Геном человека
- •Функциональный анализ генома человека
- •ДНК-анализ
- •Белковые и ДНК-чипы
- •Маркерные группы
- •Тенденции развития
- •Генная терапия
- •Поиск биологически активных веществ
- •Протеомика
- •Обмен веществ
- •Метаболомика и метаболическая инженерия
- •Системная биология
- •«Белая» биотехнология
- •Сертификация биотехнологической продукции
- •Этические аспекты генетической инженерии
- •Патентование в биотехнологии
- •Биотехнология в разных странах
- •Биотехнология в разных странах
- •Литература
- •Источники иллюстраций
- •Указатель микроорганизмов
Ферменты |
Ферменты |
ВВЕДЕНИЕ. Применение ферментов животного, рас- |
|
тительного и микробного происхождения в промыш- |
|
|
ленном производстве или в аналитических целях |
|
началось около 100 лет назад. В 1970 г. иммобили- |
|
зованые ферменты были впервые использованы как |
|
биокатализаторы для химического превращения ве- |
|
щества (ферментативная трансформация). Развитие |
|
методов генетической инженерии и возможность по- |
|
лучения рекомбинантных белков с измененными |
|
свойствами открывает новые перспективы фермен- |
|
тации. |
|
КЛАССИФИКАЦИЯ ФЕРМЕНТОВ. В соответствии с ме- |
|
ждународной классификацией ферменты разделены |
|
на 6 классов, согласно типам реакций, которые они |
|
катализируют. К настоящему времени описаны тыся- |
|
чи разнообразных ферментов с различными функция- |
|
ми. Как правило, ферменты с аналогичными функци- |
|
ями, выделенные из разных организмов, несколько |
|
отличаются по структуре. При оценке возможностей |
|
использования фермента в биотехнологии необходи- |
|
мо располагать данными о его биологических свойст- |
|
вах. Так, около трети всех описанных ферментов яв- |
|
ляются мембраносвязанными, они нестабильны в |
|
очищенном виде. Для осуществления ферментатив- |
|
ной реакции многим оксидоредуктазам, трансфера- |
|
зам, лигазам и синтазам необходимы кофакторы, на- |
|
пример NADH, ATФ или кофермент А, поэтому |
|
использование таких ферментов в биотехнологиче- |
|
ских целях не всегда экономически выгодно из-за вы- |
|
соких цен на кофакторы. Гидролазам и изомеразам |
|
кофакторы не требуются, поэтому эти ферменты ши- |
|
роко используются в промышленности. Для большин- |
|
ства аналитических и диагностических исследований |
|
особенно важна высокая специфичность ферментов |
|
по отношению к субстрату. |
|
ПОЛУЧЕНИЕ ФЕРМЕНТОВ. Способ выделения и очист- |
|
ки фермента зависит от источника (животные, расти- |
|
тельные или микробные клетки), конкретной задачи, |
|
необходимого количества, а также биологических |
|
свойств фермента (растворимый или мембраносвя- |
|
занный белок). Ферменты, секретируемые во внекле- |
|
точное пространство, удается получать в больших ко- |
|
личествах (например, протеазы для производства |
|
стиральных порошков). В этом случае процедура очи- |
|
стки фермента значительно упрощена: после отделе- |
|
ния клеток следует стадия концентрирования культу- |
|
ральной жидкости методом ультрацентрифугирования |
|
или осаждения. Затем – высушивание распылением |
|
или в псевдоожиженном слое, после чего препарат |
|
фермента готов к промышленному использованию. |
|
Полученные таким способом препараты часто содер- |
|
жат значительные примеси посторонних белков, |
74 |
поэтому при их применении могут иметь место побоч- |
ные ферментативные реакции. В промышленности |
эти посторонние активности часто не влияют на производственный процесс. Для диагностических, аналитических и терапевтических целей чаще используют внутриклеточные ферменты, и в этом случае необходимы препараты ферментов с высокой степенью очистки. После разрушения клеток клеточный дебрис удаляют центрифугированием, а внутриклеточное содержимое концентрируют. Затем для удаления посторонних белков последовательно проводят несколько стадий хроматографического разделения компонентов полученного раствора. Степень очистки фермента определяют по следующим критериям: 1) удельная активность фермента; 2) активность других компонентов препарата; 3) электрофоретическая картина разделения компонентов препарата. Многие ферменты, использующиеся в промышленности, получены путем ферментации в рекомбинантных штаммах микроорганизмов. Методы генетической инженерии позволяют получать продукт с меньшим числом побочных активностей, следовательно, его очистка требует значительно меньших затрат.
РАЗРЕШЕНИЕ НА ИСПОЛЬЗОВАНИЕ. Ферменты являются природными белками, поэтому их использование во всех областях, за исключением пищевой промышленности или медицины, не требует специальных разрешений. Компоненты пищевых продуктов, полученные из природного сырья с помощью ферментов (например, изоглюкоза), относятся к «природным» и применяются наравне с естественными. В соответствии с постановлениями Международной ассоциации производителей ферментов для пищевой промышленности (AMFEP), при производстве продуктов питания разрешено использование ферментов животного и растительного происхождения, а также продуктов так называемых «безопасных» микробных штаммов. Применение ферментов, выделенных из других микроорганизмов, разрешается лишь после прохождения многочисленных и весьма дорогостоящих процедур тестирования и утверждения, поэтому использование таких ферментов в промышленных масштабах оказывается экономически невыгодным.
Классификация ферментов и примеры
ЕС-номер |
Название, функция |
Кофактор |
Примеры |
|
|
|
|
1.x.y.z |
Оксидоредуктазы |
|
|
1.1.y.z |
Действуют на СН–ОН-группу |
NAD+, NADP+, PQQ |
Алкогольдегидрогеназа |
1.1.3.z |
Действуют на СН–ОН-группу |
FAD+ |
Глюкозооксидаза |
1.3.y.z |
Действуют на С–Н-группу |
Гем, Fe2+ |
Стероид-11β-гидроксилаза |
2.x.y.z |
Трансферазы |
|
|
2.4.y.z |
Переносят гликозильные группы |
|
Гликозилтрансфераза |
2.6.1.z |
Переносят NH2-группы на С=О |
Пиридоксальфосфат |
Трансаминаза |
3.x.y.z |
Гидролазы |
|
|
3.1.y.z |
Гидролизуют эфирные связи |
|
Липазы, эстеразы |
3.2.y.z |
Гидролизуют гликозидные связи |
|
α-Амилаза |
3.4.y.z |
Гидролизуют пептидные связи |
|
Субтилизин, трипсин |
4.x.y.z |
Лиазы |
|
|
|
Катализируют реакции присоединения по двойным связям |
|
|
4.x.y.z |
Добавление (удаление) NH2-группы к (от) двойной связи |
Аспартаза |
|
5.x.y.z |
Изомеразы |
|
|
5.1.y.z |
Рацемизация D- и L-аминокислот |
|
Аланинрацемаза |
5.3.y.z |
Внутримолекулярные оксидоредуктазы |
|
Ксилозо(глюкозо)-изомераза |
6.x.y.z |
Лигазы |
|
|
6.2.y.z |
Образование C–S связей |
|
ATФ, КоА-SH |
Ацетил-КоА-синтетаза |
||
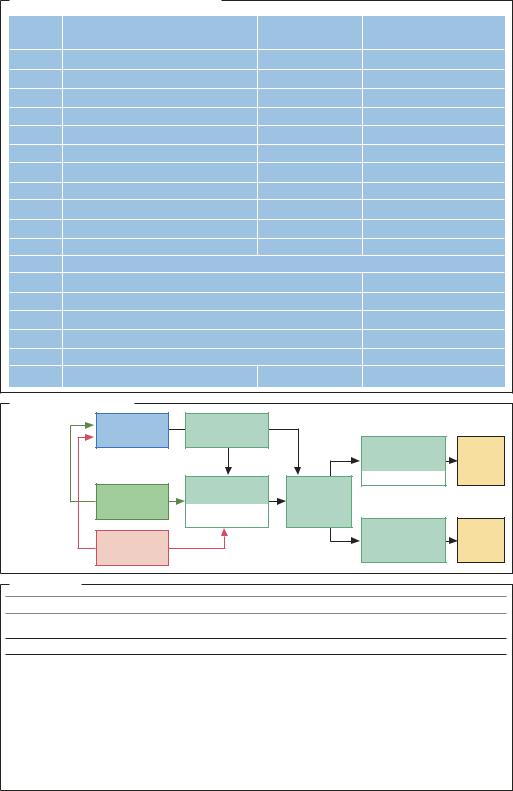
Получение ферментов |
|
|
|
|
||
|
|
Микро- |
Ферментация |
|
|
|
|
|
организмы |
|
|
|
|
|
|
|
|
Высушивание |
Техни- |
|
|
|
|
|
|
||
|
|
|
|
|
в псевдо- |
ческие |
|
|
|
|
|
ожиженном слое |
фер- |
|
|
|
Выделение |
|
гранулирование |
менты |
|
|
|
|
|
|
|
Клонирование |
|
Растительный |
из клеток |
Концент- |
|
|
и экспрессия |
|
материал |
отделение |
рирование |
|
|
|
|
|
твердых частиц |
|
|
Аналити- |
|
|
|
|
|
|
|
|
|
Животный |
|
|
Тонкая очистка |
ческие |
|
|
|
|
фер- |
||
|
|
материал |
|
|
|
менты |
Применение |
|
|
|
|
|
|
Источник |
|
Примеры |
|
|
Применение |
|
Животные ткани |
Панкреатические ферменты, |
|
в соответствии с GMP* |
|
||
|
|
сычужный фермент, пепсин |
|
|
|
|
Растительные ткани |
Папаин, бромелаин |
|
в соответствии с GMP* |
|
||
Микроорганизмы: |
|
|
|
|
|
|
а) традиционно исполь- |
Bacillus subtilis, Aspergillus niger и A. oryzae, |
GRAS (generally recognized as safe) – |
|
зуемые для получения |
Mucor javanicus, Rhizopus sp., Saccharomyces |
признаны безопасными в соответствии |
|
продуктов питания |
cerevisiae, Kluyveromyces fragilis и K. lactis, |
с положениями AMFEP (Международная |
|
|
Leuconostoc oenus |
ассоциация производителей ферментов |
|
|
|
для пищевой промышленности) |
|
б) ферменты |
Bacillus stearothermophilus, B. licheniformis, |
Специальная процедура |
|
хорошо изученных |
B. coagulans, B. megaterium и B. circulans, |
согласования |
|
микроорганизмов |
Klebsiella aerogenes |
|
|
* GMP (good manufacturing practice) – «Правила организации производства и контроля качества лекарственных средств», |
|||
принятые Всемирной организацией здравоохранения. — Прим. перев. |
75 |
||
|
|
||
Ферменты |
Ферментативный катализ |
в реакциях химического синтеза связаны с |
|
|
ВВЕДЕНИЕ. Преимущества использования ферментов |
|
в их высокой субстратной специфичностью. В про- |
|
мышленности, как правило, применяют ферменты, |
|
которые не требуют дополнительных кофакторов: |
|
гидролазы, лиазы, изомеразы и некоторые оксидоре- |
|
дуктазы. К настоящему времени гены многих фер- |
|
ментов клонированы, поэтому появилась возмож- |
|
ность получать эти ферменты без побочных |
|
активностей и с некоторыми улучшенными в резуль- |
|
тате генно-инженерных манипуляций свойствами. |
|
ОКСИДОРЕДУКТАЗЫ. На сегодняшний день охаракте- |
|
ризованно около 850 оксидоредуктаз. Эти ферменты |
|
катализируют окислительно-восстановительные ре- |
|
акции в присутствии кофермента. В случае оксидаз |
|
коферментом является молекула ФАД, ковалентно |
|
связанная с ферментом. Оксидоредуктазы широко |
|
применяются в аналитических методах. Дегидрогена- |
|
зы используются для аналитических, а также препа- |
|
ративных целей в качестве восстановителей карбок- |
|
сильных или окислителей гидроксильных групп. |
|
Процедура очистки кофакторов, например NAD(P)+ |
|
или NAD(P)H, требует значительных затрат, поэтому |
|
использование этих веществ в очищенном виде явля- |
|
ется экономически невыгодным. Часто в технологи- |
|
ческий процесс включают дополнительную реакцию с |
|
недорогими субстратами, в результате которой обра- |
|
зуются необходимые кофакторы. Значительными |
|
преимуществами обладает мембранный фермента- |
|
тивный реактор, в котором для синтеза кофактора |
|
используется производное NAD(P)H и формиатде- |
|
гидрогеназа. В последнее время ведутся активные |
|
исследования возможностей применения перокси- |
|
даз, диоксигеназ и Р450-монооксигеназ, катализи- |
|
рующих определенные реакции гидроксилирования. |
|
Эти ферменты содержат железо-серный кластер или |
|
гемовую группу, играющие роль кофактора. |
|
ТРАНСФЕРАЗЫ. К настоящему времени известно |
|
около 950 ферментов, относящихся к классу транс- |
|
фераз. В промышленности эти ферменты не находят |
|
применения. |
|
ГИДРОЛАЗЫ. К классу гидролаз относится более |
|
1000 ферментов, в том числе протеазы, липазы и |
|
эстеразы, имеющие большое значение в современ- |
|
ной биотехнологии. По сути эти ферменты можно |
|
рассматривать как трансферазы, переносящие ту или |
|
иную группу на молекулу воды. Гидролазы катализи- |
|
руют гидролиз связей С–О, C–N, C–C и др. и могут |
|
применяться для синтеза или гидролиза сложных |
|
эфиров и амидов. Так, термолизин, выделенный из |
|
Bacillus stearothermophilus, используют для синтеза |
|
аспартама из L-аспарагиновой кислоты и L-фенил- |
76 |
аланина, пенициллинамидазу из клеток E. coli – для |
гидролиза пенициллина G до 6-аминопенициллано- |
вой кислоты. Липаза из Pseudomonas cepacia служит для промышленного производства аминов из пред- шественников-амидов, липаза из Serratia marcescens используется для энантиоселективного гидролиза оксирана – предшественника дилтиазема, применяемого для снижения кровяного давления. С помощью липазы из клеток Rhizomucor miehei производят синтетическое масло какао, а ацилазу аминокислот из Aspergillus oryzae применяют для энантиоселективного гидролиза N-ациламинокислот.
ЛИАЗЫ. К лиазам относятся ферменты, которые разрывают связи С–С, С–О, С–N и др., при этом не требуется наличия кофакторов. К настоящему времени описано более 300 лиаз. Аспартазу из E. coli используют для промышленного производства L-аспа- рагиновой кислоты из фумаровой. Процедура очистки фермента требует дополнительных затрат, поэтому в промышленности используют целые клетки E. coli, а не выделенный фермент. Акрилонитрилгидратаза из Pseudomonas chloraphis катализирует присоединение молекулы воды к акрилонитрилу. В результате этой реакции образуется акриламид – важнейший продукт для получения полимера полиакриламида. Оксинитрилазы обеспечивают стереоселективное присоединение HCN к альдегиду; при гидролизе нитрила образуются D- или L-аминокисло- ты. Альдолазы, выделенные, к примеру, из печени кролика, используются при стереоселективном синтезе гексоз из С3-компонентов.
ИЗОМЕРАЗЫ. Известно около 140 ферментов, относящихся к классу изомераз. Ферментам этого типа не требуется кофактор. Изомеризация D-глюкозы и D-фруктозы, катализируемая глюкозоизомеразой, является важнейшим процессом в производстве искусственных подсластителей. Этот фермент внутриклеточный, и для этой реакции, как правило, используют дезактивированные иммобилизованные клетки
Streptomyces.
ЛИГАЗЫ. К классу лигаз, их известно 117, относятся ферменты, катализирующие соединение двух молекул, сопряженное с гидролизом АТФ. Теоретически использование лигаз в технологическом процессе весьма перспективно, однако необходимо найти дешевые пути синтеза кофактора – АТФ. Такие системы разрабатываются в лабораторных условиях, но пока не находят применения в технологических процессах.
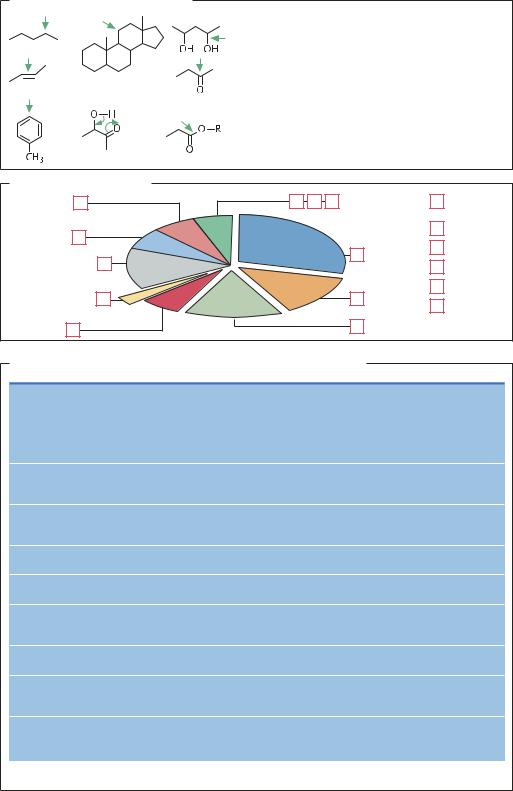
Ферменты в химическом синтезе |
|
|
|
|
|
|
|
|
|||
|
|
1 |
4 |
Преимущества ферментов в реакциях химического синтеза |
|||||||
|
|
1 |
Стерео- и субстрат-специфичное окисление |
||||||||
|
|
|
|
||||||||
|
|
|
|
2 |
неактивированных С–Н групп |
|
|
||||
|
|
|
|
Стереоселективные реакции присоединения |
|||||||
2 |
|
|
|
3 |
по активированным двойным связям |
|
|
||||
|
|
|
3 |
Стереоселективное восстановление |
|
|
|||||
|
|
|
4 |
карбонильных групп |
|
|
|
||||
5 |
|
6 |
7 |
Стереоселективное восстановление |
|
|
|||||
|
5 |
гидроксильных групп |
|
|
|
||||||
|
|
|
|
Субстрат-специфичное замещение |
|
|
|||||
|
|
|
|
6 |
в ароматических соединениях |
|
|
||||
|
|
|
|
Субстрат-специфичная изомеризация |
|
|
|||||
|
|
|
|
7 Субстрат-специфичные и стереоселективные реакции |
|||||||
|
|
|
|
|
гидролиза и этерификации |
|
|
||||
Ферменты в биокатализе |
|
|
|
|
|
|
|
|
|||
Пероксидазы |
1 |
|
|
2 |
4 |
5 |
Лиазы, |
1 |
Оксидо- |
||
и оксигеназы |
|
|
редуктазы |
||||||||
|
|
|
|
|
трансферазы, |
||||||
В том числе: |
|
|
|
|
|
|
|
изомеразы |
2 |
Трансферазы |
|
Oчищенные |
|
1 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
ферменты |
|
|
|
|
|
|
|
|
3 |
Гидролазы |
|
|
|
|
|
|
|
|
3 |
Липазы |
|||
|
|
|
|
|
|
|
|
||||
Оксидоредуктазы |
1 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
4 |
Лиазы |
||||
(целые клетки) |
|
|
|
|
|
|
|
5 |
Изомеразы |
||
Другие гидролазы |
|
|
|
|
|
|
Эстеразы |
||||
3 |
|
|
|
|
3 |
6 |
Лигазы |
||||
|
|
|
|
|
|
|
|
|
|
||
Нитрилазы |
3 |
|
|
|
|
|
3 |
Протеазы |
|
|
|
Примеры использования ферментов в технологических процессах
|
|
Реакция |
Фермент |
Ежегодное |
Фирма- |
|
|
|
|
потребление, т |
производитель |
|
|
|
|
|
|
|
|
Расщепление пенициллина G |
Пенициллинамидаза* |
40 000 |
North China |
|
3 |
||||
|
|
с образованием |
из E. coli |
|
Pharmaceuticals |
|
|
6-аминопенициллановой кислоты |
|
|
|
|
Расщепление рацемата N-ацил- |
Ацилаза* |
5 000 |
Tanabe Sejyaku, |
|
|
3 |
||||
|
|
DL-аминокислот с образованием |
из Aspergillus sp. |
|
Degussa, DSM |
|
|
|
|||
|
|
L-аминокислот |
|
|
|
|
|
Обработка NH3 |
Аспартаза* из E.coli |
10 000 |
Tanabe Sejyaku |
|
4 |
||||
|
|
фумаровой кислоты с образованием |
|
|
|
|
|
|
|
|
|
|
|
L-аспарагиновой кислоты |
|
|
|
|
|
Гидролиз крахмала до D-мальтозы |
α-Амилаза, |
100 000 |
Различные фирмы |
|
3 |
||||
|
и D-глюкозы |
глюкоамилаза |
|
|
|
|
|
|
|
||
|
Изомеризация D-глюкозы в D-фруктозу Глюкозоизомераза* |
100 000 |
Clinton Corn |
||
|
5 |
||||
|
|
|
из Streptomyces sp. |
|
Products |
|
Синтез акриламида из акрилонитрила |
Нитрилгидратаза* |
30 000 |
Nitto Chemicals |
|
|
3 |
||||
|
|
|
из Pseudomonas |
|
|
|
|
|
|
|
|
|
|
|
chloraphis |
|
|
|
|
Расщепление рацемата |
Липаза* из |
10 000 |
BASF |
|
3 |
||||
|
|
фенилэтиламинов |
Pseudomonas cepacia |
|
|
|
|
|
|
||
|
|
Трансэтерификация пальмового масла |
Липаза* из |
1000 |
Unilever |
|
3 |
||||
|
и метилового эфира стеариновой |
Rhizomucor miehei |
|
|
|
|
|
|
|
||
|
|
кислоты с образованием масла какао |
|
|
|
|
|
Дегалогенирование |
Дегалогеназа* из |
Технология |
Dow Chemicals |
|
3 |
||||
|
1-хлорпропандиола |
термофильных |
разрабатывается |
|
|
|
|
|
|||
организмов
* Иммобилизованный фермент.
77
