
- •Содержание
- •Предисловие
- •Предисловие ко 2-му изданию
- •Введение
- •Этапы развития биотехнологии
- •Биотехнология сегодня
- •Биотехнологическое производство пищевых продуктов
- •Алкогольные напитки
- •Пивоварение
- •Ферментация в пищевой промышленности
- •Пищевые продукты и молочнокислое брожение
- •Этиловый спирт
- •1-Бутанол, ацетон
- •Уксусная кислота
- •Лимонная кислота
- •Молочная и глюконовая кислоты
- •Аминокислоты
- •L-Глутаминовая кислота
- •D,L-Метионин, L-лизин и L-треонин
- •Антибиотики
- •Антибиотики: источники, применение и механизмы действия
- •Антибиотики: получение. Устойчивость к антибиотикам
- •β-Лактамные антибиотики: промышленное получение
- •Гликопептидные, полиэфирные и нуклеозидные антибиотики
- •Аминогликозидные антибиотики
- •Тетрациклины, хиноны, хинолоны и другие ароматические антибиотики
- •Поликетидные антибиотики
- •Получение новых антибиотиков
- •Специальные продукты
- •Витамины
- •Нуклеозиды и нуклеотиды
- •Биодетергенты и биокосметика
- •Микробные полисахариды
- •Биоматериалы
- •Биотрансформация
- •Биотрансформация стероидов
- •Ферменты
- •Ферменты
- •Ферментативный катализ
- •Ферменты в клинических анализах
- •Тесты с помощью ферментов
- •Применение ферментов в промышленных технологиях
- •Ферменты в производстве моющих средств
- •Ферменты, расщепляющие крахмал
- •Ферментативное расщепление крахмала в промышленности
- •Ферментативное превращение сахаров
- •Утилизация целлюлозы и полиозы
- •Использование ферментов в целлюлозно-бумажной промышленности
- •Пектиназы
- •Ферменты в производстве молочных продуктов
- •Использование ферментов в хлебобулочной и мясоперерабатывающей промышленности
- •Ферменты в кожевенной и текстильной промышленности
- •Перспективы получения ферментов для промышленных технологий
- •Белковая инженерия
- •Пекарские и кормовые дрожжи
- •Пекарские и кормовые дрожжи
- •Белки и жиры из одноклеточных организмов
- •Аэробная очистка сточных вод
- •Анаэробная очистка сточных вод и переработка ила
- •Биологическая очистка газовых выбросов
- •Биологическая очистка почв
- •Микробиологическое выщелачивание руд и биокоррозия
- •Инсулин
- •Гормон роста и другие гормоны
- •Гемоглобин, сывороточный альбумин и лактоферрин
- •Факторы свертывания крови
- •Антикоагулянты и тромболитики
- •Ингибиторы ферментов
- •Иммунная система
- •Стволовые клетки
- •Тканевая инженерия
- •Интерфероны
- •Интерлейкины
- •Эритропоэтин и другие факторы роста
- •Другие белки, имеющие медицинское значение
- •Вакцины
- •Рекомбинантные вакцины
- •Антитела
- •Моноклональные антитела
- •Рекомбинантные и каталитические антитела
- •Методы иммуноанализа
- •Биосенсоры
- •Биотехнология в сельском хозяйстве
- •Животноводство
- •Перенос эмбрионов и клонирование животных
- •Картирование генов
- •Трансгенные животные
- •Генетическая ферма и ксенотрансплантация
- •Растениеводство
- •Культивирование растительных клеток: поверхностные культуры
- •Культивирование растительных клеток: суспензионные культуры
- •Трансгенные растения: методы получения
- •Трансгенные растения
- •Вирусы
- •Бактериофаги
- •Микроорганизмы
- •Бактерии
- •Некоторые бактерии, важные для биотехнологии
- •Грибы
- •Дрожжи
- •Усовершенствование штаммов микроорганизмов
- •Основы биотехнологических методов
- •Микроорганизмы: рост в искусственных условиях
- •Кинетика образования продуктов метаболизма и биомассы в культуре микроорганизмов
- •Технология ферментации
- •Промышленные процессы ферментации
- •Культивирование животных клеток
- •Биореакторы для культивирования животных клеток
- •Биореакторы с иммобилизованными ферментами и клетками
- •Очистка биотехнологических продуктов
- •Очистка биотехнологических продуктов: хроматографические методы
- •Экономические аспекты биотехнологического производства
- •Методы генетической инженерии
- •Структура ДНК
- •Функции ДНК
- •Эксперимент в генетической инженерии
- •Методы выделения ДНК
- •Ферменты, модифицирующие ДНК
- •ПЦР: лабораторная практика
- •ДНК: химический синтез и определение размера молекул
- •Секвенирование ДНК
- •Введение ДНК в живые клетки (трансформация)
- •Идентификация и клонирование генов
- •Экспрессия генов
- •Выключение генов
- •Геном прокариот
- •Геном эукариот
- •Геном человека
- •Функциональный анализ генома человека
- •ДНК-анализ
- •Белковые и ДНК-чипы
- •Маркерные группы
- •Тенденции развития
- •Генная терапия
- •Поиск биологически активных веществ
- •Протеомика
- •Обмен веществ
- •Метаболомика и метаболическая инженерия
- •Системная биология
- •«Белая» биотехнология
- •Сертификация биотехнологической продукции
- •Этические аспекты генетической инженерии
- •Патентование в биотехнологии
- •Биотехнология в разных странах
- •Биотехнология в разных странах
- •Литература
- •Источники иллюстраций
- •Указатель микроорганизмов
хозяйстве |
Картирование генов |
|
скрещиванию и селекции основаны на генетике. Се- |
||
|
ВВЕДЕНИЕ. Классические методы животноводства по |
|
сельском |
лекционеры, применяя методы математической ста- |
|
тистики, могут оценивать влияние на фенотип окру- |
||
|
||
|
жающей среды и генетических особенностей. Для |
|
|
наиболее важных сельскохозяйственных и домашних |
|
в |
животных (лошадей, коров, свиней, овец, коз, кур, |
|
собак и кошек) созданы подробные генетические |
||
Биотехнология |
||
карты, построенные на наблюдениях за наследовани- |
||
|
||
|
ем сцепленных генов. На генетической карте указано |
|
|
местоположение гена на конкретной хромосоме. |
|
|
Геномы большинства домашних животных имеют |
|
|
размер около 3 млрд пар оснований и по сложности |
|
|
сопоставимы с геномом человека. В 2005 г. опубли- |
|
|
кованы последовательности геномов курицы и лоша- |
|
|
ди. Для коровы, свиньи, лошади и кошки существуют |
|
|
достаточно подробные карты сцепления генов, вклю- |
|
|
чающие в качестве маркеров тысячи микросателли- |
|
|
тов и сотни функциональных генов на вид. Благодаря |
|
|
этому у селекционеров есть возможность методом |
|
|
ПЦР устанавливать связи между генетическими и |
|
|
фенотипическими характеристиками разводимых |
|
|
животных. |
|
|
ГЕНЕТИЧЕСКИЕ УСОВЕРШЕНСТВОВАНИЯ. Идентифи- |
|
|
цировать признаки, целевые в животноводстве (на- |
|
|
пример, удойность), с определенными генами очень |
|
|
сложно, это все равно что собрать мозаичную карти- |
|
|
ну из десятков тысяч весьма сходных, но разных по |
|
|
происхождению фрагментов (родители и потомки). |
|
|
Поэтому животноводы-селекционеры стараются уни- |
|
|
фицировать условия содержания животных и таким |
|
|
образом упростить генетический анализ. При помо- |
|
|
щи сложных статистических методов (BLUP, от англ. |
|
|
best linear unbiased prediction – наилучшая линейная |
|
|
несмещенная оценка) можно оценить степень воз- |
|
|
действия окружающей среды и генетических данных |
|
|
на изменение признаков. В результате искусственно- |
|
|
го оплодотворения и переноса эмбрионов можно по- |
|
|
лучить группы животных, у которых влияние одного |
|
|
из родителей гораздо легче проследить по генетиче- |
|
|
скому наследованию у потомков. Однако ни один из |
|
|
этих методов не позволяет проанализировать влия- |
|
|
ние одного аллеля гена на сложные признаки. |
|
|
ГЕНЕТИЧЕСКИЕ КАРТЫ И СЕКВЕНИРОВАНИЕ ГЕНОМА. |
|
|
Анализ геномов млекопитающих – достаточно |
|
|
дорогое исследование, в частности из-за размера ге- |
|
|
номов и ограничений метода секвенирования ДНК |
|
|
(~600 п. н. за реакцию). Задача облегчается при на- |
|
|
личии маркерных точек на ДНК, находящихся на опре- |
|
|
деленном расстоянии от гена или генного участка, |
|
|
при условии, что генетический материал родителей |
|
|
обладает полиморфизмом и дает расщепление при |
|
166 |
наследовании. Такими маркерами являются микроса- |
|
теллиты (VNTR – последовательности с разным коли- |
чеством тандемных повторов). Микросателлитным ДНК, на долю которых приходится около 20% последовательности ДНК в геноме млекопитающих, принадлежит важная роль в генетическом и физическом картировании геномов. Один из методов анализа ДНК-маркеров – это анализ ПДРФ (полиморфизм длины рестриктных фрагментов): геномную ДНК или кДНК родителей и потомков расщепляют эндонуклеазами рестрикции и сравнивают картины расщепления при помощи гель-электрофореза. Таким образом получают карты рестриктного полиморфизма, которые при благоприятном стечении обстоятельств коррелируют с признаками и могут быть использованы в селекции. Если положение одного из интересующих генов в последовательности геномной ДНК известно, с помощью метода ПЦР можно амплифицировать соответствующий участок и проанализировать различия последовательностей ПЦР-продуктов. Однако сначала надо получить достоверную информацию об экзон-интронной структуре соответствующего гена, т. е. о структуре мРНК после сплайсинга (по последовательности кДНК). Для коммерчески важных домашних животных, таких как куры, коровы и свиньи, на сегодняшний день созданы генетические карты, базирующиеся на наблюдениях за наследованием признаков, генов или ДНК-маркеров (рекомбинация путем кроссинговера при мейозе). При анализе сцепления можно получить данные о расположении генов и маркеров на хромосомной ДНК.
|
Методы генетического картирования |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Разре- |
|
||||||||||
|
|
1 |
2 |
3 |
3, 4 |
|
|
|
5 |
|
|
5, 6 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
шение |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
109 |
108 |
107 |
106 |
105 |
104 |
103 |
п.н. |
|
||||||||||||||
|
|
Геном |
Хромо- |
Расстояние |
Расстояние |
Размер |
Расстояние |
Размер |
|
|
||||||||||||||
|
|
|
|
|
сома |
от точки |
между |
генов |
между микро- |
экзонов |
|
|||||||||||||
|
|
|
|
|
|
|
|
кроссинговера |
генами |
|
|
|
сателлитами |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
1 |
Скрещивание, анализ сцепления |
4 Клонируемый генный |
|
|
5 ПЦР-анализ |
|
|
||||||||||||||||
|
2 |
Клеточные функции |
|
|
|
фрагмент максимальной |
|
|
6 Секвенирование |
|
||||||||||||||
|
|
(гибриды соматических клеток), |
длины, полиморфизм |
|
|
генов |
|
|
||||||||||||||||
|
|
гибридизация in situ |
|
|
|
длин рестриктных |
|
|
|
|
|
|
|
|
||||||||||
|
3 |
Анализ сцепления |
|
|
|
фрагментов (ПДРФ) |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
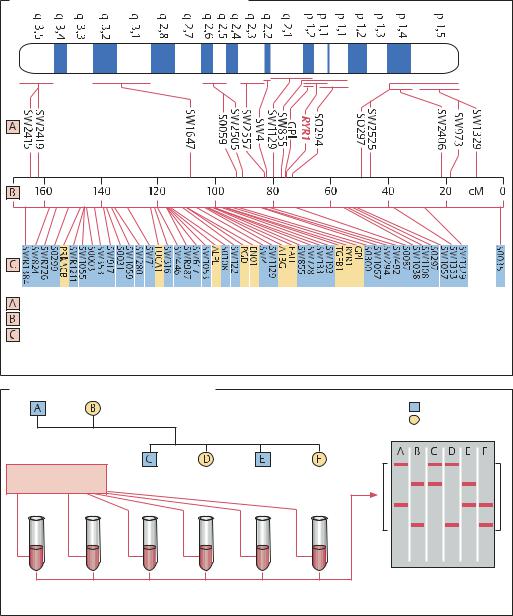
Картирование генов 6-й хромосомы свиньи
Зонды для гибридизации in situ |
|
Генетическая карта (в сМ) |
|
Соответствие физической карте (отрезкам ДНК). Синие: микросателлиты (маркерные локусы), |
|
желтые: генные участки, например RYR1 – ген рецепторного белка, наличие которого |
|
коррелирует с подверженностью стрессу |
|
ПДРФ и микросателлитные маркеры |
|
|
Самец |
Родители |
Самка |
Потомки |
|
ДНК из крови, |
|
ткани или спермы |
|
|
Картина наследования |
Анализ ДНК с помощью рестриктаз или ПЦР-праймеров |
фрагментов ДНК |
к микросателлитам |
|
|
167 |
Биотехнология в сельском хозяйстве
168
Трансгенные животные
ВВЕДЕНИЕ. Трансгенных животных, в которых экспрессирован чужеродный ген (knock-in) или выключен какой-либо собственный ген (knock-out), используют в фундаментальных исследованиях для моделирования некоторых заболеваний человека, для получения белков молока (генетическая ферма). В медицине наиболее важное модельное животное – мышь (Mus musculus), которую легко выращивать и которая по своим физиологическим особенностям близка к человеку.
ТРАНСГЕННЫЕ ЖИВОТНЫЕ. Для того чтобы свести к минимуму побочные эффекты, обусловленные гетерозиготностью наследуемых признаков, трансгенных животных, как правило, получают из близкородственных линий. Линии мышей становятся практически полностью гомозиготными после 7–10 близкородственных скрещиваний. Для введения чужеродного генетического материала (knock-in) чаще всего используют микроинъекцию генной конструкции в пронуклеус эмбриональной стволовой клетки (ЭСК). Этот метод довольно быстрый, однако количество выживающих эмбрионов невелико. В качестве векторов используют генные конструкции, содержащие промотор, чужеродный ген с экзонами и интронами и сигнал полиаденилирования. Часто встраивание такого вектора в геном животного происходит в нескольких местах, то есть ген встраивается в нескольких копиях. Для выключения генов (knock-out) предпочитают проводить трансфекцию эмбриональных стволовых клеток in vitro. В результате кроссинговера или индуцированного двухцепочечного разрыва происходит рекомбинация между последовательностью ДНК и вектором, несущим последовательности, гомологичные последовательности исследуемого гена, но не кодирующие функциональный генный продукт, что приводит к инактивации природного гена. В составе вектора обычно присутствует маркерный ген, что позволяет контролировать эффективность встраивания. Другой способ носит название «генной ловушки» (gene targeting): репортерный ген встраивается в кодирующие или регуляторные последовательности собственных генов. Методом генной ловушки место встраивания определяется достаточно точно, и происходит интеграция только одной копии гена. Для выключения генов используют также антисмысловые конструкции. Потомков, содержащих новый рекомбинантный ген или выключенный ген в одной из своих половых клеток (химерные зародыши), используют для дальнейшего размножения в качестве животного-основателя.
ТРАНСГЕННЫЕ МЫШИ. Самок мышей, у которых в результате однократной внутрибрюшинной инъекции гонадотропина (HCG) была вызвана суперовуляция, скрещивают с самцами. Из яйцеводов выделяют морулу или бластоцисту, которые затем трансформируют. При трансфекции из бластоцист получают эмбри-
ональные стволовые клетки (ЭСК), которые являются плюрипотентными и могут размножаться в клеточной культуре. Их трансфицируют ДНК-вектором и внедряют обратно в бластоцисту. При микроинъекции вектор с чужеродной ДНК вводят в крупный мужской пронуклеус, который хорошо виден под микроскопом в оплодотворенной яйцеклетке. Трансформированные бластоцисты или яйцеклетки имплантируют в матку самкам, у которых в результате спаривания с вазэктомированным самцом была стимулирована ложная беременность.
ПРИМЕНЕНИЕ. В 1982 г. повышенный интерес ученых и общественности вызвало получение трансгенной «супермыши» путем микроинъекции гена гормона роста в пронуклеус оплодотворенной яйцеклетки. Если предполагается, что причиной какого-либо заболевания является мутация определенного гена, подтвержение этому можно получить, используя трансгенных животных: введение интактных генов (knock-in) должно привести к восстановлению нарушенной функции. Если фенотип животного становится нормальным, участие данного гена в возникновении болезни можно считать доказанным. У мышей со злокачественной опухолью активированный онкоген v-Ha-ras связывается с эмбриональным промотором, что при повреждении эпидермиса приводит к развитию рака кожи. Мышей этой линии можно использовать для тестирования различных мутагенов. Трансгенных мышей с мутациями в белке-предшест- веннике β-амилоида (АРР) используют в качестве модели для изучения болезни Альцгеймера. Мыши с ТКИД (тяжелым комбинированным иммунодефицитом) служат моделями иммунных заболеваний. В середине 2005 г. в свободной продаже появились тысячи трансгенных линий мышей. Поскольку анализ генома различных линий мышей уже завершен, использование трансгенных мышей облегчает функциональный анализ генома человека.
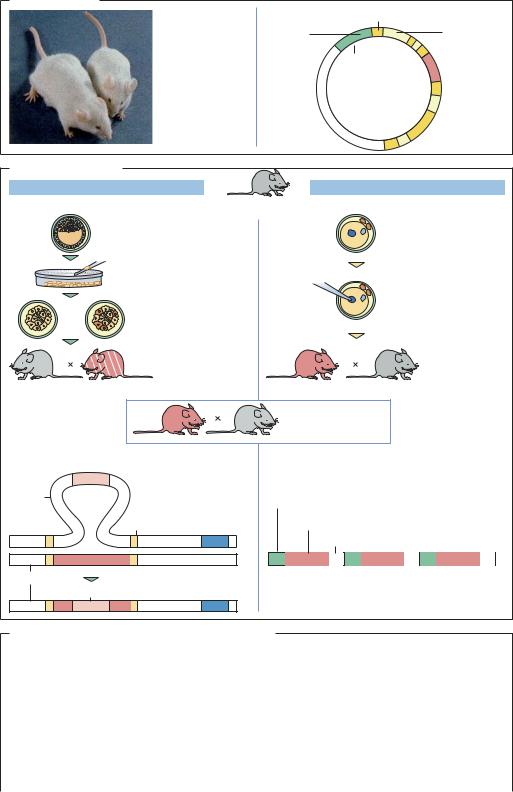
«Супермышь» |
|
|
|
N-Концевой экзон |
||
|
Мышь, полученная |
|
|
|||
|
|
|
|
|
||
|
в результате микро- |
Промотор |
|
|
Интрон |
|
|
инъекции генной |
|
|
|||
|
конструкции с геном |
гена метал- |
|
|
||
|
соматотропина |
лотионеина |
Активация |
|||
|
в пронуклеус опло- |
мыши |
|
ионами Cd2+ |
||
|
дотворенной мыши- |
|
|
|
Ген гормона |
|
|
ной яйцеклетки. |
|
|
|
роста крыс |
|
|
Справа – контроль- |
|
|
|
Генная |
|
|
ная мышь |
|
|
|
|
|
|
|
|
|
|
|
конструкция |
Трансгенные мыши |
|
|
|
|
|
|
«Нокаутные» мыши |
|
|
|
|
Трансгенная мышь |
|
Метод: эмбриональные стволовые клетки |
Донор эмбрионов |
Метод: инъекция в пронуклеус |
||||
|
Бластоциста |
|
|
|
|
Оплодотворенная |
|
|
|
|
|
яйцеклетка |
|
|
|
|
|
|
|
|
|
Культура эмбриональных |
|
|
|
|
|
|
стволовых клеток (ЭСК), |
|
|
|
|
|
|
трансформация |
|
|
|
|
|
|
ДНК-конструкцией |
|
|
|
|
Инъекция ДНК |
|
Нормальные |
|
|
|
|
в пронуклеус |
|
|
|
|
|
|
|
|
и химерные ЭСК |
|
|
|
|
|
|
Отбор химерных |
|
|
|
Нетрансгенные |
|
|
зародышей |
|
|
|
|
или трансгенные |
|
|
|
|
|
|
потомки |
Нетрансгенная |
Химерная мышь |
|
Трансгенная мышь |
Нетрансгенная мышь |
||
мышь |
|
|
|
|
|
|
|
|
|
Животное-основатель, |
|||
|
|
|
создание линии |
|||
Генная конструкция |
|
Генная конструкция |
||||
для получения «нокаутной» мыши |
|
для получения трансгенной мыши |
||||
Вектор |
|
|
Промотор |
|
|
|
|
|
|
|
|
|
|
|
Участок рекомбинации |
Ген с интронами и экзонами |
||||
|
|
|
|
|
Сайт полиаденилирования |
|
|
Экзон |
|
|
|
|
|
Хромосома |
|
|
|
|
|
|
Поврежденный экзон |
Маркер |
|
|
|
|
|
Линии мышей*, применяемые в исследованиях |
|
|
|
|||
|
Изменения/дефекты |
Модель заболевания |
|
|
|
Традиционное разведение |
Голые или облысевшие мыши, исследования чувствительности кожи |
|
|
|
Клонированный ген соматотропина |
«Супермыши» |
|
|
|
Дефекты иммунной системы |
ТКИД-мыши: мыши с ослабленным иммунитетом |
|
|
|
Дефект белка р53, |
Мыши со злокачественной опухолью: канцерогенез |
|
|
|
подавляющего развитие опухоли |
|
|
|
|
Дефект ангиотензиногена |
Мыши с повышенным кровяным давлением |
|
|
|
Дефект CTFR (муковисцидоз) |
Мыши с муковисцидозом (для генной терапии) |
|
|
|
|
|
|
|
|
* В 2005 г. были описаны уже тысячи трансгенных линий мышей. Многие из них коммерчески доступны |
169 |
||
|
|
|
|
|
|
|
|
|
|
