
- •Содержание
- •Предисловие
- •Предисловие ко 2-му изданию
- •Введение
- •Этапы развития биотехнологии
- •Биотехнология сегодня
- •Биотехнологическое производство пищевых продуктов
- •Алкогольные напитки
- •Пивоварение
- •Ферментация в пищевой промышленности
- •Пищевые продукты и молочнокислое брожение
- •Этиловый спирт
- •1-Бутанол, ацетон
- •Уксусная кислота
- •Лимонная кислота
- •Молочная и глюконовая кислоты
- •Аминокислоты
- •L-Глутаминовая кислота
- •D,L-Метионин, L-лизин и L-треонин
- •Антибиотики
- •Антибиотики: источники, применение и механизмы действия
- •Антибиотики: получение. Устойчивость к антибиотикам
- •β-Лактамные антибиотики: промышленное получение
- •Гликопептидные, полиэфирные и нуклеозидные антибиотики
- •Аминогликозидные антибиотики
- •Тетрациклины, хиноны, хинолоны и другие ароматические антибиотики
- •Поликетидные антибиотики
- •Получение новых антибиотиков
- •Специальные продукты
- •Витамины
- •Нуклеозиды и нуклеотиды
- •Биодетергенты и биокосметика
- •Микробные полисахариды
- •Биоматериалы
- •Биотрансформация
- •Биотрансформация стероидов
- •Ферменты
- •Ферменты
- •Ферментативный катализ
- •Ферменты в клинических анализах
- •Тесты с помощью ферментов
- •Применение ферментов в промышленных технологиях
- •Ферменты в производстве моющих средств
- •Ферменты, расщепляющие крахмал
- •Ферментативное расщепление крахмала в промышленности
- •Ферментативное превращение сахаров
- •Утилизация целлюлозы и полиозы
- •Использование ферментов в целлюлозно-бумажной промышленности
- •Пектиназы
- •Ферменты в производстве молочных продуктов
- •Использование ферментов в хлебобулочной и мясоперерабатывающей промышленности
- •Ферменты в кожевенной и текстильной промышленности
- •Перспективы получения ферментов для промышленных технологий
- •Белковая инженерия
- •Пекарские и кормовые дрожжи
- •Пекарские и кормовые дрожжи
- •Белки и жиры из одноклеточных организмов
- •Аэробная очистка сточных вод
- •Анаэробная очистка сточных вод и переработка ила
- •Биологическая очистка газовых выбросов
- •Биологическая очистка почв
- •Микробиологическое выщелачивание руд и биокоррозия
- •Инсулин
- •Гормон роста и другие гормоны
- •Гемоглобин, сывороточный альбумин и лактоферрин
- •Факторы свертывания крови
- •Антикоагулянты и тромболитики
- •Ингибиторы ферментов
- •Иммунная система
- •Стволовые клетки
- •Тканевая инженерия
- •Интерфероны
- •Интерлейкины
- •Эритропоэтин и другие факторы роста
- •Другие белки, имеющие медицинское значение
- •Вакцины
- •Рекомбинантные вакцины
- •Антитела
- •Моноклональные антитела
- •Рекомбинантные и каталитические антитела
- •Методы иммуноанализа
- •Биосенсоры
- •Биотехнология в сельском хозяйстве
- •Животноводство
- •Перенос эмбрионов и клонирование животных
- •Картирование генов
- •Трансгенные животные
- •Генетическая ферма и ксенотрансплантация
- •Растениеводство
- •Культивирование растительных клеток: поверхностные культуры
- •Культивирование растительных клеток: суспензионные культуры
- •Трансгенные растения: методы получения
- •Трансгенные растения
- •Вирусы
- •Бактериофаги
- •Микроорганизмы
- •Бактерии
- •Некоторые бактерии, важные для биотехнологии
- •Грибы
- •Дрожжи
- •Усовершенствование штаммов микроорганизмов
- •Основы биотехнологических методов
- •Микроорганизмы: рост в искусственных условиях
- •Кинетика образования продуктов метаболизма и биомассы в культуре микроорганизмов
- •Технология ферментации
- •Промышленные процессы ферментации
- •Культивирование животных клеток
- •Биореакторы для культивирования животных клеток
- •Биореакторы с иммобилизованными ферментами и клетками
- •Очистка биотехнологических продуктов
- •Очистка биотехнологических продуктов: хроматографические методы
- •Экономические аспекты биотехнологического производства
- •Методы генетической инженерии
- •Структура ДНК
- •Функции ДНК
- •Эксперимент в генетической инженерии
- •Методы выделения ДНК
- •Ферменты, модифицирующие ДНК
- •ПЦР: лабораторная практика
- •ДНК: химический синтез и определение размера молекул
- •Секвенирование ДНК
- •Введение ДНК в живые клетки (трансформация)
- •Идентификация и клонирование генов
- •Экспрессия генов
- •Выключение генов
- •Геном прокариот
- •Геном эукариот
- •Геном человека
- •Функциональный анализ генома человека
- •ДНК-анализ
- •Белковые и ДНК-чипы
- •Маркерные группы
- •Тенденции развития
- •Генная терапия
- •Поиск биологически активных веществ
- •Протеомика
- •Обмен веществ
- •Метаболомика и метаболическая инженерия
- •Системная биология
- •«Белая» биотехнология
- •Сертификация биотехнологической продукции
- •Этические аспекты генетической инженерии
- •Патентование в биотехнологии
- •Биотехнология в разных странах
- •Биотехнология в разных странах
- •Литература
- •Источники иллюстраций
- •Указатель микроорганизмов
Биотехнология в медицине
148
Вакцины
ВВЕДЕНИЕ. При так называемой «пассивной иммуни- |
тивируют формальдегидом или тепловой обработкой. |
зации» в организме вырабатываются антитела к ви- |
В связи с риском инфицирования все этапы произ- |
русам, бактериям или токсинам. «Активная иммуни- |
водства вакцин требуют строжайшего соблюдения |
зация», то есть вакцинация, которая используется |
техники безопасности. После получения новых пре- |
человеком уже более 200 лет, является значительно |
паратов вакцин следует стадия испытаний на экспе- |
более эффективным способом стимуляции иммун- |
риментальных животных. |
ной системы. В ответ на введение вакцины в ор- |
ПРИМЕРЫ ПОЛУЧЕНИЯ ВАКЦИН. Причиной столбня- |
ганизме происходят следующие процессы: активиру- |
ка является попадание в кровь нейротоксина, выра- |
ются В-лимфоциты – продуценты антител; активиру- |
батываемого бактериями Clostridium tetani. Для по- |
ются Т-лимфоциты, которые обладают способностью |
лучения этого токсина разработан специальный |
уничтожать чужеродный антиген; образуются долго- |
штамм-суперпродуцент токсина (штамм Харварда). В |
живущие В- и Т-лимфоциты (клетки памяти), кото- |
ферментере по окончании роста культуры клетки |
рые быстро активизируются при следующей встрече |
подвергаются автолизу, освобождаются от клеточных |
с тем же антигеном. В качестве вакцины могут слу- |
фрагментов фильтрованием, а токсин подвергают об- |
жить инактивированные, либо ослабленные (аттенуи- |
работке 0,5%-м формальдегидом в течение четырех |
рованные) микроорганизмы, которые не являются |
недель. Полученный белок называется токсоидом. |
вирулентными, однако вызывают иммунную реакцию. |
Его очищают диафильтрацией и высаливанием, для |
Иммунный ответ вызывают не только целые клетки, |
повышения иммуногенности осаждают на солях алю- |
но и отдельные клеточные компоненты, например по- |
миния, после чего проводят испытания на экспери- |
лисахариды, а также токсичные белки (токсины). Для |
ментальных животных. Вакцину против кори получа- |
получения аттенуированных вирусов разработан це- |
ют, заражая культуру клеток животных или человека |
лый ряд специальных технологий. На протяжении |
вирусом rubella с пониженной вирулентностью |
многих лет вакцины применяются для профилактики |
(штамм Эдмонтона). После лизиса клеток-хозяев из |
таких заболеваний человека, как корь, дифтерия, |
среды выделяют вирус, который затем лиофилизуют |
столбняк, коклюш, туберкулез, холера и полиомиелит, |
для получения препарата с длительным сроком хра- |
а также ящур скота. К сожалению, существует множе- |
нения. |
ство заболеваний, против которых до сих пор не полу- |
|
чено вакцин. К таким заболеваниям относятся многие |
|
тропические болезни и СПИД. Кроме того, снова ста- |
|
новится актуальной профилактика некоторых болез- |
|
ней, которые уже считались побежденными, как, на- |
|
пример, туберкулез. В значительной мере риск |
|
заболевания туберкулезом обусловлен появлением |
|
новых штаммов, обладающих устойчивостью к анти- |
|
биотикам. Методы генетической инженерии позволя- |
|
ют получать новые высокоэффективные вакцины. |
|
ПОЛУЧЕНИЕ ВАКЦИН. Традиционные методы произ- |
|
водства вакцин основаны на получении инактивиро- |
|
ванных или ослабленных антигенов в форме, доступ- |
|
ной для парентерального, внутримышечного или |
|
перорального применения. В качестве вакцины ис- |
|
пользуют, как правило, непатогенные штаммы, кото- |
|
рые, однако, вызывают иммунный ответ. Для получе- |
|
ния такой формы штамма клетки выращивают в |
|
лабораторных условиях, а затем инактивируют, обра- |
|
батывая формальдегидом или подвергая тепловой |
|
обработке. Производство многих вакцин против мик- |
|
роорганизмов или их токсинов осуществляется |
|
путем ферментации в биореакторах. До 1970 г. для |
|
культивирования вирусов использовали яйца кур, |
|
а в качестве вакцины применяли белки вирусной обо- |
|
лочки. По современной технологии культуры живот- |
|
ных клеток в биореакторах заражают вирусом. |
|
Затем выделенные из культуры клеток вирусы инак- |
|
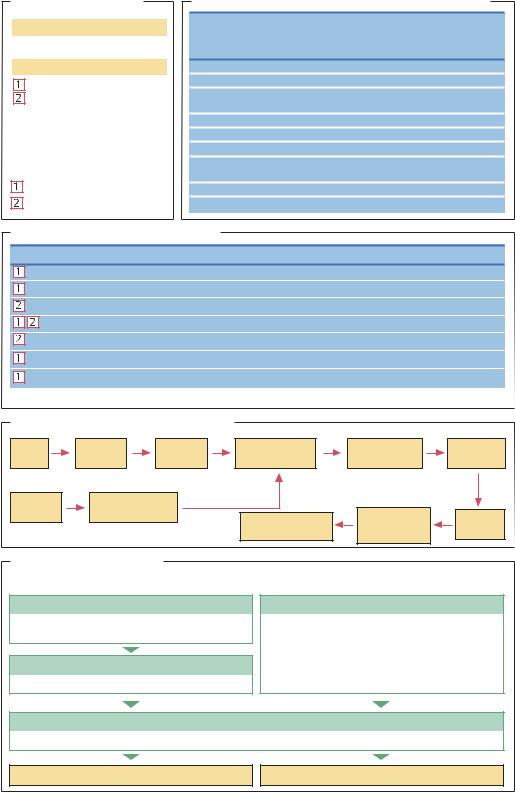
Основные типы вакцин |
|
Возникновение эпидемий инфекционных заболеваний |
||||||||
Пассивная иммунизация |
|
Заболевание |
|
|
Количество |
Количество |
||||
|
|
|
|
|
зарегистрированных |
смертельных |
||||
|
|
|
|
|
|
|
|
|
||
Введение антител |
|
|
|
|
|
|
случаев заболевания, |
исходов, |
||
|
|
|
|
|
|
|
|
|
млн/год |
тыс./год |
Активная иммунизация |
|
Диарея |
|
|
|
> 4000 |
> 400 |
|||
Парентеральное или |
|
Гельминты |
|
|
|
> 2000 |
>200 |
|||
|
Болезни |
|
|
|
> 350 |
> 4000 |
||||
Пероральное введение |
|
|
|
|
||||||
|
дыхательных путей |
|
|
|
||||||
– убитых патогенных |
|
|
|
|
||||||
микроорганизмов |
|
Малярия |
|
|
|
> 300 |
> 1 |
|||
– ослабленных патогенных |
|
Шистосомоз |
|
|
> 250 |
> 10 |
||||
микроорганизмов |
|
|
|
|||||||
|
Корь (в тропических странах) |
|
> 44 |
> 1000 |
||||||
– патоген-специфического |
|
|
||||||||
антигена |
|
|
|
Болезнь Шагаса (южно- |
|
> 25 |
— |
|||
– патоген-специфической ДНК |
американский трипаносомоз) |
|
|
|
||||||
В случае системных инфекций |
Туберкулез |
|
|
> 6 |
> 2000 |
|||||
В случае локальных инфекций |
СПИД |
|
|
|
> 5 |
> 150 |
||||
Примеры часто используемых вакцин |
|
|
|
|
|
|||||
|
Вакцина |
Применение |
Состав |
|
|
|
|
|
||
|
BCG |
|
Туберкулез |
Содержит живые аттенуированные штаммы* Mycobacetrium bovis |
||||||
|
Rubella |
|
Корь |
|
Содержит живые аттенуированные вирусы Rubella |
|
||||
|
Poliomyelitis |
Полиомиелит |
Содержит живые аттенуированные вирусы полиомиелита |
|||||||
|
Cholera |
|
Холера |
|
Содержит убитые клетки Vibrio cholerae |
|
||||
|
Typhus |
|
Тиф |
|
Содержит живые аттенуированные штаммы Salmonella typhimurium |
|||||
|
Haemophilus |
Менингит |
|
Содержит полисахарид капсулы Haemophilus influenzae |
|
|||||
|
MKS |
|
Ящур |
|
Содержит инактивированный формалином вирус ящура |
|
||||
* Аттенуированный штамм – невирулентный ослабленный штамм, который способен вызывать иммунный ответ |
|
|||||||||
Прозводство противовирусной вакцины |
|
|
|
|
|
|||||
Банк |
|
Стартовая |
Стартовая |
Культура клеток, |
|
Аттенуация или |
Концентри- |
|||
клеток |
|
культура 1 |
культура 2 |
ферментация |
|
инактивация |
рование |
|||
Штаммы |
Аттенуированный |
|
|
|
|
|
|
|||
штамм |
|
|
|
|
|
Изготовление |
|
|||
|
|
|
|
Проверка качества |
Фильтро- |
|||||
|
|
|
|
|
|
лекарственной |
||||
|
|
|
|
|
|
продукта |
|
вание |
||
|
|
|
|
|
|
|
формы |
|||
|
|
|
|
|
|
|
|
|
|
|
Ферментация и выделение |
|
|
|
|
|
|
||||
|
Антибактериальные вакцины |
|
|
Антивирусные вакцины |
|
|||||
|
|
|
Биореактор |
|
|
|
|
Получение |
|
|
Культивирование патогенных бактерий, |
|
Аттенуированные вирусы |
|
|||||||
например, в реакторе объемом 5000 л |
|
|
в зародышах трансгенных кур |
|
||||||
|
|
|
|
|
|
|
или в культуре животных клеток |
|
||
|
|
Инактивация |
|
|
|
|
|
|
||
Добавление формальдегида |
|
|
|
|
|
|
|
|||
|
|
|
|
Выделение и контроль качества продукта |
|
|||||
Очистка хроматографическими методами. Тестирование на животных |
|
|
|
|||||||
Лиофилизованный, устойчивый при хранении токсоид |
Лиофилизованная, устойчивая при хранении вакцина |
|||||||||
|
|
|
|
|
|
|
|
|
|
149 |
медицине |
Рекомбинантные вакцины |
|
вают новые возможности для создания вакцин. На- |
||
|
ВВЕДЕНИЕ. Методы генетической инженерии откры- |
|
в |
ряду с получением чистых препаратов техника |
|
Биотехнология |
||
рекомбинантных белков позволяет разрабатывать |
||
|
||
|
совершенно новые концепции иммунизации, напри- |
|
|
мер введение вакцины в клетку с помощью белков |
|
|
оболочки непатогенных вирусов, экспрессия вакци- |
|
|
ны в трансгенных растениях или в молочных желе- |
|
|
зах трансгенных животных, а также иммунизация |
|
|
путем трансфекции ДНК. В ветеринарии уже приме- |
|
|
няются рекомбинантные вакцины для животных, и |
|
|
уже допущена к применению рекомбинантная вакци- |
|
|
на для профилактики гепатита В у человека, для |
|
|
профилактики дифтерии и вакцинирования против |
|
|
боррелиоза. |
|
|
СТРАТЕГИЧЕСКИЕ ПОДХОДЫ. Современные вакцины, |
|
|
полученные с использованием методов генетической |
|
|
инженерии, содержат, как правило, не целые клетки |
|
|
возбудителя заболевания, а их компоненты, напри- |
|
|
мер специфические поверхностные белки. Такой под- |
|
|
ход, несомненно, предполагает знание иммуногенной |
|
|
структуры патогена. Примером использования этого |
|
|
подхода является создание рекомбинантной вакцины |
|
|
против гепатита В. Гепатит В – эндемическое забо- |
|
|
левание во многих странах азиатского региона. |
В90% случаев заболевание проходит бессимптомно, но в 5% приводит к хроническим болезням печени. По оценкам, в мире почти 1 млрд носителей вируса гепатита В. Для получения рекомбинантной вакцины из плазмы инфицированных доноров выделили поверхностный антиген HBsAg вируса гепатита
Ви осуществили экспрессию в различных клеткаххозяевах: культурах E. coli клеток млекопитающих и S. cerevisiae, но предпочтительнее – в культуре пекарских дрожжей. Экспрессированный белок очищали хроматографическими методами. Иммунохроматографические методы с использованием антител к HBsAg хотя и дали хорошие результаты, но этот метод очень дорогостоящий. Другим направлением развития нового поколения вакцин является получение аттенуированных штаммов. Например, по такой технологии был создан новый штамм Vibrio cholerеae для иммунизации против холеры. Холерный токсин, ответственный за патогенный эффект, представляет собой гексамерный белок с аденилатциклазной активностью. Под действием этого токсина концентрация цАМФ в тонком кишечнике увеличивается, что влечет значительные потери организмом жидкости и электролитов. Клиническими проявлениями холеры являются диарея и обезвоживание организма. Методами генетической инженерии удалось получить штамм V. cholerae, в геноме которого делетирован участок, ответственный за аденилатциклазную актив-
150 ность энтеротоксина. Такой измененный энтероток-
син вызывает полноценный иммунный ответ, однако не является патогенным. «Векторные» вакцины – еще одна новая стратегия иммунизации. В качестве вакцины при таком подходе используется вирусная ДНК, модифицированная таким образом, что она больше не оказывает патогенного действия, однако вызывает иммунный ответ. Для доставки вирусной ДНК в клетки выбран вирус коровьей оспы (Vaccinia). Геном этого вируса хорошо изучен, а сам вирус инфицирует клетки с высокой эффективностью и не опасен для человека. В геном Vaccinia можно встраивать различные вирусные антигены и наблюдать иммунный ответ. Так, на экспериментальных животных было подтверждено действие такой системы с G-белком вируса бешенства, с поверхностным антигеном гепатита В, с NP- и HA-белками вируса гриппа и с различными гликопротеинами Нerpes simplex. Стратегия «векторных» вакцин, несомненно, является многообещающей, однако ее серьезный недостаток заключается в риске развития вирусной инфекции у грудных детей, а также у лиц с ослабленным иммунитетом.
ТРАНСГЕННЫЕ РАСТЕНИЯ. Программы иммунизации, основанные на использовании трансгенных растений, больше всего обсуждаются в странах третьего мира. Такие «съедобные вакцины» поступают в организм пероральным путем, поэтому особое внимание уделяется тому, каким образом вакцина проходит через желудочно-кишечный тракт и насколько эффективен иммунный ответ клеток слизистой оболочки. Использование трансгенных растений для иммунизации не исключено в будущем, однако пока такой подход вызывает множество вопросов, в том числе касающихся условий созревания, хранения и переработки плодов трансгенных растений, несущих вакцину.
ДНК-ВАКЦИНЫ (ГЕННАЯ ИММУНИЗАЦИЯ). После инъекции ДНК, кодирующей поверхностный белок возбудителя малярии Plasmodium falcuparum, в селезенке мышей образовывались антитела к этому паразиту. Эксперименты на мышах по экспрессии фрагментов генома Mycobacterium tuberculosis подтвердили возникновение Т-клеточного иммунного ответа. Удалось также выделить гены, ответственные за возникновение такого иммунитета. В обоих случаях антиген-специфическую ДНК встраивали в плазмиды. В настоящее время ДНК-вакцины лишь начинают разрабатываться.
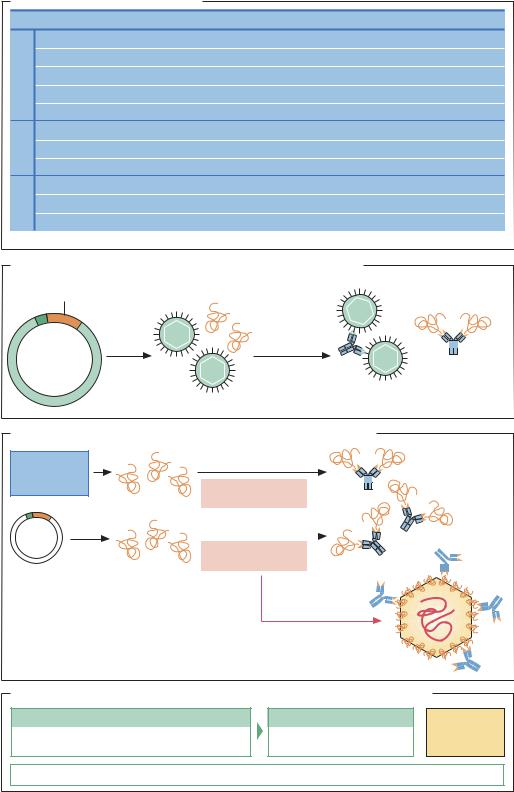
Примеры рекомбинантных вакцин
Паразиты Бактерии Вирусы
|
Антиген |
Фаза испытания |
Гепатит В |
Поверхностный антиген |
Допущена к применению |
Простой герпес типа 2 |
Поверхностный антиген |
Клинические испытания |
Бешенство |
Поверхностный антиген |
Не допущена к применению |
Желтая лихорадка |
Поверхностный антиген |
Доклинические испытания |
СПИД |
Поверхностный антиген |
Клинические испытания |
Различные стрептококки |
Полисахариды, мембранные белки |
Клинические испытания |
Clostridium tetani |
Столбнячный токсин |
Не допущена к применению |
Mycobacterium tuberculosis |
Поверхностный антиген, ДНК* |
Клинические испытания |
Plasmodium falciparum/Малярия |
ДНК* |
Клинические испытания |
Trypanosoma sp./Сонная болезнь |
ДНК |
Доклинические испытания |
Schistosoma mansoni/Шистосомоз |
ДНК |
Доклинические испытания |
* Прайм-буст иммунизация
Рекомбинантная «векторная» вакцина на основе вируса Vaccinia
Ген белка оболочки |
Белок оболочки |
вируса гепатита В |
вируса гепатита В |
Реком- |
Введение |
В-клетки |
|
синтезируют |
|||
бинантная |
|||
в кровь |
антитела |
||
вакцина |
|||
|
|
||
(модифициро- |
|
|
|
ванный вирус |
|
|
|
Vaccinia) |
|
|
|
|
|
Вирус Vaccinia |
Антитела |
против вируса |
Vaccinia |
Антитела против белка оболочки вируса гепатита В
«Пептидные» или ДНК-вакцины против белков вирусной оболочки
Получение |
Внутримышечное введение |
|
|
в биореакторе |
В-клетки |
|
|
|
синтезируют антитела |
|
Инъекция, пероральное |
|
или интраназальное введение |
|
В-клетки |
|
синтезируют антитела |
Плазмида, |
Рекомбинантный |
несущая ген |
белок вирусной |
вирусной |
оболочки |
оболочки |
|
|
При инфекции антитела |
|
связываются с вирусом |
Ферментация и выделение рекомбинантных вакцин против вируса гепатита В |
|
||
Биореактор |
Выделение |
Вакцина |
|
Рекомбинантный штамм S. cerevisiae, |
Осаждение, ультрафильтрация, |
||
против rHBAg |
|||
несущий плазмиду для экспрессии белка rHBAg |
хроматография |
||
|
|||
Контроль качества продукта (отсутствие патогенной активности, изучение аллергенных свойств и т. д.) |
|||
|
|
151 |
|
