
- •Содержание
- •Предисловие
- •Предисловие ко 2-му изданию
- •Введение
- •Этапы развития биотехнологии
- •Биотехнология сегодня
- •Биотехнологическое производство пищевых продуктов
- •Алкогольные напитки
- •Пивоварение
- •Ферментация в пищевой промышленности
- •Пищевые продукты и молочнокислое брожение
- •Этиловый спирт
- •1-Бутанол, ацетон
- •Уксусная кислота
- •Лимонная кислота
- •Молочная и глюконовая кислоты
- •Аминокислоты
- •L-Глутаминовая кислота
- •D,L-Метионин, L-лизин и L-треонин
- •Антибиотики
- •Антибиотики: источники, применение и механизмы действия
- •Антибиотики: получение. Устойчивость к антибиотикам
- •β-Лактамные антибиотики: промышленное получение
- •Гликопептидные, полиэфирные и нуклеозидные антибиотики
- •Аминогликозидные антибиотики
- •Тетрациклины, хиноны, хинолоны и другие ароматические антибиотики
- •Поликетидные антибиотики
- •Получение новых антибиотиков
- •Специальные продукты
- •Витамины
- •Нуклеозиды и нуклеотиды
- •Биодетергенты и биокосметика
- •Микробные полисахариды
- •Биоматериалы
- •Биотрансформация
- •Биотрансформация стероидов
- •Ферменты
- •Ферменты
- •Ферментативный катализ
- •Ферменты в клинических анализах
- •Тесты с помощью ферментов
- •Применение ферментов в промышленных технологиях
- •Ферменты в производстве моющих средств
- •Ферменты, расщепляющие крахмал
- •Ферментативное расщепление крахмала в промышленности
- •Ферментативное превращение сахаров
- •Утилизация целлюлозы и полиозы
- •Использование ферментов в целлюлозно-бумажной промышленности
- •Пектиназы
- •Ферменты в производстве молочных продуктов
- •Использование ферментов в хлебобулочной и мясоперерабатывающей промышленности
- •Ферменты в кожевенной и текстильной промышленности
- •Перспективы получения ферментов для промышленных технологий
- •Белковая инженерия
- •Пекарские и кормовые дрожжи
- •Пекарские и кормовые дрожжи
- •Белки и жиры из одноклеточных организмов
- •Аэробная очистка сточных вод
- •Анаэробная очистка сточных вод и переработка ила
- •Биологическая очистка газовых выбросов
- •Биологическая очистка почв
- •Микробиологическое выщелачивание руд и биокоррозия
- •Инсулин
- •Гормон роста и другие гормоны
- •Гемоглобин, сывороточный альбумин и лактоферрин
- •Факторы свертывания крови
- •Антикоагулянты и тромболитики
- •Ингибиторы ферментов
- •Иммунная система
- •Стволовые клетки
- •Тканевая инженерия
- •Интерфероны
- •Интерлейкины
- •Эритропоэтин и другие факторы роста
- •Другие белки, имеющие медицинское значение
- •Вакцины
- •Рекомбинантные вакцины
- •Антитела
- •Моноклональные антитела
- •Рекомбинантные и каталитические антитела
- •Методы иммуноанализа
- •Биосенсоры
- •Биотехнология в сельском хозяйстве
- •Животноводство
- •Перенос эмбрионов и клонирование животных
- •Картирование генов
- •Трансгенные животные
- •Генетическая ферма и ксенотрансплантация
- •Растениеводство
- •Культивирование растительных клеток: поверхностные культуры
- •Культивирование растительных клеток: суспензионные культуры
- •Трансгенные растения: методы получения
- •Трансгенные растения
- •Вирусы
- •Бактериофаги
- •Микроорганизмы
- •Бактерии
- •Некоторые бактерии, важные для биотехнологии
- •Грибы
- •Дрожжи
- •Усовершенствование штаммов микроорганизмов
- •Основы биотехнологических методов
- •Микроорганизмы: рост в искусственных условиях
- •Кинетика образования продуктов метаболизма и биомассы в культуре микроорганизмов
- •Технология ферментации
- •Промышленные процессы ферментации
- •Культивирование животных клеток
- •Биореакторы для культивирования животных клеток
- •Биореакторы с иммобилизованными ферментами и клетками
- •Очистка биотехнологических продуктов
- •Очистка биотехнологических продуктов: хроматографические методы
- •Экономические аспекты биотехнологического производства
- •Методы генетической инженерии
- •Структура ДНК
- •Функции ДНК
- •Эксперимент в генетической инженерии
- •Методы выделения ДНК
- •Ферменты, модифицирующие ДНК
- •ПЦР: лабораторная практика
- •ДНК: химический синтез и определение размера молекул
- •Секвенирование ДНК
- •Введение ДНК в живые клетки (трансформация)
- •Идентификация и клонирование генов
- •Экспрессия генов
- •Выключение генов
- •Геном прокариот
- •Геном эукариот
- •Геном человека
- •Функциональный анализ генома человека
- •ДНК-анализ
- •Белковые и ДНК-чипы
- •Маркерные группы
- •Тенденции развития
- •Генная терапия
- •Поиск биологически активных веществ
- •Протеомика
- •Обмен веществ
- •Метаболомика и метаболическая инженерия
- •Системная биология
- •«Белая» биотехнология
- •Сертификация биотехнологической продукции
- •Этические аспекты генетической инженерии
- •Патентование в биотехнологии
- •Биотехнология в разных странах
- •Биотехнология в разных странах
- •Литература
- •Источники иллюстраций
- •Указатель микроорганизмов
аминокислоты |
Уксусная кислота |
|
ВВЕДЕНИЕ. Уксус в качестве вкусовой добавки или |
||
|
||
|
консерванта использовался в Европе еще в античные |
|
|
времена. Он также находит широкое применение и в |
|
|
классической кухне народов Азии. По традиционной |
|
и |
технологии уксус получали из вина. Один из знаме- |
|
нитых примеров – бальзамический уксус, который |
||
кислоты |
||
является своеобразной «кулинарной достопримеча- |
||
|
||
|
тельностью» города Модена (Италия). Во Франции в |
|
|
XVIII в., когда еще трудно было говорить о развитии |
|
Спирты, |
промышленности, существовал так называемый |
|
«стружечный» способ получения уксуса – разведен- |
||
ное вино наливали в бочки с древесной стружкой, |
||
вымоченной в уксусе. В 1856 г. Луи Пастер обнару- |
||
жил микроорганизмы, осуществляющие уксуснокис- |
||
|
лое брожение – уксуснокислые бактерии. К 1868 г., |
|
|
изучая различные среды роста, он получил чистую |
|
|
культуру этих бактерий и таким образом заложил ос- |
|
|
новы технологического метода получения винного ук- |
|
|
суса (содержание уксусной кислоты около 6%). Сто- |
|
|
ловый уксус – 5%-й раствор уксусной кислоты, как |
|
|
правило, получают ферментацией ректификата (эта- |
|
|
нола). Мировое производство уксусной кислоты со- |
|
|
ставляет несколько млрд литров в год. В США в |
|
|
больших количествах используется ацетат кальция- |
|
|
магния (температура плавления –7,7 °С), получен- |
|
|
ный биотехнологическим методом, как реагент для |
|
|
борьбы с обледенением на автотрассах (Cryotech |
|
|
CMAТМ). Химический реактив «ледяная уксусная кис- |
|
|
лота» (99,7%, рКа 5,6) производят из этилена или |
|
|
метанола. |
|
|
МИКРООРГАНИЗМЫ В БИОСИНТЕЗЕ. Способностью |
|
|
осуществлять неполное окисление этанола с образо- |
|
|
ванием уксусной кислоты обладают лишь немногие |
|
|
микроорганизмы, в частности, некоторые штаммы |
|
|
Gluconobacter и Acetobacter. Принадлежность бакте- |
|
|
рий к тому или иному штамму определить очень |
|
|
сложно из-за быстро меняющегося фенотипа, поэто- |
|
|
му с этой целью используют анализ последователь- |
|
|
ностей 16S-рРНК или плазмид. Окисление этанола |
|
|
происходит в реакциях, катализируемых мембранос- |
|
|
вязанными ферментами алкогольдегидрогеназой |
|
|
и альдегиддегидрогеназой. В клетках Acetobacter |
|
|
альдегиддегидрогеназа несет в качестве простетиче- |
|
|
ской группы пирроллхинолинхинон (ПХХ), а альдегид- |
|
|
дегидрогеназа наряду с пирроллхинолинхиноном |
|
|
содержит еще гем. Перенос электронов на терми- |
|
|
нальную оксидазу происходит через образование |
|
|
убихинона. Уксуснокислые бактерии осуществляют |
|
|
гликолиз, образующиеся молекулы пирувата посту- |
|
|
пают в цикл лимонной кислоты. Уксуснокислые бак- |
|
|
терии чрезвычайно требовательны к высокой концен- |
|
|
трации кислорода в среде роста: прерывание аэрации |
|
24 |
всего на несколько минут приводит к значительному |
|
снижению эффективности окисления этанола. В от- |
сутствие этанола бактерии рода Acetobacter окисляют уксусную кислоту до углекислого газа.
ФЕРМЕНТАЦИЯ И ПЕРЕРАБОТКА. Для получения стартовой культуры Acetobacter sp. в пилотном ферментере клетки культивируют на сусле (вино или спирт, 1%-ная уксусная кислота, питательные вещества). После начала образования кислоты устанавливают повторяющийся цикл: когда концентрация спирта снижается до 0,2% (воздух в ферментере встроен датчик), более половины культуральной жидкости удаляют, и добавляют новое сусло. Для интенсивной аэрации без вспенивания жидкости (воздух в ферментер подают со скоростью, равной 1/10 объема ферментера в минуту) служат специальные мешалки, сконструированные Фрингсом. Тепло, выделяемое бактериями в результате метаболизма, отводится системой охлаждения. Средняя эффективность процесса в ферментере объемом 100 м3 составляет 1,6 г/л. Раствор уксусной кислоты из ферментера пропускают через мембранные фильтры, пастеризуют и разводят до концентрации столового уксуса. При использовании специальных штаммов и регулировании условий ферментации образуется 17,5%-й уксус, а более концентрированный уксус для производства консервов получают двухступенчатой ферментацией. Около 70% всего производимого в мире столового уксуса получают в ферментерах, изобретенных Фрингсом (способ Фрингса). Их количество в мире превышает 700. Альтернативой биореактору Фрингса является эрлифтный реактор с иммобилизованными уксуснокислыми бактериями: этот метод позволяет получать высокий выход продукта (свыше 100 г/л), однако пока редко используется в промышленных масштабах.
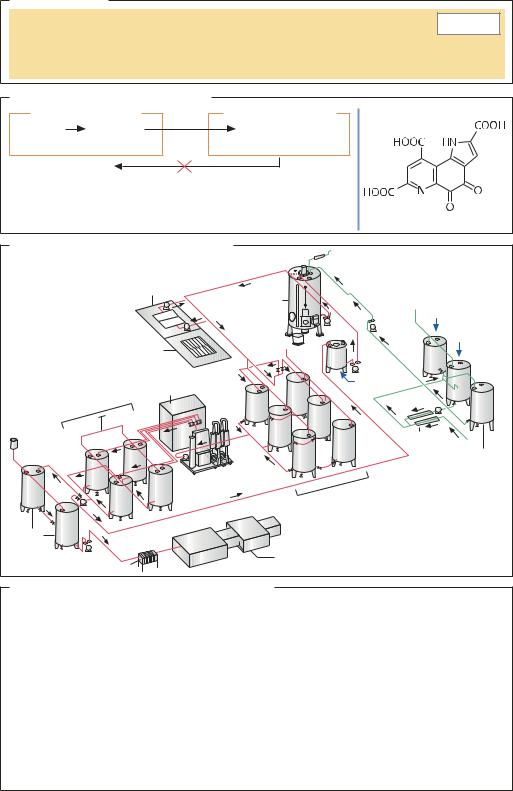
Уксусная кислота |
|
|
|
|
|
С2Н4О2 |
|
|
|
Н3С—СОOН |
|
MR |
60,05 |
|
Химический синтез: |
||
|
|
|
|||
Ткип |
117,9 °С |
|
|
|
|
pKa |
4,76 (25 °С) |
|
окисление этилена |
|
|
Код CAS |
67-19-7 |
|
или реакция СО с метанолом |
|
|
Биосинтез с участием Acetobacter sp. |
|
|
|||
Алкогольдегидрогеназа |
|
Альдегиддегидрогеназа |
|
||
С2Н5ОН |
Н3С—СНО |
|
Н3С—СОOН |
|
|
|
(ацетальдегид) |
(уксусная кислота) |
|
|
|
|
Н2О + СО2 |
|
|
|
|
|
«полное окисление» |
|
|
||
Мембраносвязанные ПХХ-зависимые дегидрогеназы передают на убихинон |
|
||||
высвобождаемые при окислении электроны, которые затем поступают |
|
||||
на терминальную оксидазу – также мембраносвязанный фермент. |
Пирроллхинолинхинон (ПХХ) |
||||
Ферментация и дальнейшая переработка |
|
|
|||
|
Система охлаждения |
|
|
||
|
|
|
Аппарат Фрингса |
Вино |
|
|
|
|
|
|
|
|
|
|
|
|
94% этанол |
Аварийный блок питания |
|
|
|||
Резервуары |
Мембранный фильтр |
Питательные |
|
||
для разбавления |
вещества |
|
|||
уксусной кислоты |
|
|
|
|
|
|
|
|
|
Смеши- |
|
|
|
|
|
вание |
Сусло |
|
|
|
|
с водой |
|
|
|
|
|
|
|
|
|
|
|
Резервуары |
|
|
|
|
|
для хранения |
|
|
|
|
|
уксусной кислоты |
|
Розлив |
|
|
|
|
|
уксуса |
|
|
Розлив пастеризованного уксуса |
|
|
|
Пастеризация |
|
|
||
|
|
|
|
|
|
Другие технологии получения уксусной кислоты
|
Максимальное |
Продуктивность |
Особенности |
|
|
содержание |
процесса, |
|
|
|
уксусной кислоты, % |
л/м3 в сут. |
|
|
Стандартный метод |
15 |
35–50 |
Простой технологический процесс |
|
(с периодическим режимом) |
|
|
|
|
Одностадийный процесс |
18,5 |
30–50 |
Высокая концентрация конечного |
|
с высоким выходом |
|
|
продукта, низкие затраты на хранение |
|
уксусной кислоты |
|
|
и транспортировку |
|
Двухстадийный процесс |
Более 20 |
30–50 |
Высокая концентрация конечного |
|
с высоким выходом |
|
|
продукта, низкие затраты на хранение |
|
уксусной кислоты |
|
|
и транспортировку |
|
Непрерывный |
Более 10 |
До 60 |
Высокая концентрация конечного |
|
ферментативный |
|
|
продукта, более низкие затраты |
|
процесс |
|
|
на хранение и транспортировку |
|
Иммобилизованные |
Менее 9 |
– |
Эрлифтные реакторы; |
|
уксуснокислые бактерии |
|
|
работают на протяжении 460 сут. |
|
(стадия испытаний) |
|
|
|
25 |
|
|
|
|
|
Спирты, кислоты и аминокислоты
Лимонная кислота
ВВЕДЕНИЕ. В 1822 г. Карл Вильгельм Шееле впер- |
ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ИЗ САХАРОВ. Для |
вые выделил D-лимонную кислоту из лимонного со- |
промышленного производства лимонной кислоты ис- |
ка и изучил ее свойства. Значительные количества |
пользуют твердофазную ферментацию сахаров под |
этой кислоты содержатся во многих фруктовых со- |
действием A. niger. В открытые металлические ре- |
ках. Хансу Кребсу принадлежит одно из самых заме- |
зервуары, устойчивые к кислой среде, помещают |
чательных открытий в биохимии: в 1937 г. он пока- |
раствор сахаров и споры гриба. Для дополнительной |
зал, что лимонная кислота является ключевым |
аэрации и отведения тепла в суспензию пропускают |
соединением аэробного обмена веществ (цикл три- |
воздух с интенсивностью до 10 объемов ферментера |
карбоновых кислот, цикл Кребса). За сутки в орга- |
в минуту. Через пять суток образуется хорошо разви- |
низме взрослого человека образуется около 1,5 кг |
тый мицелий, в котором активируется синтез лимон- |
лимонной кислоты, которая затем подвергается |
ной кислоты (продолжительность всего процесса |
дальнейшим превращениям. Лимонная кислота – |
8 сут.). После удаления мицелия проводят экстрак- |
сильная кислота с трехступенчатой диссоциацией: |
цию горячей водой и осаждение цитрата. Выход про- |
рКа при 25 °С составляют 3,13, 4,78 и 6,43 соот- |
дукта достигает 50 г/кг сахара. В современной |
ветственно. В 1%-м растворе лимонной кислоты |
промышленности цитрат получают в башенных био- |
рН 2,2. Наличие трех карбоксильных и одной гидро- |
реакторах или реакторах с механическим перемеши- |
ксильной группы определяет способность лимонной |
ванием в стерильных условиях. Объем таких реакто- |
кислоты к образованию комплексов с двух- и трехва- |
ров от 100 до 500 м3. рН продукта на выходе ~2,0, |
лентными катионами. Промышленное получение ли- |
поэтому ферментеры должны быть выполнены из ус- |
монной кислоты основано на ферментативном про- |
тойчивой к агрессивной среде высококачественной |
цессе. Мировое производство лимонной кислоты |
стали. В качестве экономически выгодного сырья ис- |
составляет 1 200 000 т в год (2005), объем рын- |
пользуют гидролизат крахмала или дешевые источ- |
ка – около 1 200 млрд долларов США. Лимонная |
ники сахарозы. Эффективность образования цитрата |
кислота используется как подкислитель и консерви- |
зависит от содержания ионов марганца в среде: |
рующий агент в пищевой промышленности, компле- |
в среде с низким содержанием марганца (менее |
ксообразователь в металлургии, средство для смяг- |
2 мкг/л) синтезируется большое количество продук- |
чения воды при производстве стиральных порошков |
та. Наращивание клеточной массы завершается че- |
и для неотложной помощи при тяжелых отравлениях |
рез 48 ч роста при рН 5. Последующее искусствен- |
солями металлов. |
ное закисление среды до рН 2,5, добавление сахаров |
МИКРООРГАНИЗМЫ И БИОСИНТЕЗ. Некоторые плес- |
при непрерывной ферментации и интенсификация |
невые грибы, в частности Aspergillus niger, в услови- |
аэрации способствуют образованию лимонной кисло- |
ях избытка глюкозы и интенсивной аэрации во время |
ты. Продукт выделяется клетками во внеклеточную |
экспоненциальной фазы роста и после ее окончания |
среду. В расчете на потребленную глюкозу выход ли- |
выделяют в среду значительное количество лимон- |
монной кислоты более 80%. По завершении фер- |
ной кислоты. Несмотря на то что многие промежу- |
ментации мицелий отфильтровывают, в раствор цит- |
точные продукты цикла Кребса оказывают регулятор- |
рата добавляют Ca(OH)2, далее цитрат кальция |
ное влияние на другие процессы обмена веществ, |
переводят в кислоту серной кислотой. Сырой продукт |
возможно создание штаммов A. niger – суперпроду- |
обрабатывают активированным углем и пропускают |
центов лимонной кислоты. Во-первых, запас оксало- |
через ионообменную колонку. В растворе кристалли- |
ацетата постоянно растет за счет активности находя- |
зуется очень чистая лимонная кислота. Расход гипса |
щиейся в цитоплазме пируваткарбоксилазы, которая |
более 1 т/т лимонной кислоты. В настоящее время |
катализирует присоединение молекулы СО2 к пиру- |
большое распространение получает другой более |
вату с образованием оксалоацетата (анаплеротиче- |
экономичный способ очистки лимонной кислоты: по- |
ская, т. е. возмещающая реакция). Во-вторых, ли- |
сле реакции цитрата с трилауриламином продукт эк- |
монная кислота синтезируется в митохондриях, |
страгируют с помощью алканов и 1-октанола. Раство- |
секретируется в цитоплазму, а затем выводится из |
рители и трилауриламин можно вновь использовать |
клетки. Причина существования такого направленно- |
после соответствующей обработки. В последние годы |
го транспорта в том, что цитоплазматическая малат- |
был разработан метод получения D-лимонной кисло- |
дегидрогеназа катализирует превращение оксалоаце- |
ты из фракций нефти с помощью особого штамма |
тата в яблочную кислоту, молекулы которой |
дрожжей. Проект был доведен до этапа создания пи- |
проникают в митохондрии, заменяя молекулы лимон- |
лотной установки, однако в связи с резким повыше- |
ной кислоты (принцип антипорта). |
нием цен на нефть пока отложен. |
26

Лимонная кислота |
|
|
|
|
|
|
|
С6Н8О7 |
|
|
Код СAS 77-92-9 |
|
|
|
|
MR |
|
192,12 |
|
|
|
|
|
Растворимость |
|
600 г/л воды (20 °С) |
|
|
|
|
|
Кислотные свойства |
рKa1 = 3,128 (25 °С); в 1%-м водном растворе лимонной кислоты рН 2,2 |
|
|||||
Комплексообразование (lgK): Fe3+ 12,5, Ca2+ 4,68, Cu2+ 3,98 (при 20 °С) |
|
|
|
||||
Источники и применение |
|
|
|
|
|
||
Источники |
|
г/кг |
|
|
Пищевая и косметическая |
||
|
|
|
|
|
промышленность |
|
|
Лимоны |
|
40–80 |
|
|
65% |
|
|
Грейпфруты |
|
12–21 |
|
|
Медицина 10% |
|
|
Малина |
|
10–13 |
|
|
|
||
|
|
|
|
|
|
||
Черная смородина |
15-30 |
|
|
|
|
|
|
Клубника |
|
6–8 |
|
|
|
|
|
Томаты |
|
2,5 |
|
|
Техника 25% |
|
|
Биосинтез в Aspergillus niger |
|
|
|
|
|
||
Глюкоза |
|
Промышленное |
Воздух |
|
|
||
|
|
|
получение цитрата: |
СО2 + воздух |
|
||
Фосфоенолпируват |
|
|
|
||||
Ме- |
Питательные |
|
Aspergillus niger |
||||
|
|
|
|
||||
|
|
|
|
|
|
||
Пируват |
|
|
ласса |
вещества, вода |
|
|
|
|
|
|
|
|
|
|
|
Ацетил-КоА |
|
|
|
|
|
||
|
|
|
|
Стерилизация |
|
|
|
1 |
|
3 |
|
|
|
|
|
Оксалоацетат |
|
Цитрат |
|
|
Ферментер |
Клеточная |
|
|
|
|
|
|
|||
2 |
4 |
|
Известь |
Са(ОН)2 |
|
масса |
|
|
|
|
|||||
|
цис-Аконитат |
|
|
||||
|
|
|
|
|
|
|
|
Малат |
|
|
|
|
|
|
|
Фумарат |
|
Изоцитрат |
фильтрация |
осаждение |
Фильтры |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
CaSO4 |
|
Сукцинат |
|
2-Оксоглутарат |
|
|
|
|
|
|
|
|
|
|
|
|
|
Анаплеротические реакции |
|
|
осаждение |
фильтрация |
|||
цикла трикабоновых кислот: |
|
|
|||||
|
|
|
|
|
|||
1 Пируваткарбоксилаза (в цитоплазме) |
Центрифуги- |
Кристаллизация |
|
Концентри- |
|||
2 Малатдегидрогеназа (в цитоплазме) |
|
||||||
рование |
|
рование |
|||||
3 Цитратсинтаза (в митохондриях) |
|
|
|||||
|
|
|
|
|
|||
4 Цитрат/малат-антипортер |
|
|
|
|
|
||
(мембрана митохондрий) |
Кристаллическая лимонная кислота |
|
|
||||
Ферментация и переработка |
|
|
|
|
|
||
Инокулят, |
|
Предфер- |
|
Основная |
|
Удаление |
|
|
Очистка |
|
питательная |
|
ментация |
|
ферментация |
|
мицелия |
|
|
|
|
|
|
Осаждение: |
Выход |
|||||||
среда |
|
|
|
|
|
|
|
|||
|
Биореактор |
Биореактор объемом |
|
Вращающиеся |
1. |
Са(ОН)2 |
||||
|
|
|
лимонной |
|||||||
Крахмал, |
объемом |
400 м3 из кислото- |
|
фильтры |
2. |
Н2SO4 |
кислоты – |
|||
меласса, |
40 м3 |
устойчивого мате- |
|
|
3. |
пере- |
более 200 г/л |
|||
источник |
|
|
риала, 8 сут. при |
|
|
|
|
кристал- |
||
|
|
|
|
|
|
через 150 ч |
||||
азота, соли |
|
|
32 °С; после завер- |
|
|
|
|
лизация |
||
|
|
|
|
|
|
ферментации |
||||
|
|
|
|
шения фазы роста |
|
|
|
|
|
|
|
|
|
|
закисление среды |
|
|
|
|
|
|
|
|
|
|
от pH 5,0 до 2,0 |
|
|
|
|
|
|
27
