
- •Содержание
- •Предисловие
- •Предисловие ко 2-му изданию
- •Введение
- •Этапы развития биотехнологии
- •Биотехнология сегодня
- •Биотехнологическое производство пищевых продуктов
- •Алкогольные напитки
- •Пивоварение
- •Ферментация в пищевой промышленности
- •Пищевые продукты и молочнокислое брожение
- •Этиловый спирт
- •1-Бутанол, ацетон
- •Уксусная кислота
- •Лимонная кислота
- •Молочная и глюконовая кислоты
- •Аминокислоты
- •L-Глутаминовая кислота
- •D,L-Метионин, L-лизин и L-треонин
- •Антибиотики
- •Антибиотики: источники, применение и механизмы действия
- •Антибиотики: получение. Устойчивость к антибиотикам
- •β-Лактамные антибиотики: промышленное получение
- •Гликопептидные, полиэфирные и нуклеозидные антибиотики
- •Аминогликозидные антибиотики
- •Тетрациклины, хиноны, хинолоны и другие ароматические антибиотики
- •Поликетидные антибиотики
- •Получение новых антибиотиков
- •Специальные продукты
- •Витамины
- •Нуклеозиды и нуклеотиды
- •Биодетергенты и биокосметика
- •Микробные полисахариды
- •Биоматериалы
- •Биотрансформация
- •Биотрансформация стероидов
- •Ферменты
- •Ферменты
- •Ферментативный катализ
- •Ферменты в клинических анализах
- •Тесты с помощью ферментов
- •Применение ферментов в промышленных технологиях
- •Ферменты в производстве моющих средств
- •Ферменты, расщепляющие крахмал
- •Ферментативное расщепление крахмала в промышленности
- •Ферментативное превращение сахаров
- •Утилизация целлюлозы и полиозы
- •Использование ферментов в целлюлозно-бумажной промышленности
- •Пектиназы
- •Ферменты в производстве молочных продуктов
- •Использование ферментов в хлебобулочной и мясоперерабатывающей промышленности
- •Ферменты в кожевенной и текстильной промышленности
- •Перспективы получения ферментов для промышленных технологий
- •Белковая инженерия
- •Пекарские и кормовые дрожжи
- •Пекарские и кормовые дрожжи
- •Белки и жиры из одноклеточных организмов
- •Аэробная очистка сточных вод
- •Анаэробная очистка сточных вод и переработка ила
- •Биологическая очистка газовых выбросов
- •Биологическая очистка почв
- •Микробиологическое выщелачивание руд и биокоррозия
- •Инсулин
- •Гормон роста и другие гормоны
- •Гемоглобин, сывороточный альбумин и лактоферрин
- •Факторы свертывания крови
- •Антикоагулянты и тромболитики
- •Ингибиторы ферментов
- •Иммунная система
- •Стволовые клетки
- •Тканевая инженерия
- •Интерфероны
- •Интерлейкины
- •Эритропоэтин и другие факторы роста
- •Другие белки, имеющие медицинское значение
- •Вакцины
- •Рекомбинантные вакцины
- •Антитела
- •Моноклональные антитела
- •Рекомбинантные и каталитические антитела
- •Методы иммуноанализа
- •Биосенсоры
- •Биотехнология в сельском хозяйстве
- •Животноводство
- •Перенос эмбрионов и клонирование животных
- •Картирование генов
- •Трансгенные животные
- •Генетическая ферма и ксенотрансплантация
- •Растениеводство
- •Культивирование растительных клеток: поверхностные культуры
- •Культивирование растительных клеток: суспензионные культуры
- •Трансгенные растения: методы получения
- •Трансгенные растения
- •Вирусы
- •Бактериофаги
- •Микроорганизмы
- •Бактерии
- •Некоторые бактерии, важные для биотехнологии
- •Грибы
- •Дрожжи
- •Усовершенствование штаммов микроорганизмов
- •Основы биотехнологических методов
- •Микроорганизмы: рост в искусственных условиях
- •Кинетика образования продуктов метаболизма и биомассы в культуре микроорганизмов
- •Технология ферментации
- •Промышленные процессы ферментации
- •Культивирование животных клеток
- •Биореакторы для культивирования животных клеток
- •Биореакторы с иммобилизованными ферментами и клетками
- •Очистка биотехнологических продуктов
- •Очистка биотехнологических продуктов: хроматографические методы
- •Экономические аспекты биотехнологического производства
- •Методы генетической инженерии
- •Структура ДНК
- •Функции ДНК
- •Эксперимент в генетической инженерии
- •Методы выделения ДНК
- •Ферменты, модифицирующие ДНК
- •ПЦР: лабораторная практика
- •ДНК: химический синтез и определение размера молекул
- •Секвенирование ДНК
- •Введение ДНК в живые клетки (трансформация)
- •Идентификация и клонирование генов
- •Экспрессия генов
- •Выключение генов
- •Геном прокариот
- •Геном эукариот
- •Геном человека
- •Функциональный анализ генома человека
- •ДНК-анализ
- •Белковые и ДНК-чипы
- •Маркерные группы
- •Тенденции развития
- •Генная терапия
- •Поиск биологически активных веществ
- •Протеомика
- •Обмен веществ
- •Метаболомика и метаболическая инженерия
- •Системная биология
- •«Белая» биотехнология
- •Сертификация биотехнологической продукции
- •Этические аспекты генетической инженерии
- •Патентование в биотехнологии
- •Биотехнология в разных странах
- •Биотехнология в разных странах
- •Литература
- •Источники иллюстраций
- •Указатель микроорганизмов
Антибиотики
54
Тетрациклины, хиноны, хинолоны и другие ароматические антибиотики
ВВЕДЕНИЕ. Благодаря широкому спектру действия антибиотики группы тетрациклинов находят широкое применение как в медицине, так и в ветеринарии (2004 г.: 880 млн долл.). Производные налидиксовой кислоты (антибиотики ряда хинолонов) также обладают широким антимикробным спектром действия и после лактамных антибиотиков являются наиболее часто используемыми в современной медицине. Объем рынка хинолонов в 2004 г. превысил 5,8 млрд долл. США.
Тетрациклины. С тех пор как в 1945 г. впервые был описан хлортетрациклин, продукт жизнедеятельности
Streptomyces aureofaciens, появилось множество производных тетрациклина. Для человека эти вещества слаботоксичны, но эффективно действуют против грамотрицательных и грамположительных бактерий, риккетсий, микоплазм, лептоспир, спирохет и некоторых крупных вирусов. Антимикробное действие антибиотиков тетрациклинового ряда основано на том, что они связываются с 70S-субъединицей прокариотической рибосомы и тем самым препятствуют синтезу белка. К сожалению, в некоторых странах неумеренное добавление этих антибиотиков в корма в птицеводстве и свиноводстве привело к появлению резистентных штаммов, число которых неуклонно растет. Наиболее часто механизм устойчивости к действию антибиотика заключается в изменении свойств внешней клеточной оболочки, в результате чего антибиотик не проникает внутрь клетки. Кроме того, в клетке могут синтезироваться так называемые тет-белки, которые осуществляют активный транспорт молекул антибиотика из клетки. Гены таких белков находятся в плазмидах. Тетрациклины образуются в процессе жизнедеятельности стрептомицетов. Биосинтез включает более 70 реакций, в результате которых из глюкозы образуются поликетидные производные, в том числе окситетрациклин. В промышленности для получения тетрациклиновых антибиотиков клетки штаммов-суперпродуцентов культивируют в биореакторах с большим рабочим объемом. Для получения высоких выходов продукта (до 25 г/л) необходимо, чтобы в среде поддерживался высокий уровень кислорода, а концентрация фосфатов не превышала оптимального значения. После проведения ферментации клетки удаляют из культуральной жидкости, методом многоступенчатой экстракции н-бутилацетатом выделяют антибиотик, а затем очищают его посредством ионообменной хроматографии.
Антрациклины. Действие антрациклиновых гликозидов, например доксорубицина (адриамицина), заключается в ингибировании ферментов-топоизомераз путем интеркаляции, что приводит к прекращению репликации ДНК. В клинической медицине эти препараты используют при лечении злокачественных опухолей. Промышленное получение антрациклиновых антибиотиков основано на ферментации.
Хинолоны. Бактерицидный эффект налидиксовой кислоты – промежуточного продукта химического синтеза антималярийного препарата хлороквина – был открыт еще в 1962 г., однако лишь в 1977 г. удалось показать, что механизм действия этого антибиотика заключается в ингибировании бактериальной топоизомеразы (гиразы А). Структуры прокариотической и эукариотической топоизомераз значительно отличаются, поэтому антибиотики ряда хинолонов не взаимодействует с эукариотическим ферментом, а значит обладают низкой токсичностью для человека. Для хинолоновых антибиотиков характерен широкий спектр антимикробного действия: грамположительные и грамотрицательные бактерии, микобактерии, хламидии, анаэробные бактерии и др. Развитие резистентности у микроорганизмов может быть результатом модификаций гиразы или пониженной проницаемости клеточной мембраны для молекул антибиотика. Поскольку гены, ответственные за возникновение такой резистентности, находятся в хромосоме, а не в плазмиде, образование новых устойчивых штаммов протекает чрезвычайно медленно. Из более чем 5000 производных хинолона, получаемых исключительно методом химического синтеза, многие находят широкое применение в медицине, например ципрофлоксацин (Ciprobay®), действующий против Bacillus anthracis.
Хлорамфеникол был выделен из Streptomyces venezuelae еще в 1950 г., однако в современном производстве этот антибиотик получают исключительно методом химического синтеза. Предшественник хлорамфеникола хоризмовая кислота образуется как промежуточный продукт при биосинтезе ароматических аминокислот. Хлорамфеникол был первым антибиотиком с широким спектром антимикробного действия; он активен против многих грамотрицательных и грамположительных бактерий, актиномицетов, риккетсий и крупных вирусов. Однако из-за нежелательных побочных эффектов, в том числе затрагивающих костный мозг, в современной медицине хлорамфеникол используется только в качестве резервного препарата при лечении тифа и инфекционных заболеваний, вызванных шигеллами и риккетсиями. Механизм действия заключается в связывании молекул антибиотика с 50S-субъединицей 70S-рибосом, что приводит к ингибированию активности пептидилтрансферазы.
Гризеофульвин – производное бензофурана, применяется в качестве фунгицида. Действие гризеофульвина заключается в том, что он препятствует митозу в клетках грибов, в результате чего образуются морфологически измененные и функционально неполноценные гифы. Этот антибиотик получают путем ферментации и используют для лечения грибковых заболеваний кожи человека, а также для защиты растений от различных заболеваний типа мучнистой росы.
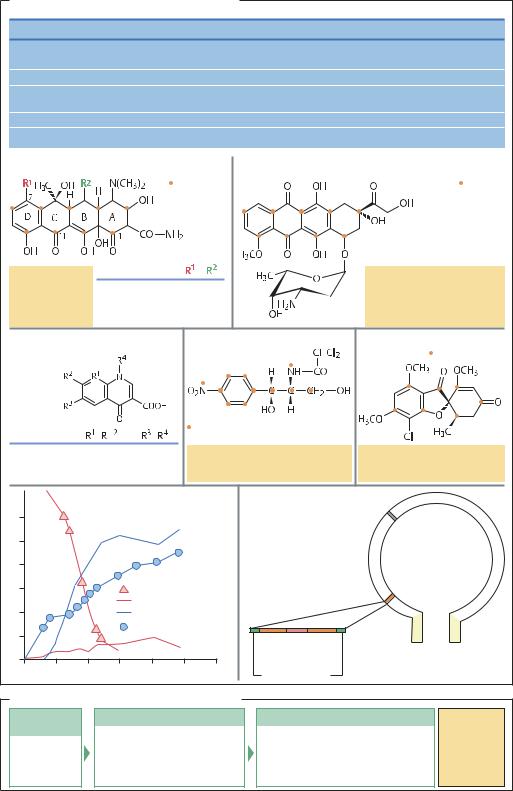
Хиноидные и ароматические антибиотики |
|
|
|
|
|
||||||||
|
|
|
|
Продуцент |
|
|
Применение |
|
|
|
|
||
(Хлор-)тетрациклин |
Streptomyces aureofaciens |
Антибиотик широкого спектра действия; |
|||||||||||
Окситетрациклин |
|
Streptomyces rimosus |
используется в медицине и ветеринарии |
||||||||||
Антрациклины |
|
|
S. peucetius |
|
|
Терапия онкологических заболеваний |
|||||||
Хинолоны |
|
|
Химический синтез |
Антибиотик широкого спектра действия; |
|||||||||
|
|
|
|
|
|
|
|
|
используется в медицине и скотоводстве |
||||
Хлорамфеникол |
|
Химический синтез |
Антибиотик широкого спектра действия |
||||||||||
Гризеофульвин |
|
|
Penicillium griseofulvum |
Борьба с грибковыми заболеваниями растений |
|||||||||
Тетрациклины |
|
|
|
|
|
|
Доксорубицин – представитель антрациклинов |
||||||
|
|
|
|
|
|
С1 из |
|
|
|
|
|
С1 из |
|
|
|
|
|
|
|
ацетата |
|
|
|
|
ацетата |
||
Хлортетрациклин |
|
|
|
|
|
|
|
С27Н29NO11 |
|
|
|||
С22Н23ClN2O8 |
|
Тетрациклин |
|
H |
|
H |
|
MR |
|
543,53 |
|||
MR |
478,89 |
Хлортетрациклин |
Cl |
H |
|
Tпл |
|
204–205 °С |
|||||
Код CAS |
57-62-5 |
Окситетрациклин |
H |
|
OH |
|
Код CAS |
23214-92-8 |
|||||
Налидиксовая кислота |
|
|
Хлорамфеникол |
Гризеофульвин |
|
||||||||
и ципрофлоксацин – хинолиновые |
|
|
|
|
|
|
|
С1 из ацетата |
|||||
антибиотики |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
из р-Аминофенилаланина |
|
|
|
|
||
Налидиксовая |
N |
СН3 |
Н |
СН3 |
|
С11Н12Cl2N2O5 |
С17Н17ClO2 |
|
|
||||
кислота |
|
|
|
|
|
|
|
|
|||||
ЦипрофлоксацинCH С4Н9N2 |
F |
С3Н5 |
MR |
323,13 |
Код CAS 56-75-7 |
MR |
352,77 |
Код CAS 126-07-8 |
|||||
|
|
|
|
|
|
|
|
|
|
ori |
|
|
|
мг/л |
|
|
|
|
|
|
|
|
|
|
Streptomyces |
||
|
|
|
|
|
|
|
|
|
|
|
rimosus |
||
Концентрация, |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Хлортетрациклин |
Кластер генов, |
|
Линейная хромосома |
|||||||
|
|
|
|
|
|
|
|
|
участвующих |
|
~ 8 млн п.н., |
||
|
|
|
|
Хлорид |
|
|
|
в биосинтезе |
|
Содержание GC ~71% |
|||
|
|
|
|
Тетрациклин |
|
|
окситетрациклина |
|
|
|
|
||
|
|
|
|
|
|
(~ 30 т.п.н.) |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Объем мицелия |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Поликетидсинтаза |
|
Hестабильные |
||
|
|
|
|
|
|
|
|
|
|
|
|||
0 |
20 |
40 |
60 |
80 |
|
100 |
|
120 ч |
Гены |
|
теломерные участки |
||
|
|
устойчивости |
|
(~ 550 т.п.н.) |
|||||||||
Ферментация и очистка хлортетрациклина |
|
|
|
|
|
||||||||
Предфер- |
|
|
Биореактор |
|
|
Выделение и очистка |
|
Выход |
|||||
ментация |
|
Объем до 150 м3, сахароза, |
Удаление мицелия при пропускании |
||||||||||
|
продукта |
||||||||||||
|
|
|
|||||||||||
Штамм-супер- |
|
жидкий кукурузный экстракт, |
культуры через фильтровальный пресс |
~ 10 г/л |
|||||||||
продуцент |
|
соли, аэрация с интенсивностью |
или сепаратор; многостадийная |
|
после 140 ч |
||||||||
Streptomyces |
|
1 объем реактора/мин, |
|
экстракция н-бутилацетатом, очистка |
ферментации |
||||||||
aureofaciens |
|
28 °С, рН 5,8–6,0; 60–65 ч |
ионообменной хроматографией |
|
55 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Антибиотики
Поликетидные антибиотики
ВВЕДЕНИЕ. К этой обширной группе относятся макро- |
рые синтезируются только дрожжами и грибами. Та- |
||
лидные, полиеновые, макротетролидные и ансамици- |
ким образом, антибиотики класса полиенов не эффе- |
||
новые антибиотики. Общим в их структуре является |
ктивны в борьбе с бактериями. Амфотерицин В и ни- |
||
наличие макроциклического лактонового или лактам- |
статин используются при грибковой инфекции |
||
ного кольца, которое образуется из длинной цепи ос- |
Candida albicans, а пимарицин – в производстве сыра |
||
татка полигидроксижирной кислоты с концевой гид- |
в качестве консерванта. Полиеновые антибиотики об- |
||
роксильной или |
аминогруппой. |
Циклическая |
ладают нефро- и гепатотоксичными свойствами, поэ- |
молекула может содержать остатки редких сахаров |
тому их применяют только при тяжелых заболевани- |
||
(макролидные антибиотики), ароматические хромо- |
ях. Химическая лабильность этих антибиотиков не |
||
форные группы (ансамицин), участки, представляю- |
позволяет использовать их в качестве противогриб- |
||
щие собой диены (полиеновые антибиотики) или |
кового средства для защиты растений. |
||
иметь структуру полилактона (макротетролидные ан- |
АНСАМИЦИН – это макролактамный антибиотик, со- |
||
тибиотики). Большинство поликетидных антибиоти- |
держащий молекулу ароматического хромофора. |
||
ков образуются в клетках стрептомицетов как вторич- |
Важнейший заменитель ансамицина – рифамицин – |
||
ные метаболиты. |
Препараты |
поликетидных |
синтезируется в Amycolatopsis mediterranei. Оба они |
антибиотиков применяются в медицине, животновод- |
эффективно действуют против грамположительных |
||
стве и пищевой промышленности. Объем рынка мак- |
бактерий и микобактерий. Рифампицин – полусинте- |
||
ролидных антибиотиков медицинского назначения в |
тический антибиотик, в настоящее время является |
||
2004 г. составил 5,7 млрд долл. США. |
важнейшим препаратом, используемым для лечения |
||
МАКРОЛИДНЫЕ АНТИБИОТИКИ – это липофильные |
туберкулеза (возбудитель – Mycobacterium tubercu- |
||
вещества с сильновыраженными основными свойства- |
losis) и проказы. Механизм действия рифампицина |
||
ми. Они представляют собой 10–60-членные макро- |
заключается в связывании β-субъединицы ДНК-за- |
||
циклические лактоны. Синтез этих молекул происхо- |
висимой РНК-полимеразы бактерий. Таким образом, |
||
дит в ходе повторяющихся циклов конденсации |
антибиотик препятствует процессу транскрипции в |
||
аналогично синтезу длинноцепочечных жирных кис- |
бактериальной клетке. Связывания рифампицина с |
||
лот: наращивание цепи происходит в реакциях, катали- |
эукариотическими РНК-полимеразами не происхо- |
||
зируемых поликетидсинтазой. Макролидные антибио- |
дит, поэтому антибиотик успешно используется для |
||
тики слаботоксичны, поэтому их применяют в |
лечения человека. Устойчивость некоторых штаммов |
||
педиатрии. Механизм действия заключается в ингиби- |
к действию рифампицина вызвана изменениями |
||
ровании синтеза белка в клетках грамположительных |
структуры РНК-полимеразы в результате мутаций. |
||
микроорганизмов: молекула антибиотика связывается |
ФЕРМЕНТАЦИЯ И ОЧИСТКА. Для промышленного |
||
с 50S-субъединицей бактериальной рибосомы, что |
производства поликетидных антибиотиков осуществ- |
||
препятствует процессу транслокации растущей поли- |
ляют ферментацию в биореакторах большого объема |
||
пептидной цепи. Устойчивость некоторых штаммов к |
с использованием штаммов-суперпродуцентов. Так, |
||
действию макролидных антибиотиков связана с мети- |
для получения эритромицина применяют штамм Sac- |
||
лированием 23S-рРНК: вероятно, из-за этого не про- |
charopolyspora erythraea (прежнее название – Strep- |
||
исходит связывания молекулы антибиотика с рибосо- |
tomyces erythreus), позволяющий получать до 7 г |
||
мой. Азитромицин, кларитромицин, эритромицин и |
продукта с литра среды после 72 ч ферментации. Ан- |
||
спирамицин используют для лечения бактериальных |
тибиотики выделяются во внеклеточную среду, |
||
инфекций дыхательных путей. Структурно сходный ти- |
откуда их экстрагируют с помощью растворителей, |
||
лозин благодаря своей высокой эффективности был |
а затем очищают хроматографическими методами. |
||
использован против микоплазмоза как добавка к кор- |
|
||
му свиней, что привело к его запрету в странах ЕС (но |
|
||
не в США) из-за высокого риска развития устойчиво- |
|
||
сти патогена. |
|
|
|
ПОЛИЕНОВЫЕ АНТИБИОТИКИ – продукты вторичного метаболизма стрептомицетов; в молекуле этих антибиотиков имеется 26–38-членное лактоновое кольцо, в которое встроена 3–7-членная молекула диена. Диены могут содержать различные боковые группы, в частности остатки аминосахаров, присоединенные гликозидной связью. Действие полиеновых антибиотиков объясняется их взаимодействием с микостеро-
56 лами (например, эргостеролом) – веществами, кото-
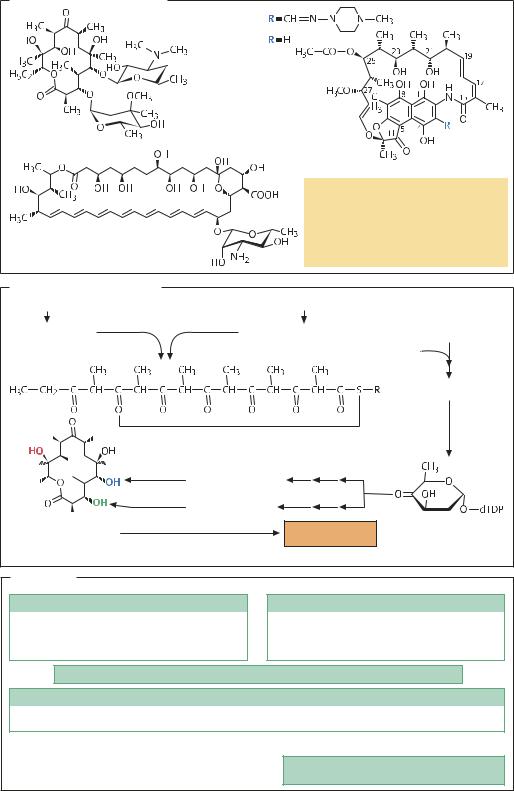
Поликетидные антибиотики |
|
|
|
|
|
|
||
а |
|
|
|
б Рифампицин |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
в Рифамицин |
|
|
|
|
Эритромицин |
|
|
|
|
|
|
|
|
г |
|
|
|
|
|
|
|
|
|
|
|
|
|
a С37Н67NO13 |
б С43Н58N4O12 |
||
|
|
|
|
|
MR |
733,94 |
MR |
822,95 |
|
|
|
|
|
Код CAS 114-07-8 |
Код CAS 13292-46-1 |
||
|
|
|
|
|
в С37Н47NO12 |
г С47Н73NO17 |
||
|
|
|
|
|
MR |
697,78 |
MR |
924,09, |
|
Амфотерицин В |
|
|
Код CAS 6998-60-3 |
Код CAS 1397-89-31 |
|||
|
|
|
|
|
|
|
||
Биосинтез эритромицина А |
|
|
|
|
|
|
||
1 × пропионовая кислота |
|
|
|
6 × сукцинил-KоА |
|
|
||
1 × пропионил-KоА |
|
|
|
6 × 2-метилмалонил-KоА |
2 × D-глюкоза |
|||
|
|
|
|
|
|
2 × дТТФ* |
|
|
|
|
|
|
|
|
|
2 × дТДФ-глюкоза |
|
Гидрокси- |
|
|
|
|
|
|
|
|
лирование |
|
Поликетид, связанный с ферментом |
|
|
|
|||
|
|
|
(предполагаемая стадия) |
|
|
|
||
|
|
Гликози- |
|
дТДФ-D-дезозамин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лирование |
дТДФ-L-микароза |
|
|
|
||
|
|
|
|
|
|
|
||
Эритромицин С |
|
|
|
Эритромицин А |
2 × дТДФ-4-оксо- |
|||
|
|
|
6-дезокси-D-глюкоза |
|||||
|
|
Метилирование микарозы |
|
|||||
|
|
|
|
|
||||
* дТТФ – дезокситимидинтрифосфат |
|
|
|
|
|
|
||
Получение |
Эритромицин |
|
|
|
Рифамицин/Рифампицин |
|
||
|
|
|
|
|
||||
|
Ферментация |
|
|
|
Ферментация |
|
||
Штамм-суперпродуцент Saccharopolyspora erythrаea, |
Штамм-суперпродуцент Amycolatopsis mediterranei, |
|||||||
непрерывная ферментация в биореакторе объемом |
непрерывная ферментация в биореакторе объемом |
|||||||
более 120 м3, глюкоза, соевая мука, микроэлементы, |
более 120 м3, глюкоза, соевая мука, микроэлементы, |
|||||||
0,2–0,5% пропанол, 33 °С, 70–120 ч |
|
|
0,2–0,5% пропанол, 33 °С, 70–120 ч |
|
||||
Отделение клеточной массы с помощью фильтровального пресса или в сепараторах |
||||||||
Выделение и очистка
Экстракция в противотоке уксуснокислого эфира масляной кислоты, хроматографические методы, перекристаллизация
Выход продукта ~ 7 г/л эритромицина после 72 ч |
|
Выход продукта ~ 7 г/л рифамицина после 72 ч |
|
|
|
Четырехстадийный синтез рифампицина
по методу Манниха
57
