
- •Содержание
- •Предисловие
- •Предисловие ко 2-му изданию
- •Введение
- •Этапы развития биотехнологии
- •Биотехнология сегодня
- •Биотехнологическое производство пищевых продуктов
- •Алкогольные напитки
- •Пивоварение
- •Ферментация в пищевой промышленности
- •Пищевые продукты и молочнокислое брожение
- •Этиловый спирт
- •1-Бутанол, ацетон
- •Уксусная кислота
- •Лимонная кислота
- •Молочная и глюконовая кислоты
- •Аминокислоты
- •L-Глутаминовая кислота
- •D,L-Метионин, L-лизин и L-треонин
- •Антибиотики
- •Антибиотики: источники, применение и механизмы действия
- •Антибиотики: получение. Устойчивость к антибиотикам
- •β-Лактамные антибиотики: промышленное получение
- •Гликопептидные, полиэфирные и нуклеозидные антибиотики
- •Аминогликозидные антибиотики
- •Тетрациклины, хиноны, хинолоны и другие ароматические антибиотики
- •Поликетидные антибиотики
- •Получение новых антибиотиков
- •Специальные продукты
- •Витамины
- •Нуклеозиды и нуклеотиды
- •Биодетергенты и биокосметика
- •Микробные полисахариды
- •Биоматериалы
- •Биотрансформация
- •Биотрансформация стероидов
- •Ферменты
- •Ферменты
- •Ферментативный катализ
- •Ферменты в клинических анализах
- •Тесты с помощью ферментов
- •Применение ферментов в промышленных технологиях
- •Ферменты в производстве моющих средств
- •Ферменты, расщепляющие крахмал
- •Ферментативное расщепление крахмала в промышленности
- •Ферментативное превращение сахаров
- •Утилизация целлюлозы и полиозы
- •Использование ферментов в целлюлозно-бумажной промышленности
- •Пектиназы
- •Ферменты в производстве молочных продуктов
- •Использование ферментов в хлебобулочной и мясоперерабатывающей промышленности
- •Ферменты в кожевенной и текстильной промышленности
- •Перспективы получения ферментов для промышленных технологий
- •Белковая инженерия
- •Пекарские и кормовые дрожжи
- •Пекарские и кормовые дрожжи
- •Белки и жиры из одноклеточных организмов
- •Аэробная очистка сточных вод
- •Анаэробная очистка сточных вод и переработка ила
- •Биологическая очистка газовых выбросов
- •Биологическая очистка почв
- •Микробиологическое выщелачивание руд и биокоррозия
- •Инсулин
- •Гормон роста и другие гормоны
- •Гемоглобин, сывороточный альбумин и лактоферрин
- •Факторы свертывания крови
- •Антикоагулянты и тромболитики
- •Ингибиторы ферментов
- •Иммунная система
- •Стволовые клетки
- •Тканевая инженерия
- •Интерфероны
- •Интерлейкины
- •Эритропоэтин и другие факторы роста
- •Другие белки, имеющие медицинское значение
- •Вакцины
- •Рекомбинантные вакцины
- •Антитела
- •Моноклональные антитела
- •Рекомбинантные и каталитические антитела
- •Методы иммуноанализа
- •Биосенсоры
- •Биотехнология в сельском хозяйстве
- •Животноводство
- •Перенос эмбрионов и клонирование животных
- •Картирование генов
- •Трансгенные животные
- •Генетическая ферма и ксенотрансплантация
- •Растениеводство
- •Культивирование растительных клеток: поверхностные культуры
- •Культивирование растительных клеток: суспензионные культуры
- •Трансгенные растения: методы получения
- •Трансгенные растения
- •Вирусы
- •Бактериофаги
- •Микроорганизмы
- •Бактерии
- •Некоторые бактерии, важные для биотехнологии
- •Грибы
- •Дрожжи
- •Усовершенствование штаммов микроорганизмов
- •Основы биотехнологических методов
- •Микроорганизмы: рост в искусственных условиях
- •Кинетика образования продуктов метаболизма и биомассы в культуре микроорганизмов
- •Технология ферментации
- •Промышленные процессы ферментации
- •Культивирование животных клеток
- •Биореакторы для культивирования животных клеток
- •Биореакторы с иммобилизованными ферментами и клетками
- •Очистка биотехнологических продуктов
- •Очистка биотехнологических продуктов: хроматографические методы
- •Экономические аспекты биотехнологического производства
- •Методы генетической инженерии
- •Структура ДНК
- •Функции ДНК
- •Эксперимент в генетической инженерии
- •Методы выделения ДНК
- •Ферменты, модифицирующие ДНК
- •ПЦР: лабораторная практика
- •ДНК: химический синтез и определение размера молекул
- •Секвенирование ДНК
- •Введение ДНК в живые клетки (трансформация)
- •Идентификация и клонирование генов
- •Экспрессия генов
- •Выключение генов
- •Геном прокариот
- •Геном эукариот
- •Геном человека
- •Функциональный анализ генома человека
- •ДНК-анализ
- •Белковые и ДНК-чипы
- •Маркерные группы
- •Тенденции развития
- •Генная терапия
- •Поиск биологически активных веществ
- •Протеомика
- •Обмен веществ
- •Метаболомика и метаболическая инженерия
- •Системная биология
- •«Белая» биотехнология
- •Сертификация биотехнологической продукции
- •Этические аспекты генетической инженерии
- •Патентование в биотехнологии
- •Биотехнология в разных странах
- •Биотехнология в разных странах
- •Литература
- •Источники иллюстраций
- •Указатель микроорганизмов
Ферменты |
Ферменты в производстве молочных продуктов |
|
мые при производстве молочных продуктов, отно- |
есть расщепляет казеин в положении между 105Pro и |
|
|
ВВЕДЕНИЕ. Наиболее важные ферменты, используе- |
той же специфичностью, что и животный химозин, то |
|
сятся к протеазам, лактазам и липазам. 1. Самое |
106Met. Этот фермент широко применяется в про- |
|
большое промышленное значение имеют высоко- |
мышленности и получил название «бактериальный |
|
специфичные протеазы (сычужный фермент, |
сычужный фермент». В 1987 г. ген предшественника |
|
реннин). Объем мирового производства этих фер- |
сычужного фермента теленка был клонирован в клет- |
|
ментов составляет около 1000 т в год, с использо- |
ки E. coli как прохимозин, а с 1992 г. в США рекоби- |
|
ванием этих ферментов производства ~13 млн т |
нантный фермент разрешен к применению в сырова- |
|
сыра (2004 г.). 2. Обработка липазами и протеаза- |
рении. В странах ЕС и в Японии рекомбинантный |
|
ми придает сыру специфический аромат. 3. Процесс |
химозин используется с 1997 г. В качестве хозяй- |
|
производства многих молочных продуктов включает |
ских клеток в настоящее время предпочитают ис- |
|
расщепление молочного сахара. Эту реакцию осуще- |
пользовать Kluyveromyces lactis. |
|
ствляет β-галактозидаза (лактаза). 4. Особый |
РАСЩЕПЛЕНИЕ ЛАКТОЗЫ (МОЛОЧНОГО САХАРА). |
|
интерес вызывает использование молочной сыво- |
Все детеныши млекопитающих, в том числе наши |
|
ротки – побочного продукта молочной промышлен- |
дети, получающие материнское молоко, способны |
|
ности. Сыворотка образуется в больших количествах |
усваивать лактозу. Однако после перехода на «взрос- |
|
(около 50 млн тонн в год), и ее утилизация обходит- |
лую» пищу многие особи теряют эту способность. Яв- |
|
ся очень дорого. Однако сыворотка богата питатель- |
ление «непереносимости» лактозы встречается у лю- |
|
ными веществами и может быть использована как |
дей почти всех народов. «Непереносимость» лактозы |
|
питательная среда для роста микроорганизмов. |
заключается в том, что сахар не усваивается в же- |
|
5. В некоторых развивающихся странах для стерили- |
лудке, поэтому использование в пищу обычных мо- |
|
зации молочных продуктов применяют лизоцим или |
лочных продуктов, богатых лактозой, вызывает диа- |
|
Н2О2/каталазу. |
рею. Сходное по симптомам, однако обусловленное |
|
МОЛОКО. Молоко представляет собой эмульсию |
другими причинами редкое заболевание галактозе- |
|
мелких капелек жира в водном растворе. Для молока |
мия возникает в результате рецессивного дефекта |
|
характерен следующий химический состав: вода |
аутосомного гена. При галактоземии нарушается син- |
|
(90%), триглицерины (жиры) (2–4%), молочный са- |
тез УДФ-галактозы, поэтому в организме накаплива- |
|
хар и белки (в сумме около 3%). Основной компо- |
ется избыточное количество токсических продуктов |
|
нент белковой фракции молока – сложные фосфо- |
метаболизма галактозы. Больные галактоземией не |
|
протеины с молекулярной массой 20–30 кДа |
должны употреблять в пищу продукты, содержащие |
|
семейства казеиногена, формирующие агрегаты раз- |
галактозу. Лактоза молочных продуктов при непере- |
|
мером до 1 млн Да. κ-Казеин в свежем молоке слу- |
носимости к ней должна быть предварительно гидро- |
|
жит коллоидообразующим агентом. Для осаждения |
лизована до глюкозы и галактозы. Йогурты, лактоз- |
|
казеинов при приготовлении молочных продуктов ис- |
ный сироп для хлебопечения и другие молочные |
|
пользуют различные методы: добавление ионов Ca2+ |
продукты, не содержащие лактозу, получают путем |
|
в концентрации более 6 мM, закисление среды до рН |
ферментации с помощью рекомбинантных микроор- |
|
<4,6, гидролиз пептидной связи между 105Pro и |
ганизмов. |
|
106Met в молекуле κ-казеина. Последняя реакция |
СПЕЦИФИЧЕСКИЕ ВЕЩЕСТВА-АРОМАТИЗАТОРЫ В СЫ- |
|
осуществляется с помощью протеолитического фер- |
РОВАРЕНИИ. При обработке липазами содержащиеся |
|
мента химозина (реннина), который вырабатывается |
в молоке триглицерины, ацилированные остатками |
|
в слизистой оболочке желудка. |
карбоновых кислот с короткой или средней углеводо- |
|
ПРОТЕИНАЗЫ, РАСЩЕПЛЯЮЩИЕ КАЗЕИН. В желудке |
родной цепью, сыры получают специфический аромат. |
|
млекопитающих казеин молока гидролизуется под |
Выбирая липазы различной специфичности, можно |
|
действием кислот и химозина. Использование химо- |
получать сыры с разными вкусовыми качествами. |
|
зина при приготовлении сыра или творога – один из |
|
|
самых старых способ консервирования продуктов. |
|
|
Согласно классическому методу, фермент выделяют |
|
|
из желудков (сычугов) молочных телят, однако полу- |
|
|
ченные таким способом препараты часто загрязнены |
|
|
другими ферментами. Учитывая технологическую |
|
|
важность ферментов, расщепляющих казеин, особое |
|
|
значение приобретают методы получения бактери- |
|
98 |
альных протеиназ и синтеза рекомбинантного химо- |
|
зина. Протеиназа из гриба Mucor miehei обладает |
|
|

Состав молока
Молоко, % Сыворотка, %
Вода |
~88 |
~94 |
Жиры |
~3–4 |
~0,5 |
Белки |
~3,3 |
~1 |
Казеины |
~2,6 |
– |
Лактоза |
~3 |
~4,8 |
Плазмида |
trp-Промотор |
|
для экспрессии |
ori |
|
прохимозина |
|
|
в клетках E. coli |
|
|
|
Ген про- |
|
|
химозина |
pCT66 |
|
|
|
|
Т7-Терминатор |
ampR |
|
|
|
Переработка молока
|
Стартовые |
|
|
Кисло- |
культуры |
Лактаза |
Продукты, |
молочные |
Молоко |
|
не содержащие |
продукты |
Кислота, |
|
лактозы |
|
|
|
|
|
Ca2+, |
|
|
|
химозин |
|
|
|
|
|
|
|
|
|
|
|
Лактаза |
Корма сельско- |
|||
Сырный сгусток |
|
Сыворотка |
|
хозяйственных |
|||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
животных, |
|
|
|
|
|
|
|
Разделение |
||||||
|
|
|
|
|
|
|
сырье для |
||||||
|
|
|
|
|
|
|
с помощью |
ферментации |
|||||
|
|
|
|
|
|
|
мембран |
|
|||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
«Молодой» сыр |
|
Лактоза и белки |
|
|
|
|
|||||||
|
|
|
|
сыворотки |
|
|
|
||||||
|
Липазы, |
|
|
|
|
||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||||
|
протеазы, |
|
|
|
|
|
|
|
|
|
|
||
|
другие |
|
|
|
|
|
|
|
|
|
|
||
|
ферменты, |
|
|
|
|
|
|
|
|
|
|
||
|
стартовые культуры |
|
|
|
|
|
|||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Зрелый сыр |
|
|
|
Лактозный сироп |
|
|
|
||||||
|
Водная эмульсия |
|
с мицеллами, |
|
содержащими |
|
α-, β- и κ-казеин |
Гидрофобное ядро |
|
Полярные |
Фосфатные |
«хвосты» |
группы |
κ-казеина |
α- и β-казеина |
Отщепление полярных участков κ-казеина с помощью химозина (сычужного фермента) приводит к разрушению мицелл и выпадению
белка в осадок (створаживание молока также происходит в присутствии Са2+)
Получение химозина
Природный способ |
Микробиологический способ |
Рекомбинантный способ |
||
|
|
|
|
|
Желудок (сычуг) |
|
Культура микроорганизмов |
|
Рекомбинантный микроорганизм |
молодых телят |
|
|
|
|
штаммы-суперпродуценты |
|
Kluyveromyces lactis |
||
размельчение, активация |
|
|
||
|
Mucor miehei или M. pusillus |
|
|
|
фермента при рН < 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Биореактор |
|
|
Биореактор |
|
|
Экстракция |
|
|
ферментация с добавлением субстрата |
|
|
|
|
||
декстрозный сироп, |
|
|||
раствор поваренной соли, |
|
|
|
|
|
соевая мука, 30 °С, 72 ч |
|
|
|
14 сут. |
|
|
|
|
|
|
|
Очистка |
|
|
|
|
|
|
|
|
Очистка |
|
добавление кислоты, фильтрация |
Очистка |
|
|
|
|
отделение мицелия, |
|
|
||
ультрафильтрация, |
|
обратный осмос, |
|
|
стандартизация |
|
осаждение |
|
|
|
|
|
|
|
|
|
|
|
|
200 ед./кг желудков |
|
5000 ед./м3 за 72 ч |
|
20 000 ед./м3 за 36 ч |
Непереносимость лактозы и галактоземия
|
Непереносимость лактозы* |
|
|
|
|
|
Галактоземия** |
|
|
|
||||||
|
|
|
|
Галактоза |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Лактоза |
|
|
|
+ |
|
|
Галактозо-1-фосфат |
|
|
УДФ-галактоза |
||||||
|
|
|
|
|
|
|||||||||||
|
|
β-Галактозидаза, |
Глюкоза |
|
|
|
|
|
|
|
|
|
|
|||
|
|
«лактаза» |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Галактит (токсичное соединение) |
|
|
Нормальный |
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
обмен веществ |
||
Нарушение осмотических процессов в тонком кишечнике: судороги и диарея |
|
|
||||||||||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
** |
Более 70% взрослого населения южноафриканского народа банту, афроамериканцев, |
|
|
индейцев, китайцев и аборигенов Австралии |
|
** |
Дефект гена 1-фосфат-уридилтрансферазы 9-й хромосомы, частота встречаемости 1:100 000 |
99 |
|
|
|
|
|

Ферменты
Использование ферментов в хлебобулочной и мясоперерабатывающей промышленности
ВВЕДЕНИЕ. Получение опары – наиболее важный |
временном производстве используют дрожжи, кото- |
этап в производстве хлебобулочных изделий. Ком- |
рые оптимизированы для быстрого образования опа- |
бинированное молочнокислое и дрожжевое броже- |
ры, следовательно и активность препаратов фермен- |
ние при изготовлении хлеба из ржаной муки способ- |
тов также должна быть высокой. Чаще всего |
ствует его лучшей усвояемости. Для приготовления |
применяется нейтральная протеиназа из Aspergillus |
теста, как правило, используют очищенные фермен- |
oryzaе, которая разрыхляет клейковину в необходимой |
ты (α-амилазы, глюкоамилазы, протеиназы, ксила- |
мере, не приводя к излишнему расщеплению белка. |
назы). Специфические ксиланазы препятствуют об- |
МЕТОДЫ АНАЛИЗА. В современной хлебопекарной |
разованию геля, вызванному пентозанами, и таким |
промышленности широко используются методы |
образом снижают вязкость ржаного или пшеничного |
анализа и контроля технологических процессов. На- |
теста. Роль амилаз, глюкоамилаз и протеиназ за- |
пример, для изучения газообразования и уменьше- |
ключается в разрыхлении теста. В зависимости от |
ния вязкости используют метод определения числа |
природы муки для теста используют разные фер- |
падения. Для наблюдения за ходом протеолиза под |
менты в разных соотношениях. Добавление β-ами- |
действием протеиназ применяют фаринограф, экс- |
лазы, катализирующей образование мальтозы при |
тенсограммы или альвеограммы, которые отражают |
гидролизе углеводов, позволяет значительно увели- |
изменение вязкости раствора при расщепления |
чить сроки хранения хлеба. Современная хлебопе- |
глютена. |
карная промышленность во всем мире потребляет |
ФЕРМЕНТЫ ПРИ ПЕРЕРАБОТКЕ МЯСА. Мясо – это |
около 1000 тонн ферментов в год. Для производст- |
мышечная ткань, подвергнутая биохимической обра- |
ва колбасных изделий к мясу добавляют стартовые |
ботке. Особая роль в этой обработке принадлежит |
культуры микроорганизмов, что определяет вкусо- |
протеиназам (катепсинам). Основными критериями |
вые качества и сроки хранения полученных колбас. |
качества мяса служат сочность, вкусовые качества, |
Нежный вкус мяса достигается обработкой протеи- |
цвет и мягкость. Существует множество способов |
назами, которые частично расщепляют мышечные |
сделать мясо более нежным на вкус: так, в Европе |
волокна. Чаще всего в мясной промышленности ис- |
мясо маринуют, а в некоторых странах его заворачи- |
пользуют протеиназу папаин. |
вают в листья папайи или замачивают в ананасовом |
ИЗГОТОВЛЕНИЕ ХЛЕБА. Муку получают перемалыва- |
соке или в соке папайи. При смачивании раствором |
нием зерна. В завимости от вида зерна различают |
папаина (сульфгидрильная протеиназа, выделенная |
пшеничную, ржаную муку, муку из спельты*. Свойст- |
из папайи) мясо тоже становится мягким. Можно |
ва почвы, на которой выращивался злак, климат и |
также делать инъекции неактивного папаина живот- |
уровень зрелости на момент сбора урожая определя- |
ным непосредственно перед забоем: в мясе убитого |
ют содержание крахмала, пентозанов и белков. |
животного окисленные группы папаина восстанавли- |
Воздействие ферментов может изменять состав му- |
ваются, происходит активация фермента и частичное |
ки: так, амилазы расщепляют крахмал до декстринов |
разрушение мышечной ткани. |
(α-амилаза), мальтозы (β-амилаза) и в конце кон- |
|
цов – до глюкозы. Этот процесс важен для |
|
следующих этапов переработки муки: например, пе- |
|
карские дрожжи, используемые для приготовления |
|
опары, могут перерабатывать только моноили диса- |
|
хариды. Белок клейковины глютен связывает воду и |
|
формирует гелеобразную структуру теста. При дейст- |
|
вии протеиназ эту структуру можно частично разру- |
|
шить и таким образом повысить эластичность теста: |
|
это необходимо для эффективного удерживания СО2, |
|
образовавшегося в результате жизнедеятельности |
|
дрожжей при получении опары. Слишком высокая |
|
концентрация протеиназ приводит к потере эластич- |
|
ности и излишнему размягчению структуры теста. На |
|
практике обычно используют α-амилазы, выделен- |
|
ные из солода, бацилл или плесневых грибов. Глюко- |
|
амилазы также получают из плесневых грибов. В со- |
|
100 * Спельта – зимостойкий сорт пшеницы, распространенный в Европе. – Прим. пер.
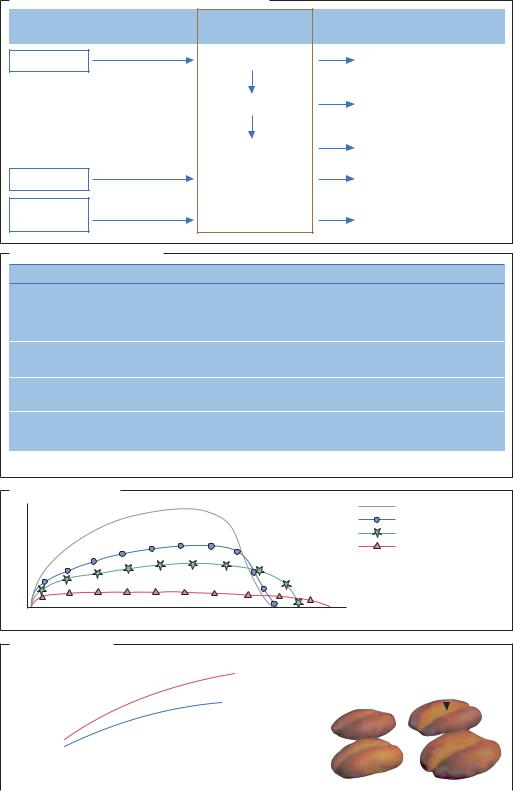
Ферменты, применяемые при подготовке теста |
|
|
||||||
Компоненты муки |
|
Тесто |
Преимущества |
|||||
|
|
|
(мука + вода + дрожжи) |
|
|
|||
Крахмал |
α-Амилаза |
Декстрины |
Разделка теста |
|||||
β-Амилаза |
||||||||
|
|
|
β-Амилаза |
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
Сахар (мальтоза) |
Ароматный, поджаристый хлеб |
||||
|
|
|
|
|
Дрожжи |
|
|
|
|
|
|
|
СО2 |
Увеличение объема |
|||
|
Протеиназы |
|
(воздушность теста) |
|||||
|
|
|
|
|
|
|||
Белки |
(оксидазы) |
Разрыхление |
Разделка теста |
|||||
|
|
|||||||
|
|
плотной структуры |
||||||
|
|
|
|
|
||||
Слизистые |
Специфические |
|
|
|
Переработка вязкой ржаной |
|||
вещества |
ксиланазы |
Расщепление пентозанов |
||||||
(= пентозаны) |
|
|
муки, увеличение объема |
|||||
|
|
|
|
|
(воздушность теста) |
|||
|
|
|
|
|
|
|||
Ферменты в хлебопечении |
|
|
|
|
|
|||
Фермент |
|
Действие |
|
|
Метод определения |
|
Эффект |
|
α-Амилаза из солода, |
Расщепление крахмальных |
Образование газа при |
|
Увеличение объема, |
||||
Bacillus, Aspergillus, |
гранул в муке, гидролиз |
|
дрожжевом брожении*, |
улучшение структуры |
||||
глюкоамилаза |
|
крахмального клейстера |
|
измерение вязкости |
|
корочки, улучшение |
||
из Aspergillus oryzae |
с образованием мальтозы |
(амилограф), |
|
вкусовых качеств |
||||
|
|
и глюкозы |
|
|
пробная выпечка |
|
|
|
Протеиназы |
|
Разрушение глютена |
|
Вязкость и эластичность |
Эластичное тесто, |
|||
из плесневых грибов |
|
|
|
(фаринограф, экстенсо- |
повышенное |
|||
|
|
|
|
|
граммы и др.) |
|
содержание газа |
|
Ксиланаза |
|
Разрушение слизистых |
|
Измерение вязкости |
|
Улучшение механических |
||
из Trichoderma viride |
веществ |
|
|
(амилограф) |
|
свойств хлеба (пористость, |
||
|
|
|
|
|
|
|
равномерность) |
|
β-Амилаза |
|
Увеличение срока |
|
Органолептически |
|
Предотвращает |
||
из B. stearothermophilus, |
хранения, более |
|
|
|
взаимодействие крахмала |
|||
Aspergillus |
|
насыщенный аромат |
|
|
|
и глютена |
||
* Saccharomyces cerevisiae перерабатывают только мальтозу или глюкозу |
|
|
||||||
(не действуют на другие олигосахариды) |
|
|
|
|
|
|||
Эластичность теста |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Контроль |
|
Сопротивление растяжению |
|
|
|
|
|
|
3 г протеиназы* |
|
|
|
|
|
|
|
6 г протеиназы* |
||
|
|
|
|
|
|
30 г протеиназы* |
||
|
|
|
|
|
|
на 100 кг муки |
||
|
|
|
|
|
|
|
||
|
Растяжимость (эластичность) |
|
|
|
* из Bacillus amyloliquefaciens |
|||
Пробная выпечка |
|
|
|
|
|
|
||
|
1500 |
|
|
|
|
В присутствии ферментов* |
|
|
Амилаза из Aspergillus oryzae, |
|||||||||
|
|
|
|
|
|
|
|
ксиланаза из Aspergillus niger |
||||||||||
хлеба |
1000 |
|
|
|
|
|
|
|
|
|
Контроль |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Объем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
500 |
|
|
|
|
|
|
|
|
|
|
*Вклад в увеличение объема: |
|||||||
|
|
|
|
|
|
|
|
|
|
|
α-амилаза |
+ |
|
10%, |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
протеиназы |
+ |
|
5%, |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
ксиланазы |
+ |
|
25%, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
10 |
30 |
60 |
90 |
120 |
160 |
|
|
|
||||||||
|
|
|
|
|
|
|
|
Время, мин |
|
|
|
|
|
|
101 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
