
- •Содержание
- •Предисловие
- •Предисловие ко 2-му изданию
- •Введение
- •Этапы развития биотехнологии
- •Биотехнология сегодня
- •Биотехнологическое производство пищевых продуктов
- •Алкогольные напитки
- •Пивоварение
- •Ферментация в пищевой промышленности
- •Пищевые продукты и молочнокислое брожение
- •Этиловый спирт
- •1-Бутанол, ацетон
- •Уксусная кислота
- •Лимонная кислота
- •Молочная и глюконовая кислоты
- •Аминокислоты
- •L-Глутаминовая кислота
- •D,L-Метионин, L-лизин и L-треонин
- •Антибиотики
- •Антибиотики: источники, применение и механизмы действия
- •Антибиотики: получение. Устойчивость к антибиотикам
- •β-Лактамные антибиотики: промышленное получение
- •Гликопептидные, полиэфирные и нуклеозидные антибиотики
- •Аминогликозидные антибиотики
- •Тетрациклины, хиноны, хинолоны и другие ароматические антибиотики
- •Поликетидные антибиотики
- •Получение новых антибиотиков
- •Специальные продукты
- •Витамины
- •Нуклеозиды и нуклеотиды
- •Биодетергенты и биокосметика
- •Микробные полисахариды
- •Биоматериалы
- •Биотрансформация
- •Биотрансформация стероидов
- •Ферменты
- •Ферменты
- •Ферментативный катализ
- •Ферменты в клинических анализах
- •Тесты с помощью ферментов
- •Применение ферментов в промышленных технологиях
- •Ферменты в производстве моющих средств
- •Ферменты, расщепляющие крахмал
- •Ферментативное расщепление крахмала в промышленности
- •Ферментативное превращение сахаров
- •Утилизация целлюлозы и полиозы
- •Использование ферментов в целлюлозно-бумажной промышленности
- •Пектиназы
- •Ферменты в производстве молочных продуктов
- •Использование ферментов в хлебобулочной и мясоперерабатывающей промышленности
- •Ферменты в кожевенной и текстильной промышленности
- •Перспективы получения ферментов для промышленных технологий
- •Белковая инженерия
- •Пекарские и кормовые дрожжи
- •Пекарские и кормовые дрожжи
- •Белки и жиры из одноклеточных организмов
- •Аэробная очистка сточных вод
- •Анаэробная очистка сточных вод и переработка ила
- •Биологическая очистка газовых выбросов
- •Биологическая очистка почв
- •Микробиологическое выщелачивание руд и биокоррозия
- •Инсулин
- •Гормон роста и другие гормоны
- •Гемоглобин, сывороточный альбумин и лактоферрин
- •Факторы свертывания крови
- •Антикоагулянты и тромболитики
- •Ингибиторы ферментов
- •Иммунная система
- •Стволовые клетки
- •Тканевая инженерия
- •Интерфероны
- •Интерлейкины
- •Эритропоэтин и другие факторы роста
- •Другие белки, имеющие медицинское значение
- •Вакцины
- •Рекомбинантные вакцины
- •Антитела
- •Моноклональные антитела
- •Рекомбинантные и каталитические антитела
- •Методы иммуноанализа
- •Биосенсоры
- •Биотехнология в сельском хозяйстве
- •Животноводство
- •Перенос эмбрионов и клонирование животных
- •Картирование генов
- •Трансгенные животные
- •Генетическая ферма и ксенотрансплантация
- •Растениеводство
- •Культивирование растительных клеток: поверхностные культуры
- •Культивирование растительных клеток: суспензионные культуры
- •Трансгенные растения: методы получения
- •Трансгенные растения
- •Вирусы
- •Бактериофаги
- •Микроорганизмы
- •Бактерии
- •Некоторые бактерии, важные для биотехнологии
- •Грибы
- •Дрожжи
- •Усовершенствование штаммов микроорганизмов
- •Основы биотехнологических методов
- •Микроорганизмы: рост в искусственных условиях
- •Кинетика образования продуктов метаболизма и биомассы в культуре микроорганизмов
- •Технология ферментации
- •Промышленные процессы ферментации
- •Культивирование животных клеток
- •Биореакторы для культивирования животных клеток
- •Биореакторы с иммобилизованными ферментами и клетками
- •Очистка биотехнологических продуктов
- •Очистка биотехнологических продуктов: хроматографические методы
- •Экономические аспекты биотехнологического производства
- •Методы генетической инженерии
- •Структура ДНК
- •Функции ДНК
- •Эксперимент в генетической инженерии
- •Методы выделения ДНК
- •Ферменты, модифицирующие ДНК
- •ПЦР: лабораторная практика
- •ДНК: химический синтез и определение размера молекул
- •Секвенирование ДНК
- •Введение ДНК в живые клетки (трансформация)
- •Идентификация и клонирование генов
- •Экспрессия генов
- •Выключение генов
- •Геном прокариот
- •Геном эукариот
- •Геном человека
- •Функциональный анализ генома человека
- •ДНК-анализ
- •Белковые и ДНК-чипы
- •Маркерные группы
- •Тенденции развития
- •Генная терапия
- •Поиск биологически активных веществ
- •Протеомика
- •Обмен веществ
- •Метаболомика и метаболическая инженерия
- •Системная биология
- •«Белая» биотехнология
- •Сертификация биотехнологической продукции
- •Этические аспекты генетической инженерии
- •Патентование в биотехнологии
- •Биотехнология в разных странах
- •Биотехнология в разных странах
- •Литература
- •Источники иллюстраций
- •Указатель микроорганизмов
Спирты, кислоты и аминокислоты
32
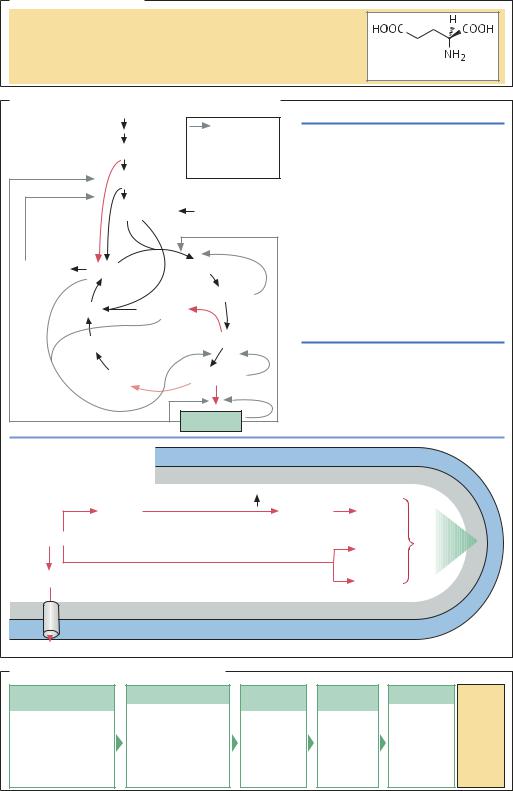
L-Глутаминовая кислота
ВВЕДЕНИЕ. В 1908 г. японские ученые установили, что L-глутаминовая кислота, содержащаяся в водорослях Konbu, может усиливать вкус. Промышленное производство L-глутаминовой кислоты из кислотного гидролизата клейковины пшеницы и соевого белка было начато уже в 1909 г. на фирме Ajinоmoto. В 1957 г. сотрудник фирмы Киова Хакко обнаружил, что при выращивании Corynebacterium glutamicum в
сахаросодержащей среде накапливается L-глутами- новая кислота. В настоящее время в результате усовершенствования штамма и оптимизации технологии ферментации удается получать до 150 г глутамата из 1 л культуры.
МИКРООРГАНИЗМЫ И БИОСИНТЕЗ. В клетках C. glutamicum L-глутаминовая кислота образуется при трансаминировании 2-оксоглутаровой кислоты, которая получается при окислении изолимонной кислоты в цикле Кребса. В диком штамме окисление дикарбоновых продуктов цикла Кребса строго регулируется. Изучение генома C. glutamicum и способов регуляции активности ферментов привело к созданию нового штамма, в котором: 1) возросла секреция глутамата в среду роста; 2) изменены пути регуляции активности некоторых ферментов, участвующих в биосинтезе L-глута- миновой кислоты; 3) активированы некоторые побочные пути обмена веществ.
Приведем разъяснения.
1.Количество глутамата в культуральной жидкости в большой степени зависит от скорости секреции, и, следовательно, от проницаемости цитоплазматической мембраны. Проницаемость мембран может изменяться. Например, для увеличения проницаемости ограничивают доступ биотина, жирных кислот или глицерина (для ауксотрофов по жирным кислотам или по глицерину соответственно). Добавление в среду пенициллина также приводит к повышению проницаемости клеточной стенки, так как пенициллин препятствует ее образованию.
2.В промышленных штаммах C. glutamicum активность 2-оксоглутаратдегидрогеназы значитель-
но ниже активности L-глутаматдегидрогеназы (KМ различаются примерно в 70 раз, Vmax – примерно в 150 раз).
3.К наиболее важным анаплеротическим реакциям относятся карбоксилирование фосфоенолпирувата и активация глиоксилатного цикла (в растениях
ибактериях). Обе реакции приводят к образованию оксалоацетата, предшественника цитрата, кроме того, в результате этих реакций происходит включение
дикарбоновых (С2) продуктов гликолиза в цикл лимонной кислоты. Фосфоенолпируваткарбоксилаза использует в качестве кофактора биотин, следовательно, изменяя количество биотина, можно регулировать активность фермента. Активность многих
ферментов, участвующих в глиоксилатном цикле, зависит от концентрации метаболитов, конечных продуктов, а также NH+4 и NAD+/ NADH, поэтому можно «искусственно» менять их активность. Выход продукта
вштаммах-продуцентах глутамата можно повысить методами генетической инженерии. В настоящее время геном C. glutamicum полностью расшифрован и активно изучается. В частности, исследуют зависимость выхода продукта от введения в геном мультикопийных кассет, несущих ген глутаматдегидрогеназы.
ФЕРМЕНТАЦИЯ И ПЕРВИЧНАЯ ПЕРЕРАБОТКА. В качестве сырья для производства глутамата используют мелассу или гидролизат крахмала. В оптимальных условиях культивирования высокопродуктивные штаммы C. glutamicum перерабатывают до 60–70% исходного сырья. Источником азота служат соли аммония и аммиак. При выборе условий роста необходимо оптимизировать концентрацию биотина в среде,
арН среды поддерживать в диапазоне 7,0–8,0. Для синтеза глутамата очень важна аэрация клеточной
культуры: оптимальное значение kd составляет 3,5 10–6 моль кислорода/(атм мин мл). Ферментацию в промышленных масштабах проводят в реакторах с рабочим объемом до 500 м3. Как правило, сначала проводят предферментацию, а затем ферментацию воздушно-проточным способом. Чтобы избежать ингибирования катаболитами, после образования достаточного количества клеток (14 ч роста)
всреде поддерживают постоянный уровень глюкозы, не превышающий 0,5%. После удаления клеток ультрафильтрацией глутамат выделяют из культуральной жидкости методами ионообменной или абсорбционной хроматографии (150 г/л через 60 ч роста).
ЭКОНОМИЧЕСКИЕ АСПЕКТЫ. L-Глутамат используется в основном в пищевой промышленности как усилитель вкуса, чаще всего в комбинации с нуклеозидами. В 2004 г. путем ферментации было получено 1 500 000 т L-глутамата. Рыночная стоимость L-глу- тамата составляет 1000 долларов США за тонну,
аобъем рынка достигает 1,5 млрд долларов США. Основные производства расположены в странах азиатского региона.
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
L-Глутаминовая кислота |
|
|
|
|
|
|
|
|
|
|
|
|
||
С5Н9NO4 |
|
|
|
|
Код СAS 56-86-0 (L)-форма |
|
|
|
|
|||||
MR |
|
147,13 |
|
|
|
|
|
|
|
|
|
|
|
|
Тпл |
|
247–249°С |
|
|
|
|
|
|
|
|
|
|
|
|
Растворимость |
600 г/л воды |
|
|
|
|
|
(2 S)-форма, L-форма |
|
||||||
Биосинтез и штаммы-суперпродуценты глутамата |
|
|
|
|
|
|
|
|
||||||
|
Глюкоза |
|
|
|
|
|
Ферменты |
|
|
|
|
Ген |
||
|
|
|
|
Регуляция |
|
|
1 Фосфоенолпируват- |
|
|
ppc |
||||
|
|
|
|
по принципу |
|
|
|
|
||||||
|
|
|
|
|
|
карбоксилаза (PEPC) |
|
|
||||||
|
Фосфоенолпируват |
обратной |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
2 |
|
связи или |
|
|
2 Пируваткиназа |
|
|
|
pyk |
|||
|
1 |
|
репрессия |
|
|
3 Пируваткарбоксилаза |
|
pyk |
||||||
|
Пируват |
|
|
|
|
|
|
|||||||
|
|
4 |
|
|
|
|
|
|
4 Пируватдегидрогеназа |
|
pdh |
|||
|
Ацетил-КоА |
Ацетат |
|
|
|
5 Цитратсинтаза |
|
|
|
gltA |
||||
|
3 |
|
|
|
|
|
|
|
6 Aконитаза |
|
|
|
citB |
|
|
|
|
5 |
|
|
|
|
7 Изоцитратдегидрогеназа |
|
icd |
||||
|
|
|
|
|
|
|
|
|
||||||
L-Аспартат |
Оксалоацетат |
Цитрат |
6 |
|
|
|
8 L-Глутаматдегидрогеназа (GDH) |
gdh |
||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
9 α-Кетоглутарат- |
|
|
aceE |
|||
|
|
|
|
|
|
|
|
|
|
|
||||
|
11 |
|
цис-Аконитат |
|
|
дегидрогеназа (KDH) |
|
|
||||||
|
Малат |
Глиоксилат |
|
|
|
|
10 Изоцитратлиаза (ICL) |
|
aceE |
|||||
|
|
|
|
10 |
|
|
|
|
11 Малатсинтетаза (MS) |
|
aceB |
|||
|
|
|
|
|
|
|
|
|
|
|||||
|
Фумарат |
|
|
Изоцитрат |
|
Штаммы-суперпродуценты: |
|
|
||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
7 |
|
|
|
|
|||||
|
|
|
|
|
|
|
1. Повышенная активность PEPC, GDH, ICL, MS |
|||||||
|
|
|
2-Оксоглутарат |
|
|
|||||||||
|
Сукцинат |
|
|
2. Сниженная активность или инактивация |
||||||||||
|
9 |
|
8 |
|
|
|||||||||
|
|
|
|
|
|
|
KDH |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
3. Нарушение регуляции активности PEPC |
||||||
|
|
|
|
L-Глутамат |
|
|
|
по механизму обратной связи посредством |
||||||
|
|
|
|
|
|
|
L-глутамата |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Усиление секреции |
|
Клеточная стенка |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
Клеточная мембрана |
|
|
|
|
|
|
|
|
|||
|
|
|
После добавления |
|
|
|
|
|
|
|
|
|||
|
Ацетил- |
|
|
биотина |
Малонил- |
Жирные |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||
|
КоА |
|
Ограничение доступа |
|
|
KоА |
кислоты |
|
|
|
||||
Глюкоза |
|
ненасыщенных жирных кислот |
|
|
|
|
|
Фосфо- |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Глицерин |
липиды |
|
|
|
L-Глутамат |
|
|
|
|
|
|
|
|
|
Инозит |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Изменение интенсивности транспорта через мембрану |
|
|
|
|
|
|
||||||||
Нарушение синтеза клеточной стенки под действием пенициллина |
|
|
|
|
|
|||||||||
L-Глутамат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ферментация и первичная переработка |
|
|
|
|
|
|
|
|
|
|||||
Посевной материал, |
|
Ферментация |
|
Удаление |
|
Концентри- |
Обработка |
|
|
|||||
предферментация |
Биореактор до 500 м3, |
клеток |
|
рование |
Высушивание |
|
|
|||||||
Постепенное |
|
Пресс-фильтр |
Ультра- |
|
Выход |
|||||||||
увеличение объема |
источник углерода – |
или ультра- |
|
фильтрация |
распылением |
продукта: |
||||||||
меласса или |
|
|
|
или кристал- |
||||||||||
культуры в реакторе |
|
|
фильтрация |
|
|
|
~150 г/л |
|||||||
гидролизат крахмала, |
|
|
|
лизация |
||||||||||
|
|
|
|
|
|
|
через |
|||||||
|
|
источник азота – |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
40–60 ч |
||||
|
|
аммиак, наличие |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
биотина |
|
|
|
|
|
|
|
|
|
|
33 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аминокислоты |
D,L-Метионин, L-лизин и L-треонин |
||||||
ВВЕДЕНИЕ. Основное |
применение D,L-метионин, |
cum в качестве источника углерода добавляют рас- |
|||||
|
|||||||
|
L-лизин и L-треонин находят в составе пищевых и |
творы сахаров. Уровень биотина в среде поддержива- |
|||||
|
кормовых добавок. Это незаменимые аминокислоты |
ют на постоянном уровне – около 30 мкг/л. После |
|||||
|
для человека и многих сельскохозяйственных живот- |
окончания синтеза и удаления клеток L-лизин выделя- |
|||||
и |
ных, т. е. они не образуются в организме и должны |
ют на ионообменной колонке или путем распылитель- |
|||||
поступать вместе с пищей. D,L-Метионин, L-лизин и |
ной сушки. Еще одна технология получения L-лизина |
||||||
кислоты |
|||||||
L-треонин содержатся в белках кукурузы, сои, овса, |
основана на использовании клеток Cryptococcus lau- |
||||||
|
|||||||
|
ячменя, ржи и риса, однако их содержание недоста- |
rentii. В настоящее время эта технология практиче- |
|||||
|
точно для полноценного питания. Поэтому вегетари- |
ски не реализуется, так как не может конкурировать |
|||||
Спирты, |
анцам рекомендуется дополнительно принимать пре- |
с технологией с использованием C. glutamicum. Тех- |
|||||
рожь, |
прибавка |
в |
весе достигается |
только |
coccus laurentii. Дешевым сырьем в данном случае |
||
|
параты L-метионина, L-лизина и L-треонина. При |
нология заключается в производстве L-лизина из |
|||||
|
откорме скота эти аминокислоты особенно важны: |
D,L-α-амино-ε-капролактама в биореакторе, в кото- |
|||||
|
когда основой питания животных являются рис и |
рый добавлены высушенные ацетоном клетки Crypto- |
|||||
|
в том случае, если в корм добавляют L-лизин и |
являются отходы производства нейлона, селектив- |
|||||
|
L-треонин, а когда животных кормят в основном куку- |
ный гидролиз которых приводит к образованию |
|||||
|
рузой, в их рацион необходимо добавлять D,L-метио- |
D,L-α-амино-ε-капролактама, который в свою оче- |
|||||
|
нин, L-лизин и L-треонин. В промышленности эти |
редь подвергается рацемизации ферментом D-ами- |
|||||
|
аминокислоты получают ферментацией или химиче- |
нокапролактамрацемазой, выделенной из штамма |
|||||
|
ским синтезом. |
|
|
|
Achromobacter obae. |
||
|
D,L-МЕТИОНИН. Химический синтез D,L-метионина, |
L-ТРЕОНИН. Мутантные штаммы Escherichia coli с из- |
|||||
|
L-лизина и L-треонина включает пять стадий. В каче- |
мененным путем регуляции биосинтеза являются ос- |
|||||
|
стве исходных веществ используют акролеин, метан- |
новными промышленными продуцентами L-треонина. |
|||||
|
тиол и синильную кислоту. Одним из промежуточных |
Максимальный выход продукта составляет 80 г/л че- |
|||||
|
продуктов синтеза является гидантоин – консервант, |
рез 30 ч роста. Уже клонированы гены оперона, от- |
|||||
|
использующийся при производстве шампуней и мою- |
вечающего за биосинтез треонина, и в настоящее |
|||||
|
щих средств. В процессе химического синтеза обра- |
время ведутся работы, направленные на получение |
|||||
|
зуется рацемат, в разделении которого нет необходи- |
штаммов с еще более высоким выходом продукта. |
|||||
|
мости, поскольку в организме высших животных |
После отделения клеток проводят ультрафильтрацию |
|||||
|
D-метионин превращается в L-метионин. |
|
культуральной жидкости, а затем L-треонин очищают |
||||
|
L-ЛИЗИН. В промышленом производстве L-лизина |
кристаллизацией. |
|||||
|
используются штаммы Corynebacterium glutamicum. |
ЭКОНОМИЧЕСКИЕ АСПЕКТЫ. В 2004 г. было произ- |
|||||
|
L-Лизин образуется из диаминопимелиновой кисло- |
ведено 600 000 т D,L-метионина, 700 000 т L-лизи- |
|||||
|
ты, которая в свою очередь получается из оксалоаце- |
на и 55 000 т L-треонина. Метионин получают преи- |
|||||
|
тата в результате многоступенчатой реакции конде- |
мущественно путем химического синтеза, а L-лизин и |
|||||
|
нсации аспарагиновой кислоты и пирувата. В диких |
L-треонин – ферментацией. Стоимость этих амино- |
|||||
|
штаммах в качестве побочных продуктов этой много- |
кислот 1000–2000 долл. США/т, а объем продаж до- |
|||||
|
стадийной реакции |
образуются предшественники |
стигает 500 млн долл. В последнее время наряду с |
||||
|
L-треонина и L-метионина, что снижает выход L-лизи- |
традиционным производством аминокислот для кор- |
|||||
|
на. В штаммах-суперпродуцентах этот побочный путь |
мовых добавок развивается новая технология – |
|||||
|
блокирован благодаря мутациям в генах соответству- |
выращивание трансгенных растений с измененным |
|||||
|
ющих ферментов (используют также ауксотрофные |
аминокислотным составом. Такие растения в перспе- |
|||||
|
мутантные штаммы, для метаболизма которых необ- |
ктиве могут использоваться непосредственно для от- |
|||||
|
ходимо присутствие специфических веществ, напри- |
корма скота. |
|||||
|
мер гомосерина). В настоящее время клонированы |
|
|||||
|
гены почти всех ферментов, участвующих в биосин- |
|
|||||
|
тезе L-лизина и его регуляции, поэтому методы гене- |
|
|||||
|
тической инженерии играют решающую роль в полу- |
|
|||||
|
чении |
штаммов, |
характеризующихся |
высоким |
|
||
|
уровнем синтеза L-лизина. В современном производ- |
|
|||||
|
стве используются штаммы, в которых выход проду- |
|
|||||
|
кта достигает 120 г/л через 60 ч роста. Как правило, |
|
|||||
34 |
применяют воздушно-проточную ферментацию в реа- |
|
|||||
кторах объемом до 500 м3. В среду роста C. glutami- |
|
||||||

D,L-Метионин |
|
С5Н11NO2S |
|
MR |
149,21 |
Код CAS |
63-68-3 |
L-Лизин |
|
С6Н14N2O2 |
|
MR |
146,19 |
Код CAS |
56-87-1 |
L-Треонин |
|
С4Н9NO3 |
|
MR |
119,12 |
Код CAS |
72-19-5 |
Аминокислоты в кормах |
|
|
|
|
|
|
||
Пшеница |
без добавок |
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
L-лизин 0,25% |
|
|
|
|
|
||
L-лизин 0,4% + L-треонин 0,4% |
|
|
|
|
|
|||
Кукуруза |
без добавок |
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
L-лизин 0,05% |
|
|
|
|
|
||
L-лизин 0,4% + L-триптофан 0,35% |
|
|
|
|
|
|||
Рис |
без добавок |
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
L-лизин 0,1% |
|
|
|
|
|
||
L-лизин 0,2% + L-треонин 0,1% |
|
|
|
|
|
|||
Для сравнения: |
казеин без добавок |
|
|
|
|
|
||
|
|
0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
|
|
|
|
Относительная пищевая ценность при откорме свиней |
|||||
Биосинтез и штаммы-суперпродуценты |
|
|
|
|
|
|||
Синтез L-лизина в клетках |
|
Мутанты с заблокированными побочными процессами |
||||||
Corynebacterium glutamicum |
|
|||||||
|
в среде с L-гомосерином |
|
|
|
||||
|
|
|
|
|
|
|||
2 |
|
|
|
1 |
|
|
|
|
Аспарагиновая |
|
|
Полуальдегид |
|
|
|
||
Аспартилфосфат |
|
аспарагиновой кислоты |
L-Гомосерин |
L-Треонин |
||||
кислота |
|
|||||||
|
|
|
|
|
|
|
||
2 |
|
|
Дегидродипиколиновая |
|
|
|
||
|
|
кислота |
|
|
2-Оксо- |
|||
|
|
|
|
|
||||
|
|
|
Диаминопимелиновая |
|
|
масляная |
||
|
|
|
|
|
кислота |
|||
Ингибирование |
|
|
кислота |
|
|
|||
|
|
|
|
|
||||
Репрессия |
|
|
L-Лизин |
L-Метионин |
L-Изолейцин |
|||
|
|
|
||||||
В мутантных штаммах нет ингибирования L-лизином и L-треонином |
|
|
|
|||||
Производство L-лизина |
|
|
|
|
|
|
||
|
Основной метод получения: ферментация |
|
|
|
||||
Штаммы- |
Предфер- |
Основная |
Удаление |
Очистка |
Выход |
|||
суперпродуценты |
ментация |
ферментация |
клеток |
|
|
L-лизина |
||
Мутанты по регулятор- |
30 м3, |
500 м3, декстроза, |
Сепаратор |
Ионообменная |
120 г/л |
|||
ным ферментам или |
декстроза, |
соевая мука, |
или ультра- |
хроматография, |
через |
|||
80 ч |
||||||||
ауксотрофные мутанты |
соевая |
оптимизирован- |
фильтрация |
перекристалли- |
||||
фермен- |
||||||||
Corynebacterium |
мука |
ные условия |
|
зация или сушка |
||||
|
тации |
|||||||
glutamicum |
|
массопереноса |
|
распылением |
||||
|
|
|
||||||
Другая технология: каскадная реакция в биореакторе |
|
|
|
|||||
1 |
2 |
|
|
|
1 |
ACL-рацемаза: |
||
|
|
|
|
|
Achromobacter obae |
|||
|
|
|
|
|
2 |
ACL-гидролаза: |
||
D-α-амино- |
L-α-амино- |
|
L-лизин |
|
Cryptococcus laurentii |
|||
|
|
|
|
|
||||
ε-капролактам (ACL) |
ε-капролактам |
|
|
|
|
|
35 |
|
|
|
|
|
|
|
|
||
Спирты, кислоты и аминокислоты
36
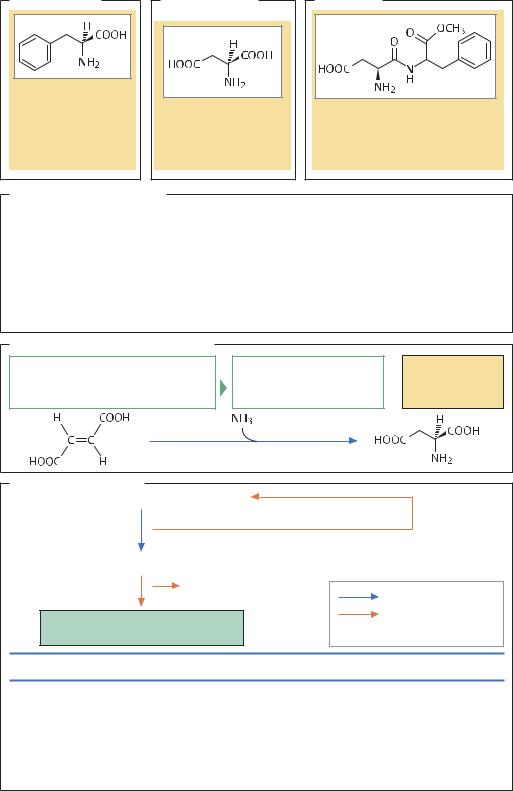
Аспартам™, L-фенилаланин и L-аспарагиновая кислота
ВВЕДЕНИЕ. Аспартам (метиловый эфир L-α-аспартил- L-фенилаланина) – это низкокалорийный искусственный подсластитель, который по сладости в 200 раз превосходит сахар, полученный из сахарной свеклы. Объем производства аспартама составляет 30 000 т/г (2004). Исходными веществами для синтеза аспартама являются L-аспарагиновая кислота и L-фенилала- нин. При химическом синтезе аспартама требуются дополнительные затраты на введение защитных групп в молекулы исходных веществ, поэтому в настоящее время применяют ферментативные методы получения этого продукта.
L-АСПАРАГИНОВАЯ КИСЛОТА. Одним из методов получения L-аспарагиновой кислоты является экстракция из белкового гидролизата, однако экономически более выгодным оказался синтез клетками Escherichia coli из фумаровой кислоты в присутствии аммиака. Реакцию осуществляет фермент аспартаза, находящаяся в клетках микроорганизма. Как правило, для выращивания клеток используют реактор, в котором бактерии иммобилизованы на κ- каррагинане или полиакриламиде. Выход продукта в такой системе достигает 140 г/(л ч), а срок службы биокатализатора на основе иммобилизованных клеток составляет два года. Использование сублимированных клеток промышленных штаммов позволяет получать до 166 г L-аспарагиновой кислоты с литра клеточной культуры. В лабораторных условиях удалось получить штамм E. coli с плазмидой, несущей ген аспартазы (aspA). В таком штамме выход L-аспарагиновой кислоты увеличивается в 30 раз.
L-ФЕНИЛАЛАНИН. Традиционно производство L-фе- нилаланина осуществлялось в ферментативных реакторах на доступном сырье. В последнее время в связи с развитием молекулярно-биологических методов, позволяющих получать генетически модифицированные штаммы-суперпродуценты, все шире используют ферментацию. Распространение ферментативных методов объясняется доступностью и невысокой стоимостью синтетического сырья, а также выгодным соотношением между производственными площадями, временными затратами и выходом продукта. Для производства L-фенилаланина наиболее выгодным оказалось использование биореактора, в котором в присутствии аммиака происходит аминирование коричной кислоты под действием фермента фенилаланинаммиаклиазы из Rhodotorula glutinis. В таком реакторе выход продукта достигает 50 г/л, а эффективность переработки сырья составляет 83%. Перспективным также считается метод расщепления D,L-5-бензилгидантоина ферментами L-гидантоина- зой и L-N-карбамоилазой, выделенными из Flavobacterium ammoniagenes. Для ферментации в биореакторах в современном производстве, как правило,
используют штаммы-суперпродуценты E. coli или коринебактерий. В этих организмах биосинтез L-фени- лаланина из эритрозо-4-фосфата и фосфоенолпирувата протекает в несколько стадий. В качестве промежуточных соединений образуются шикимовая, префеновая и фенилпировиноградная кислоты, в диком штамме они предшественники L-триптофана и L-тирозина. Однако в промышленности используют мутантные ауксотрофные штаммы, в которых активность ключевых ферментов строго регулируется. Практически все гены, продукты которых участвуют в биосинтезе L-фенилаланина, к настоящему времени клонированы. Это позволяет получать новые штам- мы-суперпродуценты, применяя генно-инженерные методы. Так, выход L-фенилаланина в одном из рекомбинантных штаммов Brevibacterium fermentum
составляет 45 г на литр клеточной культуры. После завершения ферментации по воздушно-проточному способу клетки отделяют, а затем концентрируют культуральную жидкость ульрафильтрацией. Для окончательной очистки L-фенилаланина применяют ионообменную хроматографию или кристаллизацию. АСПАРТАМТМ. Для синтеза аспартама из L-аспараги- новой кислоты и L-фенилаланина необходимо сначала ввести в исходные молекулы пять защитных групп, а в конце синтеза их удалить. Такой метод значительно сложнее синтеза с использованием протеиназы. В обычных условиях протеолитические ферменты катализируют гидролиз пептидных связей, однако возможно сдвинуть равновесие в сторону образования пептидной связи. Так, в концентрированных растворах, содержащих L-аспарагиновую кислоту (в которой аминогруппа защищена бензилоксикарбонилом) и метиловый эфир L-фенилаланина, протеиназа катализирует образование малорастворимого пептида, который выпадает в осадок. Особенно важно, что в этой реакции принимает участие только α-карбоксильная группа L-аспарагиновой кислоты, так как изомер аспартама – метиловый эфир L-β-аспартил-L-фенилаланина – обладает сильно выраженным горьким вкусом. В промышленном производстве, как правило, используют иммобилизованную протеиназу термолизин, выделенную из Bacillus thermoproteolyticus. Этот фермент устойчив к высоким температурам и может осуществлять реакцию при 70 °С, что значительно повышает эффективность процесса (выход продукта достигает 30 г/л). Образовавшийся аспартам в значительной степени отделен от побочных продуктов, так что для окончательной очистки от примеси исходных веществ достаточно ионообменной хроматографии.
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
L-Фенилаланин |
L-Аспарагиновая |
||
|
|
кислота |
|
С9Н11NO2 |
|
С4Н7NO4 |
|
MR |
165,19 |
MR |
133,10 |
Тпл |
310–312 °C |
Код CAS |
56-84-8 |
Код CAS |
63-91-2 |
|
|
Получение L-фенилаланина |
|
|
|
α-Аспартам |
|
С14Н18N2O5 |
|
MR |
294,31 |
Максимальная |
40 мг/кг |
суточная доза |
|
Код CAS |
22389-47-0 |
Наиболее распространенный метод – ферментация |
|
|
Штаммы-суперпродуценты: |
Источник С: глюкоза |
Более 40 г/л |
коринебактерии |
Очистка: использование мембран, |
через 60 ч роста |
или E. coli |
ионообменная хроматография, |
|
|
перекристаллизация |
|
|
|
|
|
Другой метод – ферментативный реактор |
|
Добавление аммиака |
Иммобилизованный фермент |
Около 50 г/л при 83% |
к транс-коричной кислоте |
L-фенилаланин-аммиаклиаза |
конверсии сырья |
|
из Rhodotorula glutinis |
|
Получение L-аспарагиновой кислоты
Многоступенчатая реакция в биореакторе |
|
Очистка |
Выход 90–95%, |
|
Иммобилизованные клетки E. coli; |
Добавление H2SO4 при 15 °С |
|||
срок службы клеток |
||||
1,2 М фумаровая кислота, аммиак, |
(рН 2,8) приводит к выпадению |
E. coli 2 года |
||
рН 8,5, 37°С |
|
аспарагиновой кислоты в осадок |
|
|
|
|
Аспартаза (иммобилизованные клетки E. coli) |
|
|
|
|
Получение α-аспартама |
|
|
|
|
|
L-Z-аспарагиновая кислота + D,L-фенилаланин-ОМе |
|
|
|
||
иммобилизованый |
|
|
|
рацемизация |
|
|
|
|
|
|
|
термолизин |
|
D-фенилаланин-ОМе |
|
|
|
(60 °С, 2 ч) |
|
|
|
||
L-Z-α-аспартил-L-фенилаланин-ОМе |
|
|
|
||
гидрирование |
ZH |
ферментативный катализ |
|
||
|
|
|
|
||
L-α-аспартил-L-фенилаланин-ОМе |
химические реакции |
|
|||
|
|
|
|||
|
α-Аспартам |
Z = бензилоксикарбонил |
|
||
Подсластитель |
Химическое строение |
|
Относительная |
|
|
|
|
|
|
сладость |
|
Сахароза |
Дисахарид |
|
|
1 |
|
Цикламат |
Синтетическая циклогексилсульфаминовая кислота, натриевая соль |
40 |
|
||
α-Аспартам |
Дипептид, метиловый эфир |
|
200 |
|
|
Стевиозид |
Гликозилированный дитерпен |
|
300 |
|
|
Сахарин |
Синтетический имид 2-сульфобензойной кислоты, натриевая соль |
450 |
|
||
Тауматин |
Негликозилированный белок – одна полипептидная цепь |
|
2500 |
|
|
|
из 208 аминокислотных остатков |
|
|
||
Монеллин |
Негликозилированный белок – две полипептидные цепи |
|
2500 |
|
|
|
из 44 и 50 аминокислотных остатков |
|
37 |
||
|
|
|
|
|
|
Спирты, кислоты и аминокислоты
Получение L-аминокислот
путем ферментативной трансформации
ВВЕДЕНИЕ. Как мы уже видели на примере L-лизина, L-аспарагиновой кислоты и L-фенилаланина, тот или иной энантиомер аминокислоты можно получить путем ферментативных превращений предшественников. В отличие от ферментации использование энантиоспецифичных ферментов позволяет синтезировать небелковые аминокислоты. Для этой цели наиболее широко используют гидролазы, селективно расщепляющие определенные энантиомеры в рацемате. В качестве примера можно привести эстеразы, аминоацилазы, амидазы и гидантоиназы. Недостаток метода заключается в необходимости удаления «неправильного» энантиомера из реакционной смеси, его рацемизации и повторного введения в реакцию. В другом методе используются реакции присоединения, катализируемые лиазами (например, оксинитрилазами), или окислительно-восстановитель- ные реакции, катализируемые оксидоредуктазами; в этих реакциях образуются только «правильные» энантиомеры.
ЭНАНТИОСЕЛЕКТИВНЫЙ ГИДРОЛИЗ. Наиболее хорошо изучены и активно применяются в современных промышленных процессах аминоацилазы и гидантоиназы. Для осуществления гидролиза рацемата N-ациламинокислот используют иммобилизованную ацилазу, выделенную из Aspergillus oryzae или Baсillus thermoglucosidius. В реакции участвуют только L-энантиомеры, а N-ацил-D-аминокислоты, оставшиеся в реакционной смеси после кристаллизации L-аминокислот, подвергают термической рацемизации и снова вводят в реакцию. Таким способом ежегодно производят сотни тонн L-метионина, L-тирози- на, L-пролина и L-валина для медицинских нужд. Аналогичным образом можно получать и D-амино- кислоты, однако более выгодно использовать доступные предшественники аминокислот – гидантоины. После расщепления гидантоинов специфическими гидантоиназами образуются N-карбамоил- аминокислоты, которые в свою очередь могут быть превращены в D- или L-аминокислоты при помощи карбамоилаз. «Ложный» гидантоин прекращает ферментативную рацемизацию и в ходе оптимизированного путем генетических технологий ферментативного каскада приводит к количественному выходу абиогенных L- и D-аминокислот. Свойство «неправильного» гидантоина рацемизоваться при рН 8,5 легло в основу нового метода, перспективного для промышленного получения D-фенилглицина и 4-гидроксифенилглицина – важных предшественников полусинтетических пенициллинов ампициллина и амоксициллина.
ЭНАНТИОСЕЛЕКТИВНЫЕ РЕАКЦИИ ПРИСОЕДИНЕНИЯ.
оксинитрилазы – ферменты из растительных тканей.
Внастоящее время R- и S-оксинитрилазы получены в виде рекомбинантных белков в клетках E. coli; при этом ген R-оксинитрилазы клонирован из маниока, а ген S-оксинитрилазы – из миндаля. Определена пространственная структура обоих ферментов и с помощью методов белковой инженерии предприняты попытки усовершенствовать ферменты для промышленного применения.
ЭНАНТИОСЕЛЕКТИВНЫЕ ОКИСЛИТЕЛЬНО-ВОССТАНО- ВИТЕЛЬНЫЕ РЕАКЦИИ. На примере стереоселективного синтеза L-лейцина из α-оксоизокапроновой кислоты видно, что для восстановительного аминирования с помощью L-лейциндегидрогеназы из Bacil-
lus sp. кроме NH3 необходим NADH. Ввиду высокой стоимости кофермента необходимо создать систему его регенерации. Очень элегантно эта проблема решена в случае формиатдегидрогеназы из Candida boi-
dinii: CO2 – один из побочных продуктов реакции – сдвигает равновесие в сторону образования L-лейци- на. Использование NADH, связанного с полиэтиленгликолем (ПЭГ), позволяет получать до 600 000 молярных эквивалентов продукта из одного моля NADH.
Впромышленности восстановление NADH в окисли- тельно-восстановительных реакциях происходит на неизменяющемся коэнзиме в порционном режиме. Еще более интенсивно подобный процесс происходит
сучастием измененных (путем Protein Design или направленной эволюции) ферментов в генетически модифицированных микроорганизмах.
Для осуществления реакций, специфичных для 38 R- и S-энантиомеров, используют соответствующие

Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
Наиболее хорошо изученные реакции |
|
|
|
||||
Тип реакции |
Класс фермента |
Комментарий |
|
|
|||
Гидролиз рацемических |
Гидролазы |
|
Простая, широко применяемая, но дорогостоящая реакция, так как |
||||
смесей предшествеников |
|
|
|
«неправильный» энантиомер необходимо вновь рацемизировать |
|||
Присоединение |
Лиазы |
|
|
Простая реакция с количественным выходом; |
|||
HCN или NH3 |
|
|
|
недостаток – малый выбор ферментов |
|
||
по карбонильной группе |
|
|
|
|
|
|
|
Восстановительное |
Дегидрогеназы |
Образуется только один энантиомер, однако это процесс |
|||||
аминирование |
|
|
|
дорогой из-за затрат на системы регенерации кофакторов |
|||
α-оксокарбоновых кислот |
|
|
|
|
|
|
|
1 |
|
|
|
|
2 |
1 |
Гидантоиназы |
|
|
|
|
2 |
Карбамоилазы |
||
|
|
|
|
|
|
||
|
|
|
|
|
|
3 |
Эстеразы |
|
|
|
|
|
|
|
(R1 = OR, R2 = H) |
|
|
|
|
|
|
4 |
Аминоацилазы |
|
|
|
|
|
|
|
(R1 = OH, R2 = Acyl) |
|
3 |
4 |
5 |
|
|
5 |
Амидазы |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
(R1 = NH2, R2 = H) |
|
|
|
|
|
L-Аминокислота |
6 |
Оксинитрилазы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Например, |
|
6 |
|
|
|
|
|
L- или S-специфические |
|
|
|
|
|
|
|
ферменты |
|
|
|
|
|
|
Ферментативный |
|
Реакции химического |
|
|
|
|
|
катализ |
|
синтеза |
Энантиоселективное расщепление D,L-N-ациламинокислот |
|
|
|||||
N-Ацетил-D,L-аминокислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рацеми- |
Иммоби- |
|
|
|
|
Кристаллизатор |
|
зация |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
лизован- |
|
|
|
|
|
|
|
ная амино- |
|
|
|
|
|
|
N-Ацетил- |
ацилаза |
|
|
|
|
Сепаратор |
|
|
Испаритель |
|
|
D-аминокислота |
||||
|
|
|
|
||||
|
|
|
|
|
|||
|
(растворитель, |
L-Аминокислота |
|
Не кристаллизуется |
|||
|
уксусная кислота) |
|
|
||||
|
|
|
|
|
Кристаллизуется |
|
|
Восстановительное аминирование α-оксокарбоновых кислот |
|
|
|||||
Лейциндегидрогеназа, обладающая широкой |
|
|
Мембранный ферментный реактор |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
субстратной специфичностью, осуществляет реакцию |
|
|
|
|
|
|
|
|
|
|
|
|
||||
аминирования не только лейцина, |
|
|
|
|
|
L-Лейциндегидрогеназа |
|
|
|
|
|
|
|
|||
но и других α-оксокарбоновых кислот. |
|
|
α-Оксо- |
|
|
|
|
|
|
|
L-Лейцин |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||||
При этом образуются небелковые аминокислоты, |
изокап- |
|
|
|
|
|
|
|
|
|
||||||
например L-лейцин. |
|
|
|
ронат |
до 106 циклов |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Лейциндегидрогеназа |
Относительная |
K , mM |
|
|
|
ПЭГ-NADH |
ПЭГ-NADH+ |
|
|
|
|
|
|
|
|
|
из Bacillus sphaericus |
активность |
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
α-оксоизокапронат |
100 |
0,31 |
|
СО2 |
|
|
|
|
|
|
|
Муравьиная |
|||
|
α-оксоизовалериат |
126 |
1,4 |
|
|
Формиатдегидрогеназа |
|
|
|
кислота |
||||||
|
α-оксовалериат |
76 |
1,7 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
α-оксобутират |
57 |
7,7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мембрана для |
||||||||||||
|
α-оксокапронат |
46 |
7,0 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
ультрафильтрации |
||||||||||
ПЭГ-NADH – синтетическое производное NADH с MR = 3000. Многие дегидрогеназы способны использовать |
||||||||||||||||
его в качестве кофактора. Для удерживания ПЭГ-NADH в реакционной смеси используют ультрафильтрацию. |
||||||||||||||||
Реакция протекает со свободным NADH и расходованием продукта. |
|
|
|
|
|
|
|
|
39 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
