
- •Ерстенюк а.М., Сиротинська і.Д., Мельник м.В.,
- •На підготовчому факультеті іноземних громадян
- •1. Тематичний план лекцій з хімії
- •2. Тематичний план лабораторних занять з хімії
- •3. Тематичний план контрольних робіт з хімії
- •4. Тематичний план практичних і лабораторних занять з хімії
- •Частина і. Загальна хімія
- •§1.1. Класифікація речовин
- •Способи розділення сумішей
- •Фізичні
- •§1.2. Хімічні елементи
- •Символ позначає:
- •§1.3. Атомно-молекулярне вчення. Поняття «атом» і «молекула»
- •§1.4. Відносна атомна та молекулярна маса
- •Формула позначає:
- •§1.5. Моль. Молярна маса. Закон Авогадро
- •§1.6. Основні закони хімії
- •1. Закон збереження маси: маса речовин, які вступили в реакцію, дорівнює масі продуктів реакції. Тобто, атоми не змінюються в хімічних реакціях, а тільки переходять з одних молекул в інші.
- •2. Закон сталості складу: кожна чиста речовина молекулярної будови має постійний склад, який не залежить від місця і способу одержання речовини.
- •§1.7. Приклади розв’язування задач
- •Заняття №1 Тема: Предмет хімії. Значення хімії у сучасних технічних досягненнях, у медицині та фармації. Прості і складні речовини. Властивості речовин. Чисті речовини і суміші
- •Самостійна позааудиторна робота:
- •Контрольні питання:
- •Самостійна робота на занятті
- •Самостійна позаавдиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №3 Тема: Закон збереження маси речовин. Хімічне рівняння. Кількість речовини. Моль – одиниця кількості речовини. Молярна маса. Закон Авогадро. Молярний об'єм газу.
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №4
- •Тема: Розв’язування задач на основі законів хімії.
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
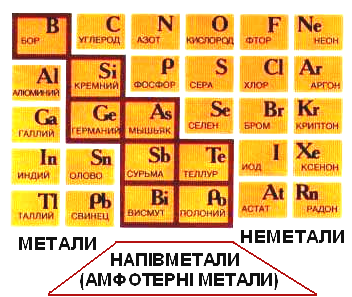
- •Розділ 2. Періодичний закон і періодична система
- •Структура періодичної системи д.І.Менделєєва
- •Номер групи співпадає з числом валентних електронів, які можуть брати участь в утворенні хімічних зв'язків.
- •Значення періодичного закону і системи елементів
- •§2.2. Зміна властивостей елементів у періодичній системі д.І.Менделєєва
- •Розглянемо основні закономірності зміни властивостей елементів
- •§2.3. Будова атома. Ядро. Ізотопи
- •§2.4. Будова електронних оболонок атомов
- •§2.5. Квантові числа електронів
- •§2.6. Електронні формули елементів
- •Кожен елемент має свою індивідуальну електронну формулу.
- •§2.7. Залежність властивостей елементів від періодичної зміни електронних структур атомів
- •Заняття №5 Тема: Будова атома. Склад атомних ядер. Ізотопи
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №6 Тема: Атоми як форма існування хімічних елементів. Будова електронних оболонок атомів хімічних елементів. Квантові числа. Електронні формули. Поняття про електронегативність
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №7 Тема: Періодичний закон. Періодична система хімічних
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №8 Тема: Залежність властивостей елементів від періодичної зміни електронних структур атомів. Характеристика хімічних елементів за положенням у періодичній системі та будовою атома
- •Самостійна позаудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Характеристика хімічних елементів за положенням в періодичній системі і будовою атома
- •Розділ 3. Хімічний зв'язок. Типи хімічних зв’язків,
- •1. Ковалентний зв'язок
- •2. Йонний зв'язок
- •3. Металічний зв'язок
- •4. Водневий зв'язок
- •§3.2. Ковалентний зв'язок та його види
- •Види ковалентного зв'язку:
- •Властивості речовин з ковалентним неполярним зв'язком:
- •Властивості речовин з ковалентним полярним зв'язком:
- •§3.3. Механізми утворення ковалентного зв’язку
- •§3.4. Властивості ковалентного зв'язку. Σ – та π - зв’язки
- •3.5. Гібридизація атомних орбіталей.
- •3.6. Йонний зв'язок. Механізм утворення йонного зв’язку
- •3.7. Валентність та ступінь окиснення елементів
- •Як складати формули сполук за валентністю
- •Як знайти валентність:
- •3.8. Металічний зв'язок
- •3.9. Водневий зв’язок
- •Заняття 9
- •Тема: Природа хімічного зв’язку. Види хімічного зв’язку.
- •Ковалентний зв'язок: полярний і неполярний.
- •Донорно-акцепторний механізм утворення хімічного зв’язку. Гібридизація. Типи гібридизації
- •Самостійна позавдиторна робота студентів.
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття 10 Тема: Йонний зв’язок, як граничний випадок ковалентного зв’язку. Валентність і ступінь окиснення. Металічний та водневий зв'язок.
- •Самостійна позавдиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Розділ 4. Кінетика хімічних реакцій
- •§4.2. Тепловий ефект реакцій
- •§4.3. Швидкість хімічних реакцій. Фактори, від яких залежить швидкість реакції
- •1) Вплив природи реагуючих речовин
- •2) Вплив концентрації реагуючих речовин
- •3) Вплив температури на швидкість реакції
- •4) Вплив каталізатора
- •§4.4. Рівновага хімічних реакцій
- •§4.5. Способи зсуву хімічної рівноваги. Закон Ле-Шательє
- •Самостійна позааудиторна робота:
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №12
- •Тема: Загальні уявлення про швидкість хімічних реакцій.
- •Залежність швидкості реакції від природи, концентрації,
- •Температури. Поняття про каталіз
- •Самостійна позааудиторна робота:
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №13 Тема: Оборотні та необоротні реакції. Хімічна рівновага. Принцип Ле-Шательє. Константа рівноваги. Вплив зовнішніх факторів на хімічну рівновагу.
- •Самостійна позааудиторна робота
- •7. Як вплине підвищення температури на вихід продуктів реакції
- •Контрольні питання:
- •Самостійна робота на занятті
- •Розділ 5. Окисно-відновні реакції
- •§5.2. Найважливіші окисники і відновники. Окисно-відновний дуалізм
- •§5.3. Типи окисно-відновних реакцій та вплив на них різних факторів
- •Фактори, що впливають на окисно-відновні
- •§5.4. Складання рівнянь окисно-відновних реакцій
- •§5.5. Реакції з участю перманганату калію (kMnO4) як окисника
- •Реакції в нейтральному середовищі (рН7)
- •Самостійна позаудиторна робота:
- •Контрольні питання
- •Самостійна робота на занятті
- •Розділ 6. Класи неорганічних сполук
- •§6.2. Оксиди, їх склад, назви оксидів, добування, хімічні властивості
- •Графічні формули
- • Коротко основні хімічні властивості оксидів
- •Одержання оксидів
- •6.3. Основи, їх назви, добування та властивості. Амфотерні гідроксиди
- •Графічні формули основ
- •Одержання гідроксидів
- •§6.4. Кислоти, їх класифікація та номенклатура. Добування та властивості кислот
- •Хімічні властивості кислот
- •2. Кислоти взаємодіють з металами:
- •3) Кислоти взаємодіють з основними оксидами.
- •4) Кислоти взаємодіють з основами:
- •5) Кислоти взаємодіють з солями, якщо утворюється осад () або газ ():
- •6 Деякі кислоти розкладаються при нагріванні:
- •Одержання кислот
- •§6.5. Солі, їх властивості, класифікація солей, назви і добування солей. Комплексні сполуки
- •Класифікація солей:
- •Одержання солей
- •Хімічні властивості
- •Кислі солі
- •Основні солі
- •§5.6. Генетичний зв’язок між різними класами неорганічних сполук
- •Кислота
- •Заняття №15 Тема: Класифікація неорганічних речовин. Оксиди, їх класифікація, хімічні властивості.
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №16 Тема: Основи. Номенклатура основ, графічне зображення формул. Луги та нерозчинні у воді основи. Методи одержання та основні хімічні властивості основ
- •Самостійна позаавдиторна робота студентів.
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №17 Тема: Кислоти, їх класифікація. Способи отримання та хімічні властивості кислот.
- •Самостійна позаааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №18
- •Тема: Солі. Одержання солей. Хімічні властивості.
- •Класифікація солей за хімічними властивостями
- •(Середні, кислі, основні).
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №19
- •Контрольна робота №2
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті Правила техніки безпеки в хімічній лабораторії.
- •Перша допомога при нещасних випадках.
- •Оформлення звітів лабораторних робіт Звіти оформляються в окремому зошиті об’ємом біля 50 листів.
- •Журнал для лабораторних робіт
- •Розділ 7. Розчини.
- •Класифікація розчинів
- •3. За кількістю розчиненої речовини розчини ділять на:
- •§7.2. Розчинність речовин у воді
- •Механізм розчинення
- •§7.3. Способи вираження концентрації розчинів
- •§7.4. Приклади розв’язування задач за темою «Розчини»
- •Розв’язок:
- •Самостійна позаавдиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №21 Тема: Способи вираження концентрації розчинів: масова частка та молярна концентрація розчиненої речовини. Розв’язування розрахункових задач.
- •Самостійна позаавдиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №22
- •Тема: Приготування розчинів з заданою масовою часткою та молярною концентрацією
- •Самостійна позааудиторна робота студентів.
- •Самостійна робота на занятті
- •Техніка приготування розчину з заданою концентрацією:
- •Розділ 8. Електролітична дисоціація. РН розчинів
- •Причини та умови електролітичної дисоціації.
- •Механізм дисоціації:
- •§8.2. Особливості розчинів кислот, основ та солей
- •§8.3. Ступінь дисоціації. Сильні та слабкі електроліти. Константа дисоціації.
- •§8.4. Йонні рівняння реакцій
- •Умови безповоротності реакцій іонного обміну
- •Скорочене йонне рівняння показує
- •§8.5. Дисоціація води. Водневий показник.
- •§8.6. Гідроліз солей. Ступінь та константа гідролізу
- •Заняття №23
- •Тема: Теорія електролітичної дисоціації.
- •Електролітична дисоціація кислот, основ і солей у водних розчинах. Сильні та слабкі електроліти.
- •Ступінь та константа електролітичної дисоціації
- •Самостійна позаавдиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №24 Тема: Електролітична дисоціація води. Іонний добуток води. Водневий показник – рН.
- •Самостійна позаавдиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №25 Тема: Реакції обміну між розчинами електролітів. Йонні реакції. Контрольна робота №3
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття 26.
- •Тема: Гідроліз солей
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •§9.2. Загальні фізичні та хімічні властивості металів
- •Загальні хімічні властивості металів
- •§9.3. Лужні метали. Будова, фізичні та хімічні властивості.
- •Фізичні властивості. Низькі температури плавлення, мала густина, м'які, ріжуться ножем.
- •Найважливіші Сполуки лужних металів
- •Оксиди (r2o) і пероксиди (r2o2)
- •ГІдроксиди (roh)
- •§9.4. Властивості лужноземельних металів. Твердість води.
- •Хімічні властивості
- •Найважливіші Сполуки лужноземельних металів
- •Оксиди (ro)
- •ГІдроксиди r(oh)2
- •§9.5. Підгрупа алюмінію
- •Хімічні властивості
- •Алюміній (Al) Хімічні властивості
- •Найважливіші Сполуки алюмінію
- •Гідроксид алюмінію (Al(он)3)
- •§9.6. Перехідні метали.
- •Сполуки двОвалентного Феруму
- •Гідроксид Феруму (II) Fe(oн)2
- •Сполуки трЬОхвалентного Феруму
- •Оксид Феруму (iіi) Fe2o3
- •Гідроксид феруму (iіi) Fe(oн)3
- •Заняття №27 Тема: Загальна характеристика металів. Розміщення в періодичній системі. Фізична та хімічні властивості металів. Електрохімічний ряд напруг металів. Метали в природі
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №28 Тема: Лужні і лужноземельні метали. Їх будова, фізичні та хімічні властивості. Біологічна роль сполук натрію і калію. Характеристика кальцію та його сполук
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №29
- •Тема: Алюміній: будова атома та властивості.
- •Амфотерні властивості оксиду і гідроксиду алюмінію.
- •Ферум як представник d-елементів: будова атома та властивості. Добування і використання металів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №30
- •Тема: Порівняння хімічної активності металів
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Розділ 10. Неметали
- •Здатність атомів елементів приєднувати до себе електрони знижується в ряді:
- •§10.2. Гідроген (Водень)
- •Одержання
- •§10.3. VII а група - галогени
- •Найважливіші Сполуки
- •§10.4. VI а група – Підгрупа Оксигену
- •Сірка (сульфур) s
- •Найважливіші Сполуки сірки
- •Хімічні властивості
- •Хімічні властивості
- •Хімічні властивості
- •Хімічні властивості
- •§10.5. VII а група – підгрупа Нітрогену (Азот)
- •Хімічні властивості
- •Азот і його сполуки азот (Нітроген) n2
- •Найважливіші Сполуки азоту
- •Солі амонію
- •Хімічні властивості
- •Оксиди нітрогену
- •Хімічні властивості
- •Хімічні властивості
- •Реакції розкладання нітратів при нагріванні
- •Фосфор. Будова атома, властивості фосфору та основних його сполук Алотропні модифікації
- •Хімічні властивості
- •Хімічні властивості
- •Хімічні властивості
- •Хімічні властивості
- •Хімічні властивості
- •§10.6. IV а група.
- •Алотропія в природі вуглець існує у вигляді кількох алотропних модифікацій:
- •Хімічні властивості
- •Найважливіші сполуки вуглецю
- •Карбонатна (вугільна) кислота h2co3
- •Найважливіші сполуки кремнію
- •Кремнієві кислоти
- •Поняття про твердість води
- •Заняття №31 Тема: Положення елементів-неметалів в періодичній системі. Гідроген: будова атома, поширення в природі та властивості. Сполуки гідрогену. Властивості води
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №32 Тема: Будова і властивості неметалів VII групи. Хлор: будова атома, поширення в природі та властивості. Найважливіші сполуки хлору: хлороводень, хлоридна кислота.
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №33
- •Тема: Властивості неметалів VI групи.
- •Оксиген: будова атома і поширення в природі. Поняття про алотропію. Озон. Хімічні властивості та застосування кисню.
- •Будова атома та властивості сульфуру і його сполук.
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №36 Тема: Контрольна робота №4
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Частина ііі. Органічна хімія Розділ 11. Теоретичні основи органічної хімії
- •§11.1. Предмет органічної хімії
- •§11.2. Теорія будови органічних речовин. Ізомери. Теорія будови органічних сполук а.М. Бутлерова:
- •§11.3. Класифікація органічних сполук
- •§11.5. Номенклатура органічних сполук
- •§11.6. Класифікація реакцій в органічній хімії
- •Розділ 12. Вуглеводні
- •§12.1. Насичені вуглеводні (алкани)
- •12.1.1. Гомологічний ряд алканів
- •12.1.2. Будова молекули Метану
- •12.1.3. Ізомерія
- •12.1.4. Одержання
- •3) Реакція Вюрца:
- •12.1.7. Застосування
- •§12.2. Ненасичені вуглеводні
- •12.2.1. Алкени. Гомологічний ряд алкенів.
- •Структурна формула етилену електронна формула етилену
- •12.2.2. Електронна будова подвійного зв’язку
- •12.2.3. Ізомерія
- •12.2.4. Одержання
- •12.2.5. Фізичні властивості
- •12.2.6. Хімічні властивості
- •12.2.7. Застосування
- •12.2.8. Дієнові вуглеводні (алкадієни). Типи алкадієнів.
- •12.2.9. Одержання алкадієнів
- •12.2.10. Хімічні властивості алкадієнів
- •Полімеризація дієнових сполук
- •12.2.11. Алкіни. Гомологічний ряд алкінів
- •12.2.12. Добування
- •12.2.13. Електронна будова потрійного зв’язку
- •12.2.14. Фізичні властивості алкінів
- •Застосування
- •§ 2.3. Ароматичні вуглеводні (арени)
- •12.3.1. Будова молекули бензолу (бензену)
- •12.3.2. Гомологи бензолу. Ізомерія. Гомологи бензолу можна розглядати як похідні бензолу, в яких один або декілька атомів вуглецю заміщені різними вуглеводневими радикалами.
- •12.3.3. Фізичні властивості
- •12.3.4. Хімічні властивості
- •І. Реакції заміщення:
- •1) Галогенування
- •1) Гідрування:
- •2) Галогенування
- •12.3.5. Правила орієнтації в бензольному ядрі
- •12.3.6. Застосування
- •13.1.1. Одноатомні спирти
- •Гомологічний ряд спиртів
- •Фізичні властивості
- •Одержання
- •4) Гідроліз галогенопохідних вуглеводнів:
- •13.1.2. Багатоатомні спирти
- •Застосування
- •13.3.1. Номенклатура альдегідів і кетонів
- •13.3.2. Одержання
- •13.3.3. Хімічні властивості
- •1) Реакції приєднання
- •2) Реакція відновлення:
- •3) Реакції полімеризації:
- •13.3.4. Застосування
- •§13.4. Карбоксильні сполуки
- •13.4.1. Карбонові кислоти
- •Класифікація карбонових кислот
- •Номенклатура
- •Ізомерія карбонових кислот
- •Одержання
- •3) Промисловий синтез оцтової кислоти:
- •Хімічні властивості
- •Застосування
- •13.4.2 Естери
- •Номенклатура
- •Види ізомерії
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •Застосування
- •Генетичний зв’язок між вуглеводнями, спиртами, альдегідами і кислотами
- •13.4.3 Ліпіди (жири)
- •Класифікація
- •Номенклатура
- •Одержання
- •Перший синтез жиру здійснив Бертло (1854 р.) при нагріванні гліцерину і стеаринової кислоти:
- •Хімічні властивості
- •Застосування
- •Біологічна роль (функції) жирів у людському організмі
- •Розділ 14. Вуглеводи §14.1. Вуглеводи. Їх класифікація
- •Значення
- •§14.2. Моносахариди. Будова. Ізомерія Вуглеводи. Генетичний d- ряд моносахаридів
- •Класифікація
- •Номенклатура Генетичний d- ряд сахаридів
- •Формули Хеуорса
- •Фізичні властивості
- •II. Реакції по гідроксильних групах
- •2. Ацилювання (утворення складних ефірів).
- •III. Специфічні реакції
- •Застосування
- •Застосування
- •Знаходження в природі
- •Знаходження в природі
- •Застосування
- •Розділ 15. Нітрогенвмісні органічні сполуки §15.1. Нітросполуки
- •Класифікація і номенклатура
- •Одержання
- •Хімічні властивості
- •Застосування
- •Класифікація
- •Номенклатура
- •Ізомерія
- •Застосування
- •§15.3. Амінокислоти
- •Класифікація
- •Ізомерія
- •Хімічні властивості
- •Біполярний йон
- •Застосування
- •Поширення в природі
- •Хімічні властивості
- •Заняття №37 Тема: Поняття про органічні сполуки. Теорія хімічної будови органічних сполук о. М. Бутлерова. Електронна природа зв'язків. Класифікація і номенклатура органічних сполук
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №38 Тема: Насичені вуглеводні. Алкани. Будова, хімічні властивості, застосування насичених вуглеводнів
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №39 Тема: Ненасичені вуглеводні. Π-зв’язок. Алкени. Алкадієни. Алкіни. Хімічні властивості та застосування. Реакція полімеризації. Полімери. Одержання, властивості і застосування пластмас
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №40 Тема: Ароматичні вуглеводні. Системи спряження. Правила орієнтації в ароматичному ядрі.
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №41 Тема: Контрольна робота №5
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №42 Тема: Кисневмісні сполуки. Спирти. Будова, властивості, застосування насичених одноатомних спиртів. Багатоатомні спирти
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №43 Тема: Ароматичні спирти і феноли. Структура, властивості, застосування. Генетичний зв'язок між спиртами і вуглеводами
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №45
- •Тема: Карбонові кислоти.
- •Гомологічний ряд одноосновних насичених кислот.
- •Двохосновні карбонові кислоти. Ненасичені карбонові кислоти
- •Самостійна позааудиторна робота студентів:
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №46 Тема: Зв’язок між вуглеводнями, спиртами, кислотами. Взаємозв’язок між класами органічних сполук.
- •Самостійна позааудиторна робота студентів:
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №47 Тема: Контрольна робота №6
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №48. Лабораторна робота №6. Тема: Ароматичні вуглеводні. Властивості бензолу та його гомологів
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Дослід 2. Дія бромної води і калій перманганату на бензен.
- •Заняття №49 Лабораторна робота №7. Тема: Спирти і альдегіди
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Заняття №50 Лабораторна робота №8. Тема: Карбонові кислоти
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Заняття №51 Лабораторна робота №9. Тема: Взаємозв’язок між класами органічних сполук
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Заняття №52 Тема: Складні ефіри. Жири як естери. Хімічні властивості жирів.
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №53 Тема: Вуглеводи. Класифікація вуглеводів. Моносахариди.
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №54 Тема: Ди- і полісахариди.
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №55 Тема: Азотовмісні сполуки. Аміни
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №56 Тема: Амінокислоти. Пептиди. Білки. Контрольна робота №7
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Класифікація оксидів
§6.2. Оксиди, їх склад, назви оксидів, добування, хімічні властивості
|
ОКСИДИ – це складні речовини, що складаються з двохелементів, один з яких Оксиген в ступені окиснення –2. |
Загальна формула оксидів ЕхОу; де Е – елемент, х та у – індекси.
КЛАСИФІКАЦІЯ ОКСИДІВ:
|
Несолетворні |
- не утворюють солей при хімічних реакціях: CO, N2O, NO |
|
Солетворні
|
ОСНОВНІ це оксиди металів які проявляють невеликий ступінь окиснення +1 +2: Na2O; MgO; CuO |
|
АМФОТЕРНІ (звичайно для металів зі ступенем окиснення +3 +4): ZnO; Al2O3; Cr2O3; SnO2 Як гідрати їм відповідають амфотерні гідроксиди. | |
|
КИСЛОТНІ це оксиди неметалів і металів зі ступенем окиснення від +5 до +7: SO2; SO3; P2O5; Mn2O7; CrO3 |
Основним оксидам відповідають ОСНОВИ,
кислотним – КИСЛОТИ,
амфотерним – і ті й інші.
|
|
КИСЛОТНИМИ ОКСИДАМ називаються оксиди, які взаємодіють з ОСНОВАМИ з утворенням солі та води. ОСНОВНИМИ ОКСИДАМИ називаються оксиди, які взаємодіють з КИСЛОТАМИ з утворенням солі та води. АМФОТЕРНИМИ ОКСИДАМИ називаються оксиди, які взаємодіють як з КИСЛОТАМИ так і з ОСНОВАМИ з утворенням солі та води. |
НОМЕНКЛАТУРА ОКСИДІВ
НАЗВА ОКСИДІВ складається з трьох слів:
1. Українська назва елементу в родовому відмінку.
2. Валентності елементу.
3. Слова "оксид". Наприклад: Fе2О3 - ферум (III) оксид
Мn2О7 - мангану (VII) оксид
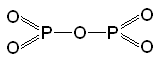
Графічні формули
Графічні формули показують порядок сполучення атому з іншими атомами в молекулі та валентність атомів.
Правила написання графічних формул:
1. Атом Оксигену завжди двовалентний (─О─)
2. Атоми Оксигену не з'єднуються один з одним, окрім пероксидів Н2О2 (Н─О─О─Н), ВаО2.
3. Атоми одного елементу не з'єднуються один з одним.
|
СО2 |
О = С = О; |
Р2О5 |
|
; |
Сl2О7 |
|
ХАРАКТЕРИСТИКА ОКСИДІВ.
|
ОСНОВНІ ОКСИДИ |
КИСЛОТНІ ОКСИДИ |
|
утворюють основи, а при взаємодії з кислотами та кислотними оксидами утворюють КАТІОНИ солей. Наприклад: К2О, ВаО, СrO. |
утворюють кислоти, а при взаємодії з основами та основними оксидами – АНІОНИ солей. Наприклад: СО2, SО3, Mn2O7 |
|
ФІЗИЧНІ ВЛАСТИВОСТІ | |
|
це тверді речовини з високою температурою плавлення |
За агрегатним станом поділяються на три групи: - газоподібні: СО2, SO2 - рідкі: SO3, N2O3, C12O7 - тверді: Р2О5, N2O5. Всі кислотні оксиди розчиняються у воді, окрім SiO2. Погано розчиняються СО2, SO2. |
|
ХІМІЧНІ ВЛАСТИВОСТІ | |
|
1) Основний оксид + вода = основа (ЛУГ) Na2O + Н2О = 2NaOH СаО + Н2О = Са(ОН)2 СuО + Н2О – реакція не йде, оскільки СuО і Сu(ОН)2 не розчиняються у воді. 2) Основний оксид + кислотний оксид = сіль MgO + SO3 = MgSO4 3) Основний оксид + кислота = сіль + Н2О К2О + 2HNO3 = 2KNO3 + Н2О |
1) Кислотний оксид + вода = кислота SO3 + Н2О = H2SO4 Р2О5 +3 Н2О = 2 Н3РО4 N2O5 + Н2О = 2 HNО3, SiO2 + Н2О – реакція не йде, оскільки SiO2 і Н2SiO3 не розчиняються з воді 2) Кислотний оксид + основний оксид = сіль
S H2SO4 3) Кислотний оксид + основа =: сіль + Н2О
S H2SiO3 |
|
АМФОТЕРНІ ОКСИДИ | |
|
Здатні проявляти властивості як основних, так і кислотних оксидів залежно від умов реакції. Амфотерним оксидам відповідають як основи, так і кислоти, вони утворюють катіони солей в реакціях з кислотами і аніони солей в реакціях з лугами. Амфотерні оксиди з водою не взаємодіють. | |
|
ХІМІЧНІ ВЛАСТИВОСТІ | |
|
1). Амфотерний оксид + кислота = сіль + вода А12О3 + 2 Н3РО4 = 2A1PO4 + 3Н2О ZnO + H2SO4 = ZnSO4 + Н2О 2). Амфотерний оксид + луг = сіль + вода А12О3 +2 NaOH = 2NaAlO2 + Н2О ZnO + 2 КОН = K2ZnO2 + Н2О у розчинах утворюються гідроксокомплекси: А12О3 + 2NaOH + 7Н2О = 2Na[Al(OH)4(H2O)2] ZnO + 2NaOH + Н2О = Na2[Zn(OH)4] | |


 O3
+
СаО =
CaSO4
O3
+
СаО =
CaSO4 iO2
+ 2 NaOH = Na2SiO3
+ H2O
iO2
+ 2 NaOH = Na2SiO3
+ H2O