
- •Общее описание печи 406
- •Часть 1.Производство чугуна и железа
- •Глава 1.Сырые материалы и их подготовка
- •§1. Железные руды
- •§2. Основные месторождения железных руд
- •§3. Марганцевые руды
- •§4. Флюсы и отходы производства
- •§5. Подготовка железных руд к доменной плавке
- •§6. Топливо
- •Глава 2. Конструкция доменной печи
- •§1. Общее описание печи
- •§2. Профиль печи и основные размеры
- •§3. Фундамент, кожух и холодильники
- •§4. Футеровка печи
- •§6. Колошниковое устройство
- •Глава 3. Доменный процесс
- •§1. Загрузка шихты и распределение материалов на колошнике
- •§2. Распределение температур, удаление влаги и разложение карбонатов
- •§3. Процессы восстановления
- •1. Восстановление железа
- •2. Восстановление марганца и выплавка марганцовистых чугунов
- •3. Восстановление кремния и выплавка кремнистых чугунов
- •4. Восстановление фосфора
- •5. Восстановление других элементов
- •§4. Образование чугуна
- •§5. Эбразование шлака и его свойства
- •§6. Поведение серы
- •§ 7. Дутье, процессы в горне и движение газов в печи
- •1. Дутье
- •2. Процессы в горне
- •3. Движение газов в печи и изменение их температуры, состава, количества и давления
- •§8. Интенсификация доменного прцесса
- •1. Нагрев дутья
- •2. Увлажнение дутья
- •3. Повышенное давление газа
- •4. Обогащение дутья кислородом
- •5. Вдувание в горн углеродсодержащих веществ
- •6. Комбинированное дутье
- •§ 9. Продукты доменной плавки
- •§ 10. Управление процессом, контроль, автоматизапще
- •§ 11. Организация ремонтов, задувка и выдувка печи
- •Глава 4. Оборудование и работа обслуживающих доменную печь участков
- •§ 1. Подача шихты в доменную печь
- •§ 2. Воздухонагреватели и нагрев дутья
- •§ 3. Очистка доменного газа
- •§ 4. Выпуск и уборка чугуна
- •§ 5. Выпуск и уборка шлака
- •Глава 5.Показатели работы доменных печей
- •§ 1. Материальный и тепловой балансы плавки
- •§ 2. Расход кокса
- •§ 3. Основные технические показатели
- •§ 1. Актуальность проблемы
- •§ 2. Процессы твердофазного восстановления железа
- •§ 3. Процессы жидкофазного восстановления (пжв)
- •§ 4. Решение проблем охраны природы и охраны труда
- •§ 1. История развития сталеплавильного производства
- •§ 2. Классификация стали
- •§ 3. Основные реакции и процессы сталеплавильного производства
- •1. Термодинамика сталеплавильных процессов
- •2. Кинетика сталеплавильных процессов
- •3. Сталеплавильные шлаки
- •4. Основные реакции сталеплавильных процессов
- •6. Неметаллические включения
- •7. Раскисление и легирование стали
- •§ 4. Шихтовые материалы сталеплавильного производства
- •§ 1. Разновидности конвертерных процессов
- •1. Конвертерные процессы с донным воздушным дутьем
- •2. Кислородно-конвертерные процессы
- •§ 2. Устройство кислородных конвертеров для верхней продувки
- •§ 3. Шихтовые материалы кислородно-конвертерного процесса
- •§ 4. Плавка в кислородном конвертере с верхней продувкой
- •1. Технология плавки
- •2. Режим дутья
- •3. Поведение составляющих чугуна при продувке
- •4. Шлаковый режим
- •5. Раскисление и легирование
- •6. Тепловой режим
- •7. Потери металла при продувке
- •8. Основные технические показатели
- •§ 5. Конвертерные процессы с донной продувкой кислородом
- •§ 6. Конвертерные процессы с комбинированной продувкой
- •6 7. Плавка с увеличенным расходом лома
- •§ 8. Передел высокофосфористых чугунов
- •§ 9. Передел пригодно легированных чугунов
- •§ 10. Экология, очистка конвертерных газов
- •§ 11. Автоматизация и контроль конвертерной плавки
- •6 12. Процессы с аргоно- и парокислородным дутьем
- •§ 13. Производство в конвертерах стали для литья
- •§ 1. Конструкция и работа мартеновской печи
- •1. Назначение и устройство отдельных элементов печи
- •§ 2. Тепловая работа и отопление мартеновских печей
- •6 3. Общая характеристика мартеновского процесса
- •1. Разновидности процесса
- •2. Особенности технологии мартеновской плавки
- •3. Шлакообразование и роль шлака в мартеновском процессе
- •§ 4. Основной мартеновский процесс и его разновидности
- •§ 5. Кислый мартеновский процесс
- •§ 7. Автоматизация работы мартеновской печи
- •§ 8. Тепловой и материальный балансы мартеновской плавки
- •Глава 4.Выплавка стали в электрических печах
- •§ 1. Устройство дуговых электропечей
- •1. Общее описание печи
- •2. Рабочее пространство печи
- •3. Рабочее пространство высокомощных водоохлаждаемых печей
- •4. Механическое оборудование печей
- •5. Электроды и механизмы для их зажима и перемещения
- •6. Электрооборудование дуговой печи
- •§ 2. Электрический режим
- •§ 3. Выплавка стали в основных дуговых электропечах
- •1. Шихтовые материалы электроплавки
- •2. Традиционная технология с восстановительным периодом
- •3. Выплавка стали методом переплава
- •5. Плавка в высокомощных водоохлаждаемых печах
- •6. Плавка с использованием металлизованных окатышей
- •7. Основные технические показатели
- •§ 4. Выплавка стали в кислых дуговых электропечах
- •§5. Электродуговые печи постоянного тока
- •§6. Работа электродуговых печвй и экология
- •§7. Выплавка стали в индукционных печах
- •1. Устройство индукционной печи повышенной частоты
- •2. Технология плавки
- •3. Плавка в вакуумных индукционных печах
- •Глава 5. Слитки и разливка стали
- •§1. Способы разливки стали. Разливка сифоном и сверху
- •§2. Кристаллизация и строение стальных слитков 1. Кристаллизация стали
- •2. Слиток спокойной стали
- •3. Слиток кипящей стали
- •4. Слиток полуспокойной стали
- •§ 3. Химическая неоднородность слитков
- •§ 6. Особенности разливки спокойной стали
- •1. Технология разливки
- •2. Защита металла в изложнице от окисления
- •3. Специальные методы теплоизоляции и обогрева верха слитка
- •17. Особенности разливки кипящей стали
- •§8. Дефекты стальных слитков
- •§1. Общая характеристика непрерывной разливки
- •1. Разновидности и преимущества способа
- •2. Основные типы унрс
- •3. Затвердевание непрерывно вытягиваемого слитка
- •§ 2. Устройство установок непрерывной разливки 1. Унрс с вытягиванием и скольжением слитка
- •2. Унрс без скольжения слитка в кристаллизаторе
- •3. Литейно-прокатные агрегаты
- •§ 4. Производительность унрс
- •§1. Общие условия
- •§ 2. Технологические основы внепечного рафинирования
- •§ 3. Современные способы вакуумирования
- •§4. Обработка металла вакуумом и кислородом
- •§5. Метод продувки инертными газами
- •§ 6. Аргонокислородная продувка
- •§7. Внепечная обработка и производство высокохромистых сталей и сплавов
- •§8. Обработка стали шлаками
- •§9. Введение реагентов в глубь металла
- •§ 10. Предотвращение вторичного окисления
- •§11. Методы отделения шлака от металла ("отсечки" шлака)
- •§ 12. Комбинированные (комплексные) методы внепечной обработки
- •§ 13. Внепбчная обработка стали
- •§ 14. Обработка стали в процессе кристаллизации
- •§ 15. Внепечная обработка стали и проблемы экологии
- •Глава 8. Комплексные технологии внепечной обработки чугуна и стали
- •§ 1. Внбдомбнная дбсульфурация чугуна
- •§ 2. Внедоменная дефосфорация чугуна
- •§ 3. Проведение обескремнивания и дефосфорации чугуна
- •§ 4. Совместное проведение операций десульфурации и дефосфорации
- •§ 5. Комплексные технологии внепечной обработки чугуна и стали
- •§ 1. Конструкции сталеплавильных агрегатов непрерывного действия (санд)
- •§ 2. Переплав металлолома
- •§ 3. Перспективы развития непрерывных процессов
- •§1. Вакуумный индукционный переплав
- •§2. Вакуумный дуговой переплав
- •§ 3. Элбктрошлаковый переплав
- •§ 4. Электронно-лучевой и плазменно-дуговой переплавы
- •§ 5. Перспективы развития переплавных процессов
- •Глава 2. Ферросплавная печь
- •§ 1. Восстановительные ферросплавные печи
- •§ 2. Рафинировочные ферросплавные печи
- •§3. Загрузка шихты в ферросплавные печи
- •Глава 5. Производство силикомарганца
- •Глава 6. Производство углеродистого феррохрома
- •Глава 7. Основы технологии производства
- •Глава 2. Металлургия меди
- •§ 1. Свойства меди и еб применение
- •§2. Сырье для получения меди
- •§ 3. Пирометаллургический способ производства меди
- •1. Подготовка медных руд к плавке
- •2. Плавка на штейн
- •3. Конвертирование медного штейна
- •4. Рафинирование меди
- •§ 1. Свойства никеля и его применение
- •§2. Сырье для получения никеля
- •§3. Получение никеля из окисленных руд
- •§4. Получение никеля
- •§1. Свойства алюминия и его применение
- •§2. Сырые материалы
- •§ 3. Производство глинозема
- •1. Способ Байера
- •2. Способ спекания
- •§ 4. Электролитическое получение алюминия
- •§ 5. Рафинирование алюминия
- •§1. Основы хлоридных методов производства металлов
- •§ 2. Производство магния
- •§ 3. Производство титана
- •§ 1. Правовые аспекты проблем охраны природы
- •Раздел X включает перечень задач, стоящих перед экологическим контролем.
- •§ 2. Основные направления охраны окружающей среды и рационального природопользования
- •§ 3. Охрана природы и металлургия.
- •§ 4. Защита воздушного бассейна
- •§ 5. Охрана водного бассейна
- •§ 6. Утилизация шлаков
- •§ 7. Использование шламов и выбросов
- •§ 8. Использование отходов смежных производств
- •§ 9. Использование вторичных энергоресурсов
- •§ 10. Использование металлургических агрегатов для переработки бытовых отходов
- •153008, Г. Иваново, ул. Типографская, 6.
§ 3. Производство титана
Титан отличается высокой механической прочностью, коррозионной стойкостью, жаропрочностью (t пл = 1660 °С) и малой плотностью (4,51 г/см3). Его применяют как конструкционный материал в самолетостроении, а также при постройке сосудов, предназначенных для транспортирования концентрированной азотной и разбавленной серной кислот.
Применяют также диоксид TiO2 для производства титановых белил и эмали.
Наиболее распространенным сырьем для получения титана и диоксида титана служит ильменитовый концентрат, выделяемый при обогащении титаномагнетитовых железных руд, в котором содержится, %: 40-60 TiO2, ~30FeO, ~20Fe2O3 и 5–7 пустой породы (CaO, MgO, A12O3, SiO2), причем титан в виде минерала ильменита FeO • TiO2.
Технологический процесс производства титана из ильме-нитового концентрата состоит из следующих основных стадий: получение титанового шлака восстановительной плавкой, получение тетрахлорида титана хлорированием титановых шлаков, получение титана (губки, порошка) восстановлением из тетрахлорида. Кроме того, зачастую проводят рафинирование полученного титана и иногда переплав для получения титана в виде слитков.
750
Восстановительная плавка ильменит ового концентрата имеет целью перевести TiO2 в шлак и отделить оксиды железа путем их восстановления. Плавку проводят в электродуговых печах. В печь загружают концентрат и восстановитель (кокс, антрацит), их нагревают до ~ 1650 °С. Основной реакцией является: FeO • TiO2 + С = Fe + TiO2 + CO. Из восстановленного и науглероживающегося железа образуется чугун, а оксид титана переходит в шлак, который содержит 82-90% TiO2 (титановый шлак).
получение тетрахлорида титана TiCl4 осуществляют воздействием газообразного хлора на оксид титана при температурах 700-900 °С, при этом протекает реакция: TiO2 + + 2С12 + 2С = TiCl4 + 2СО. Исходным титаносодержащим сырьем при этом является титановый шлак.
Хлорирование осуществляют в шахтных хлораторах непрерывного действия или в солевых хлораторах. Шахтный хлоратор – это футерованный цилиндр диаметром до 2 и высотой до 10 м, в который сверху загружают брикеты из измельченного титанового шлака и снизу вдувают газ магниевых электролизеров, содержащий 65–70 % С12. Взаимодействие TiO2 брикетов и хлора идет с выделением тепла, обеспечивающего необходимые для процесса температуры (~ 950 °С в зоне реагирования). Образующийся в хлораторе газообразный TiCl4 отводят через верх, остаток шлака от хлорирования непрерывно выгружают снизу.
Солевой хлоратор представляет собой футерованную шамотом камеру, наполовину заполненную отработанным электролитом магниевых электролизеров, содержащим хлориды калия, натрия, магния и кальция. Сверху в расплав загружают измельченные титановый шлак и кокс, а снизу вдувают хлор. Температура 800–850 °С, необходимая для интенсивного протекания хлорирования титанового шлака в расплаве, обеспечивается за счет тепла протекающих экзотермических реакций хлорирования. Газообразный TiCl4 из верха хлоратора отводят на очистку от примесей, отработанный электролит периодически заменяют. Основное преимущество солевых хлораторов состоит в том, что не требуется дорогостоящее брикетирование шихты. Отводимый из хлораторов газообразный TiCl4 содержит пыль и примеси газов – СО, СО2 и различные хлориды, поэтому его подвергают сложной, проводимой в несколько стадий очистке.
751
Металлотермическое восстановление титана из тетрахло-рида TiCl4 проводят магнием или натрием. Для восстановления магнием служат аппараты, представляющие собой (рис. 252) помещенную в печь герметичную реторту высотой 2–3 м из хромо-никелевой стали. После ввода в разогретую до ~ 750 °С реторту магния в нее подают тетрахлорид титана. Восстановление титана магнием TiCl4 + 2Mg = Ti + + 2MgCl2 идет с выделением тепла, поэтому электронагрев печи отключают и реторту обдувают воздухом, поддерживая температуру в пределах 800–900 °С; ее регулируют также скоростью подачи тетрахлорида титана. За один цикл восстановления длительностью 30–50 ч получают 1–4 т титана в виде губки (твердые частицы титана спекаются в пористую массу – губку). Жидкий MgCl2 из реторты периодически выпускают.
Титановая губка впитывает много MgCl2 и магния, поэтому после окончания цикла восстановления проводят вакуумную отгонку примесей. Реторту после нагрева до ~ 1000 °С и создания в ней вакуума выдерживают в течение 35–50 ч; за это время примеси испаряются. Иногда отгонку примесей
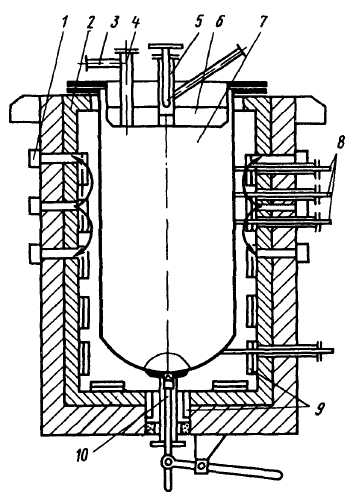
752
из губки проводят после ее извлечения из реторты. Восстановление натрием проводят в аппаратах, схожих с применяемыми для магниетермического восстановления. В реторте после подачи TiCl4 и жидкого натрия идет реакция восстановления титана: TiCl4 + 4Na = Ti + 4NaCl. Температура в 800–880 °С поддерживается за счет выделяющегося при восстановлении тепла.
Полученную твердую массу, содержащую 17 % Ti и 83 % NaCl извлекают из реактора, измельчают и выщелачивают из нее NaCl водой, получая титановый порошок.
Рафинирование титана. Для получения титана высокой чистоты применяют так называемый иодидный способ, при котором используется реакция Ti + 2I2 +=± Til4. При температуре 100–200 °С реакция протекает в направлении образования Til4, а при температуре 1300–1400 °С – в обратном направлении.
Титановую губку (порошок) загружают в специальную реторту, помещаемую в термостат, где температура должна быть на уровне 100–200 °С, и внутри нее спеиальным приспособлением разбивают ампулу с иодом. Через несколько натянутых в реторте титановых проволок пропускают ток, в результате чего они накаливаются до 1300–1400 °С. Пары иода реагируют с титаном губки по реакции Ti + + 212 –*• Til4. Полученный Til4 разлагается на раскаленной титановой проволоке, образуя кристаллы чистого титана и освобождая иод: Til4 –*■ Ti + 2I2. Пары иода вновь вступают во взаимодействие с рафинируемым титаном, а на проволоке постепенно наращивается слой кристаллизующегося чистого титана. Процесс заканчивают при толщине получаемого прутка титана 25–30 мм. Получаемый металл содержит 99,9–99,99 % Ti, в одном аппарате получают ~ 10 кг чистого титана в сутки.
Получение титановых слитков. Для получения ковкого титана в виде слитков губку переплавляют в вакуумной дуговой печи. Расходуемый (плавящийся) электрод получают прессованием губки и титановых отходов. Жидкий титан затвердевает в печи в водоохлаждаемом кристаллизаторе.
753
Ч а с т ь V. МЕТАЛЛУРГИЯ И ПРОБЛЕМЫ ОХРАНЫ ОКРУЖАЮЩЕЙ СРЕДЫ
Охрана окружающей среды (ООС) или "охрана природы" есть система естественно-научных, технико-производственных, экономических и административно-правовых мероприятий, осуществляемых в пределах данного государства или его части, а также в международном масштабе и направленных на сохранение и контролируемое изменение природы в интересах человечества, на поддержание и увеличение ее продуктивности, обеспечение рационального использования (включая восстановление) природных ресурсов и окружающей среды.
Решая те или иные технологические проблемы, организуя то или иное производство, мы принимаем в расчет расходы не только на освоение природы, но и на охрану и восстановление экосферы, учитываем не только показатели прибыльности и производительности, но и экологической обоснованности технических нововведений, экологического контроля над планированием промышленности и природопользования.
Развитие человеческого общества происходило и происходит в постоянном взаимодействии с природой. Влияние человека на природу, окружающую среду неизбежно, оно усиливается по мере развития производительных сил и увеличения массы веществ, вовлекаемых в хозяйственный оборот. В настоящее время воздействие человека на природу приобретает такие масштабы, что в отдельных регионах возможны нарушения существующего в природе относительного равновесия, причем эти нарушения могут стать необратимыми.
Основные виды нежелательного воздействия человека на окружающую среду: загрязнение атмосферы, загрязнение гидросферы, загрязнение земной поверхности, истощение природных ресурсов (нерациональное использование полезных ископаемых, забор огромного количества пресной воды, отчуждение или приведение в негодность для сельскохозяйственного использования больших площадей, занятых промышленным строительством, территорий, используемых под шлаковые отвалы, терриконы, и т.п., вырубка лесов и т.д.).
754
