
- •Общее описание печи 406
- •Часть 1.Производство чугуна и железа
- •Глава 1.Сырые материалы и их подготовка
- •§1. Железные руды
- •§2. Основные месторождения железных руд
- •§3. Марганцевые руды
- •§4. Флюсы и отходы производства
- •§5. Подготовка железных руд к доменной плавке
- •§6. Топливо
- •Глава 2. Конструкция доменной печи
- •§1. Общее описание печи
- •§2. Профиль печи и основные размеры
- •§3. Фундамент, кожух и холодильники
- •§4. Футеровка печи
- •§6. Колошниковое устройство
- •Глава 3. Доменный процесс
- •§1. Загрузка шихты и распределение материалов на колошнике
- •§2. Распределение температур, удаление влаги и разложение карбонатов
- •§3. Процессы восстановления
- •1. Восстановление железа
- •2. Восстановление марганца и выплавка марганцовистых чугунов
- •3. Восстановление кремния и выплавка кремнистых чугунов
- •4. Восстановление фосфора
- •5. Восстановление других элементов
- •§4. Образование чугуна
- •§5. Эбразование шлака и его свойства
- •§6. Поведение серы
- •§ 7. Дутье, процессы в горне и движение газов в печи
- •1. Дутье
- •2. Процессы в горне
- •3. Движение газов в печи и изменение их температуры, состава, количества и давления
- •§8. Интенсификация доменного прцесса
- •1. Нагрев дутья
- •2. Увлажнение дутья
- •3. Повышенное давление газа
- •4. Обогащение дутья кислородом
- •5. Вдувание в горн углеродсодержащих веществ
- •6. Комбинированное дутье
- •§ 9. Продукты доменной плавки
- •§ 10. Управление процессом, контроль, автоматизапще
- •§ 11. Организация ремонтов, задувка и выдувка печи
- •Глава 4. Оборудование и работа обслуживающих доменную печь участков
- •§ 1. Подача шихты в доменную печь
- •§ 2. Воздухонагреватели и нагрев дутья
- •§ 3. Очистка доменного газа
- •§ 4. Выпуск и уборка чугуна
- •§ 5. Выпуск и уборка шлака
- •Глава 5.Показатели работы доменных печей
- •§ 1. Материальный и тепловой балансы плавки
- •§ 2. Расход кокса
- •§ 3. Основные технические показатели
- •§ 1. Актуальность проблемы
- •§ 2. Процессы твердофазного восстановления железа
- •§ 3. Процессы жидкофазного восстановления (пжв)
- •§ 4. Решение проблем охраны природы и охраны труда
- •§ 1. История развития сталеплавильного производства
- •§ 2. Классификация стали
- •§ 3. Основные реакции и процессы сталеплавильного производства
- •1. Термодинамика сталеплавильных процессов
- •2. Кинетика сталеплавильных процессов
- •3. Сталеплавильные шлаки
- •4. Основные реакции сталеплавильных процессов
- •6. Неметаллические включения
- •7. Раскисление и легирование стали
- •§ 4. Шихтовые материалы сталеплавильного производства
- •§ 1. Разновидности конвертерных процессов
- •1. Конвертерные процессы с донным воздушным дутьем
- •2. Кислородно-конвертерные процессы
- •§ 2. Устройство кислородных конвертеров для верхней продувки
- •§ 3. Шихтовые материалы кислородно-конвертерного процесса
- •§ 4. Плавка в кислородном конвертере с верхней продувкой
- •1. Технология плавки
- •2. Режим дутья
- •3. Поведение составляющих чугуна при продувке
- •4. Шлаковый режим
- •5. Раскисление и легирование
- •6. Тепловой режим
- •7. Потери металла при продувке
- •8. Основные технические показатели
- •§ 5. Конвертерные процессы с донной продувкой кислородом
- •§ 6. Конвертерные процессы с комбинированной продувкой
- •6 7. Плавка с увеличенным расходом лома
- •§ 8. Передел высокофосфористых чугунов
- •§ 9. Передел пригодно легированных чугунов
- •§ 10. Экология, очистка конвертерных газов
- •§ 11. Автоматизация и контроль конвертерной плавки
- •6 12. Процессы с аргоно- и парокислородным дутьем
- •§ 13. Производство в конвертерах стали для литья
- •§ 1. Конструкция и работа мартеновской печи
- •1. Назначение и устройство отдельных элементов печи
- •§ 2. Тепловая работа и отопление мартеновских печей
- •6 3. Общая характеристика мартеновского процесса
- •1. Разновидности процесса
- •2. Особенности технологии мартеновской плавки
- •3. Шлакообразование и роль шлака в мартеновском процессе
- •§ 4. Основной мартеновский процесс и его разновидности
- •§ 5. Кислый мартеновский процесс
- •§ 7. Автоматизация работы мартеновской печи
- •§ 8. Тепловой и материальный балансы мартеновской плавки
- •Глава 4.Выплавка стали в электрических печах
- •§ 1. Устройство дуговых электропечей
- •1. Общее описание печи
- •2. Рабочее пространство печи
- •3. Рабочее пространство высокомощных водоохлаждаемых печей
- •4. Механическое оборудование печей
- •5. Электроды и механизмы для их зажима и перемещения
- •6. Электрооборудование дуговой печи
- •§ 2. Электрический режим
- •§ 3. Выплавка стали в основных дуговых электропечах
- •1. Шихтовые материалы электроплавки
- •2. Традиционная технология с восстановительным периодом
- •3. Выплавка стали методом переплава
- •5. Плавка в высокомощных водоохлаждаемых печах
- •6. Плавка с использованием металлизованных окатышей
- •7. Основные технические показатели
- •§ 4. Выплавка стали в кислых дуговых электропечах
- •§5. Электродуговые печи постоянного тока
- •§6. Работа электродуговых печвй и экология
- •§7. Выплавка стали в индукционных печах
- •1. Устройство индукционной печи повышенной частоты
- •2. Технология плавки
- •3. Плавка в вакуумных индукционных печах
- •Глава 5. Слитки и разливка стали
- •§1. Способы разливки стали. Разливка сифоном и сверху
- •§2. Кристаллизация и строение стальных слитков 1. Кристаллизация стали
- •2. Слиток спокойной стали
- •3. Слиток кипящей стали
- •4. Слиток полуспокойной стали
- •§ 3. Химическая неоднородность слитков
- •§ 6. Особенности разливки спокойной стали
- •1. Технология разливки
- •2. Защита металла в изложнице от окисления
- •3. Специальные методы теплоизоляции и обогрева верха слитка
- •17. Особенности разливки кипящей стали
- •§8. Дефекты стальных слитков
- •§1. Общая характеристика непрерывной разливки
- •1. Разновидности и преимущества способа
- •2. Основные типы унрс
- •3. Затвердевание непрерывно вытягиваемого слитка
- •§ 2. Устройство установок непрерывной разливки 1. Унрс с вытягиванием и скольжением слитка
- •2. Унрс без скольжения слитка в кристаллизаторе
- •3. Литейно-прокатные агрегаты
- •§ 4. Производительность унрс
- •§1. Общие условия
- •§ 2. Технологические основы внепечного рафинирования
- •§ 3. Современные способы вакуумирования
- •§4. Обработка металла вакуумом и кислородом
- •§5. Метод продувки инертными газами
- •§ 6. Аргонокислородная продувка
- •§7. Внепечная обработка и производство высокохромистых сталей и сплавов
- •§8. Обработка стали шлаками
- •§9. Введение реагентов в глубь металла
- •§ 10. Предотвращение вторичного окисления
- •§11. Методы отделения шлака от металла ("отсечки" шлака)
- •§ 12. Комбинированные (комплексные) методы внепечной обработки
- •§ 13. Внепбчная обработка стали
- •§ 14. Обработка стали в процессе кристаллизации
- •§ 15. Внепечная обработка стали и проблемы экологии
- •Глава 8. Комплексные технологии внепечной обработки чугуна и стали
- •§ 1. Внбдомбнная дбсульфурация чугуна
- •§ 2. Внедоменная дефосфорация чугуна
- •§ 3. Проведение обескремнивания и дефосфорации чугуна
- •§ 4. Совместное проведение операций десульфурации и дефосфорации
- •§ 5. Комплексные технологии внепечной обработки чугуна и стали
- •§ 1. Конструкции сталеплавильных агрегатов непрерывного действия (санд)
- •§ 2. Переплав металлолома
- •§ 3. Перспективы развития непрерывных процессов
- •§1. Вакуумный индукционный переплав
- •§2. Вакуумный дуговой переплав
- •§ 3. Элбктрошлаковый переплав
- •§ 4. Электронно-лучевой и плазменно-дуговой переплавы
- •§ 5. Перспективы развития переплавных процессов
- •Глава 2. Ферросплавная печь
- •§ 1. Восстановительные ферросплавные печи
- •§ 2. Рафинировочные ферросплавные печи
- •§3. Загрузка шихты в ферросплавные печи
- •Глава 5. Производство силикомарганца
- •Глава 6. Производство углеродистого феррохрома
- •Глава 7. Основы технологии производства
- •Глава 2. Металлургия меди
- •§ 1. Свойства меди и еб применение
- •§2. Сырье для получения меди
- •§ 3. Пирометаллургический способ производства меди
- •1. Подготовка медных руд к плавке
- •2. Плавка на штейн
- •3. Конвертирование медного штейна
- •4. Рафинирование меди
- •§ 1. Свойства никеля и его применение
- •§2. Сырье для получения никеля
- •§3. Получение никеля из окисленных руд
- •§4. Получение никеля
- •§1. Свойства алюминия и его применение
- •§2. Сырые материалы
- •§ 3. Производство глинозема
- •1. Способ Байера
- •2. Способ спекания
- •§ 4. Электролитическое получение алюминия
- •§ 5. Рафинирование алюминия
- •§1. Основы хлоридных методов производства металлов
- •§ 2. Производство магния
- •§ 3. Производство титана
- •§ 1. Правовые аспекты проблем охраны природы
- •Раздел X включает перечень задач, стоящих перед экологическим контролем.
- •§ 2. Основные направления охраны окружающей среды и рационального природопользования
- •§ 3. Охрана природы и металлургия.
- •§ 4. Защита воздушного бассейна
- •§ 5. Охрана водного бассейна
- •§ 6. Утилизация шлаков
- •§ 7. Использование шламов и выбросов
- •§ 8. Использование отходов смежных производств
- •§ 9. Использование вторичных энергоресурсов
- •§ 10. Использование металлургических агрегатов для переработки бытовых отходов
- •153008, Г. Иваново, ул. Типографская, 6.
§3. Процессы восстановления
1. Восстановление железа
Железо поступает в доменную печь в виде оксидов: агломерат вносит Fe3O4 и немного Fe2O3 и FeO, окатыши– Fe2O3 и Fe3O4 и железная руда, если ее применяют,- Fe2O3 и Fe3O4, причем часть этих оксидов находится в виде химических соединений с другими оксидами.
Основная задача доменного процесса – обеспечение как можно более полного извлечения железа из этих оксидов путем их восстановления. Восстановление заключается в отнятии кислорода от оксида и получении из него элемента (или же оксида с меньшим содержанием кислорода). Его осуществляют с помощью восстановителя– вещества, к которому переходит кислород благодаря тому, что у восстановителя большее химическое сродство к кислороду, чем у восстанавливаемого элемента. Таким образом в процессе восстановления одно вещество теряет кислород (восстаналивается), а другое приобретает его (окисляется). В общем виде процесс восстановления описывается уравнением:
МО + В = М + ВО,
где М– восстанавливаемый металл; В– восстановитель; МО- восстанавливаемый оксид; ВО- оксид восстановителя.
В соответствии с выявленными акад. А.А.Байковым закономерностями восстановление оксидов железа протекает ступенчато от высших к низшим:
Fe2O3 –*» Fe3O4 –*• FeO –*- Fe.
Поскольку при температурах ниже 570 °С оксид FeO неустойчив и разлагается (на Fe3O4 и Fe), схема восстановления при температурах ниже 570 °С следующая:
Fe2O3 –> Fe3O4 –•• Fe.
Восстановителями оксидов железа в доменной печи служат углерод, оксид СО и водород. Восстановление углеродом принято называть прямым восстановлением, а газами– косвенным. Реакции косвенного восстановления оксидом углерода следующие:
при температуре > 570 °С 94
l)3Fe2O3 + CO = 2Fe3O4 + CO2 + 53 740; 2)Fe3O4 + CO = 3FeO + CO2 - 36 680; 3)FeO + CO = Fe + CO2 + 16 060; при температуре < 570 °C
l)3Fe2O3 + CO = 2Fe3O4 + CO2 + 53 740;
4)l/4Fe3O4 + CO = 3/4Fe + CO2 + 2870.
Их характерной особенностью является то, что продуктом реакций всегда является СО2, и то, что они идут без затрат тепла. Реакции прямого восстановления углеродом протекают с образованием СО и требуют значительных затрат тепла, например:
5)FeO + C = Fe + CO - 152670.
Необходимо отметить, что приведенная запись реакции прямого восстановления не отражает механизма ее протекания. Дело в том, что непосредственное взаимодействие углерода с твердыми оксидами ограничено, так как поверхность контакта между неровными кусками очень мала. Поэтому фактически прямое восстановление протекает через газовую фазу и состоит из двух стадий:
FeO + СО = Fe + СО2, СО2 + С = 2СО,
что после суммирования дает итоговую реакцию прямого восстановления
FeO + С = Fe + CO.
Таким образом главное, что отличает прямое восстановление от косвенного, это расходование углерода, а это означает, что с развитием реакций прямого восстановления сокращается количество углерода, достигающего фурм.
Условия протекания реакций косвенного восстановления (/)–(4) и восстановительную способность газовой смеси из СО и СО2 характеризуют данные рис.36. Здесь кривые 1-4, соответствуя номерам приведенных выше реакций косвенного восстановления, характеризуют равновесный состав газа этих реакций и ограничивают поля, внутри которых будет
95
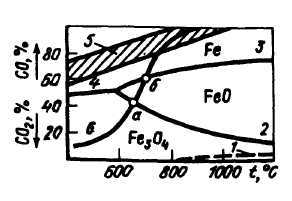
устойчивым железо или один из его оксидов в атмосфере из СО и СО2. Например, при температурах и содержаниях СО и СО2, ограниченных кривыми 3-2 (полем FeO), устойчивым является лишь FeO; железо при этих условиях будет окисляться до FeO, реагируя с СО2, а оксиды Fe2O3 и Fe3O4 будут восстанавливаться, реагируя с СО.
Можно видеть, что кривая равновесного состава газа реакции (1) сильно приближена к оси абсцисс, т.е. даже небольших концентраций СО достаточно для восстановления оксида Fe2O3 до Fe3O4. Железо может быть получено лишь при содержаниях СО больших, чем отмечено кривыми 4 и 3.
При анализе возможности восстановления оксидов железа необходимо учитывать, что состав (равновесный) газа в системе, состоящей из СО и СО2) при наличии в ней избытка углерода будет определяться равновесием обратимой реакции
6)СО2 + С = 2СО.
Этот равновесный состав (при давлении 0,1 МПа) характеризует кривая 6. Поэтому в условиях равновесия железо, например, может быть получено лишь при температурах более высоких, чем отмечено точкой б, a FeO – точкой а.
Фактический состав газа в доменной печи показан заштрихованной областью 5 на рис. 36. Видно, что реальное содержание СО при низких (менее 850-1000 °С) температурах выше равновесного, определяемого реакцией (6). Объясняется это тем, что за короткое время пребывания газов в печи (3–12 с) реакция (6) не успевает дойти до равновесия. Реальное содержание СО обеспечивает, как это видно из рис. 36, возможность восстановления косвенным путем всех оксидов до железа при температурах 400 °С и ниже, т.е. даже в районе колошника.
Из данных рис. 36 вытекает, что в доменной печи, где имеется избыток углерода, реакции косвенного восстановле-
96
ния, протекающие с образованием СО2, могут идти лишь при температурах ниже 900-1000 °С, поскольку при более высоких температурах СО2 существовать не может, переходя в СО по реакции (6). Соответственно, доменную печь условно делят на зону косвенного восстановления (зона с температурами < 900-1000 °С) и зону, где может протекать лишь прямое восстановление (зона прямого восстановления с температурами выше 900-1000 °С).
Косвенное восстановление водородом, содержание которого в атмосфере доменной печи может достигать 8–12 %, протекает по следующим реакциям:
3Fe2O3 + Н2 = 2Fe3O4 + Н2О - 4200; Fe3O4 + Н2 = 3FeO + Н2О - 62410; FeO + Н2 = Fe + Н2О - 27800.
Сравнение равновесных характеристик этих реакций и реакций восстановления оксидом углерода показывает, что при температурах выше 810 °С водород является более сильным восстановителем, чем СО, а при меньших, чем 810 °С, температурах – более слабым, т.е. при этих температурах у водорода меньше химическое сродство к кислороду, чем у СО. Вместе с тем опыт, показал, что в доменной печи как при высоких (> 810 °С), так и при более низких температурах водород является более энергичным восстановителем, чем СО. Добавка водорода и повышение его концентрации в газовой фазе ведет к ускорению процесса восстановления и увеличению степени косвенного восстановления железа. Это объясняется двумя причинами. Во-первых, благодаря малым массе и размерам молекул водорода они более подвижны, чем СО, быстрее диффундируют в поры агломерата и проникают в более мелкие поры и трещины, куда молекулы СО проникнуть не могут, – все это заметно увеличивает поверхность взаимодействия. Во-вторых, известно, что молекулы Н2 многократно участвуют в процессе восстановления. Эта особенность водорода как восстановителя связана с тем, что при температурах доменного процесса и наличии избытка углерода и СО водяные пары существовать в печи не могут. В зоне высоких температур (850-1000 °С и более) пары Н2О разлагаются углеродом: Н2О + С = Н2 + СО; при температурах ниже 810°С идет реакция: Н2О + СО = Н2 +
7-4050
+ СО2. Соответственно Н2О, образующаяся при реакциях восстановления водородом, тут же взаимодействует с углеродом кокса, либо с СО по приведенным выше реакциям и вновь переходит в водород. Этот образовавшийся водород вновь реагирует с оксидами железа и так несколько раз по мере подъема от горна до колошника. Иначе говоря, происходит регенерация водорода с его повторным участием в восстановлении. Сам же водород в процессе восстановления является как бы промежуточным реагентом или переносчиком кислорода от оксидов железа к СО или углероду и в конечном счете к газовой фазе печи. При этом количество водорода в газовой фазе может не изменяться.
В целом ход процесса восстановления железа в доменной печи можно охарактеризовать следующим образом. Во всем объеме печи, начиная от верха колошника до участков с температурой 900–1000 °С, протекают процессы косвенного восстановления газом СО и отчасти водородом. В этой зоне косвенного восстановления все высшие оксиды железа успевают восстановиться до FeO, а часть FeO восстанавливается до железа, причем частицы восстановленного железа обнаруживаются уже в колошнике. Вместе с тем| часть FeO восстанавливается до железа прямым путем в зоне высоких температур (> 900–1000 °С). При этом в зонах с температурами свыше 1100–1250 °С, когда сформировался шлак, железо восстанавливается прямым путем из жидкого шлака при стекании его капель вниз между кусками кокса. Железо при восстановлении получается в твердом виде; частицы железа, восстановившиеся из материалов, находящихся в твердом виде, имеют форму губки.
В доменной печи железо восстанавливается почти полностью. Степень восстановления железа т\ составляет 0,99–0,998, а это означает, что 99–99,8 % железа переходит в чугун и лишь 0,2–1,0% переходит в шлак.
Особенности прямого и косвенного восстановления. Доменный процесс стараются вести так, чтобы обеспечивался минимальный расход дефицитного и дорогостоящего кокса. Наряду с рядом других факторов большое влияние на расход кокса оказывает степень развития прямого и косвенного восстановления. Сравнивая эти способы восстановления, отмечают следующее. Отрицательной стороной прямого восстановления является то, что оно протекает с затратой тепла;
98
кроме того увеличение степени прямого восстановления приводит к снижению количества кокса, достигающего фурм и, следовательно, к уменьшению прихода тепла в горне. Реакции косвенного восстановления не требуют затрат тепла. Однако косвенное восстановление требует значительно большего расхода углерода, чем прямое. Причина в том, что для протекания реакций косвенного восстановления необходимо определенное соотношение между СО и СО2 в газовой фазе. Например, при 700 °С восстановление железа из FeO может начаться (рис. 36), если газ содержит около 60 % СО и 40 % СО2, т.е. при СО/СО2 = 1,5. Следовательно, на один атом железа необходимо 2,5 атома углерода (1,5 в виде СО и 1 в виде СО2), полученных в результате сжигания кокса, в то время как по реакции прямого восстановления FeO+C = Fe+CO на один атом железа расходуется один атом углерода, вносимого коксом.
Должно существовать оптимальное с точки зрения расхода углерода соотношение между прямым и косвенным восстановлением. Для оценки доли прямого или косвенного восстановления используют ряд показателей. Предложенный акад. М.А.Павловым показатель– степень прямого восстановления обозначается величиной rd и показывает часть железа в процентах или долях единицы, восстановленного из FeO прямым путем. При этом, если прямым путем восстанавливается d % Fe, то косвенным восстанавливается (100 – d) %.
В настоящее время степень прямого восстановления на печах, работающих без применения природного газа или мазута, составляет 40–60 %, а на печах, в которых применяют углеводородные добавки, - 20-40%. Наивыгоднейшая степень прямого восстановления, при которой достигается минимальный расход кокса, меньше приведенных величин. Фактические значения rd обычно выше оптимальных, и поэтому необходимо принимать все меры для улучшения условий восстановления шихты газами, т.е. для повышения степени косвенного восстановления (вдувание восстановительных газов, улучшение распределения газов в печи, подготовка шихты), что обеспечит снижение расхода кокса.
Степень прямого восстановления железа получается ниже у печей, работающих с пониженной температурой дутья и на более бедной шихте. Однако эти факторы приводят к повышению расхода кокса.
99
