
- •Рекомендуемая литература
- •Качественные реакции обнаружения катионов.
- •Рекомендуемая литература
- •Определение растворимости лекарственных веществ
- •2. Определение температуры плавления лекарственных веществ
- •Методика определения.
- •3. Определение кислотности или щелочности растворов лекарственных препаратов
- •4. Определение рН раствора лекарственного препарата колориметрическим методом
- •Рекомендуемая литература
- •Натрия гидрокарбонат
- •Натрия сульфат
- •Тема: определение качества воды очищенной, воды для инъекций, кислорода, перекисных соединений Вопросы для самоконтроля
- •Рекомендуемая литература
- •Раствор водорода перекиси
- •Магния перекись
- •Таблетки гидроперита
- •Вода очищенная (фс)
- •Вода для инъекций (фс).
- •Образец оформления протокола анализа качества неорганического лекарственного средства.
- •Тема: определение качества натрия тиосульфата, натрия нитрита, натрия гидрокарбоната, лития карбоната. Вопросы для самоконтроля
- •Рекомендуемая литература
- •Натрия тиосульфат
- •Натрия гидрокарбонат
- •Натрия нитрит
- •Лития карбонат
- •Тема: определение качества лекарственных средств из группы производных галогенов Вопросы для самоконтроля
- •Рекомендуемая литература
- •Натрия иодид
- •Калия иодид
- •Натрия фторид
- •Определение качества лекарственных средств группы соединений кальция, магния, бария, цинка Вопросы для самоконтроля
- •Рекомендуемая литература
- •Раствор кальция хлорида
- •Магния оксид
- •Магния сульфат
- •Цинка оксид
- •Цинка сульфат
- •Бария сульфат для рентгеноскопии
- •Тема: определение качества лекарственных средств из группы соединений бора, висмута, алюминия, железа, меди и серебра Вопросы для самоконтроля
- •Рекомендуемая литература
- •Кислота борная
- •Натрия тетраборат
- •Висмута нитрат основной
- •Алюминия гидроксид
- •Алюминия фосфат
- •Железа сульфат
- •Серебра нитрат
- •Меди сульфат
- •Тема: функциональный анализ органических лекарственных веществ Блок информации
- •Идентификация спиртового гидроксила
- •Реакции окисления (индофеноловая проба)
- •Реакции конденсации с альдегидами
- •Сочетание с солями диазония
- •Реакции замещения (с бромной водой и азотной кислотой)
- •Идентификация кето-группы
- •Идентификация гидроксиацетильной группы
- •Идентификация карбоксильной группы
- •Идентификациясложноэфирнойгруппы
- •Реакция кислотного или щелочного гидролиза
- •Гидроксамовая проба
- •Идентификация простой эфирной группы
- •Идентификация первичной ароматической аминогруппы
- •Реакция образования азокрасителя
- •Реакции окисления
- •Реакции конденсации с альдегидами
- •Идентификация первичной алифатической аминогруппы
- •Идентификация вторичной аминогруппы
- •Идентификация третичной аминогруппы
- •Идентификация амиднои и n-замещенной амидной группы
- •Идентификация гидразидной группы
- •Идентификация ароматической нитрогруппы
- •Идентификация сульфгидрильной группы
- •Идентификация сульфамидной группы
- •Реакция образования солей с тяжелыми металлами
- •Реакция минерализации
- •Идентификация соединений, содержащих двойную связь
- •Тема: определение качества лекарственных средств из группы спиртов, альдегидов, их производных и углеводов Вопросы для самоконтроля
- •Рекомендуемая литература
- •Раствор формальдегида
- •Гексаметилентетрамин
- •Хлоралгидрат
- •Спирт этиловый (гф х)
- •Глюкоза
- •Сахароза
- •Лактоза
- •Галактоза
- •Крахмал
- •Образец оформления протокола анализа качества органического лекарственного средства.
- •Тема: определение качества лекарственных средств из группы карбоновых кислот Вопросы для самоконтроля
- •Рекомендуемая литература
- •Калия ацетат
- •Кальция лактат
- •Кальция глюконат
- •Натрия цитрат для инъекций
- •Натрия вальпроат
- •Тема: определение качества лекарственных средств производных лактонов ненасыщенных полигидроксикислот, статинов, кислоты дитиокарбаминовой и аминокислот Вопросы для самоконтроля
- •Рекомендуемая литература
- •Кислота аскорбиновая
- •Таблетки «тетурам»
- •Кислота глутаминовая
- •Кислота аминомасляная (аминалон)
- •Цистеин
- •Ацетилцистеин
- •Метионин
- •Пеницилламин
- •Раствор тетацина-калыция (натрия кальция эдетата) 10% для инъекций
- •Кислота аминокапроновая
- •Каптоприл
- •Образец оформления протокола анализа качества лекарственной формы.
- •Определение качества лекарственных средств из группы бета-лактамидов: пенициллинов, цефалоспоринов, ингибиторов бета-лактамаз Вопросы для самоконтроля
- •Рекомендуемая литература
- •Общие реакции определения подлинности лекарственных средств из группы бета-лактамидов
- •1. Гидроксамовая реакция
- •2. Образование комплексных солей
- •3. Взаимодействие с реактивом Марки
- •4. Реакция обнаружения серы
- •Ампициллина тригидрат
- •Тема: определение качества лекарственных средств группы терпенов Вопросы для самоконтроля:
- •Рекомендуемая литература:
- •Терпингидрат
- •Валидол
- •Камфора
- •Бромкамфора
- •Масляный раствор ретинола ацетата (3,44%; 6,88%; 8,60%)
- •Раствор сульфокамфокаина 10% для инъекций
- •Тема: определение качества лекарственных средств,
- •Производных циклопентанопергидрофенантрена:
- •Витаминов группы d, карденолидов, аминостероидных миорелаксантов.
- •Вопросы для самоконтроля.
- •Рекомендуемая литература:
- •Масляный раствор эргокальциферола
- •Строфантин к
- •Таблетки дигитоксина
- •Таблетки дигоксина.
- •Раствор коргликона 0,06% для инъекций
- •Тема: определение качества лекарственных средств из группы кортикостероидов. Вопросы для самоконтроля
- •Рекомендуемая литература
- •Таблетки дезоксикортикостерона ацетата
- •Раствор дезоксикортикостерона ацетата в масле для инъекций
- •Таблетки кортизона ацетата
- •Таблетки преднизолона
- •Мазь флуоцинолона ацетонида
- •Тема: определение качества лекарственных средств из группы производных циклопентанопергидрофенантрена: андрогенов и анаболиков; антиандрогенов. Вопросы для самоконтроля
- •Рекомендуемая литература
- •Раствор тестостерона пропионата в масле
- •Таблетки метилтестостерона
- •Таблетки метиландростендиола
- •Таблетки метандростенолона
- •Раствор нандролона деканоата (ретаболила) для инъекций или раствор нандролона фенилпропионата (феноболина) для инъекций.
- •Таблетки ципротерона ацетата (андрокур) по 0,05 г.
- •Тема: определение качества лекарственных средств,
- •Производных циклопентанопергидрофенантрена:
- •Эстрогенов и гестагенов, антиэстрогенов.
- •Вопросы для самоконтроля
- •Рекомендуемая литература
- •Эстрадиола гемигидрат
- •Таблетки этинилэстрадиола
- •Идентификация эстрогенов методом тсх
- •Прогестерон
- •Раствор прогестерона для инъекций.
- •Суспензия медроксипрогестерона ацетата для инъекций (депо-провера)
- •Таблетки тамоксифена цитрата
- •Тема: определение качества лекарственных средств из группы производных фенола. Вопросы для самоконтроля
- •Рекомендуемая литература.
- •Резорцин
- •Таблетки синэстрола
- •Таблетки диэтилстильбэстрола
- •Тема: определение качества лекарственных средств из группы производных хинонов и тетрациклинов Вопросы для самоконтроля
- •Рекомендуемая литература
- •Раствор витамина к, для инъекций. (раствор фитоменадиона для инъекций)
- •Таблетки витамина к (фитоменадиона)
- •Раствор викасола 1% для инъекций
- •Таблетки викасола (по 0,015 г)
- •Таблетки тетрациклина или тетрациклина гидрохлорида
- •Таблетки окситетрациклина или окситетрациклина гидрохлорида
- •Таблетки или капсулы доксициклина гидрохлорида
- •Таблетки или капсулы метациклина гидрохлорида
- •Тема: определение качества лекарственных средств из группы производных пара- и мета-аминофенола, диалкиламиноацетанилида, ароматических кислот и их солей Вопросы для самоконтроля
- •Рекомендуемая литература
- •Парацетамол
- •Таблетки парацетамола
- •Прозерин (неостигмина метилсульфат)
- •Раствор прозерина 0,05% для инъекций
- •Раствор лидокаина гидрохлорида (ксикаина) для инъекций
- •Кислота бензойная
- •Кислота салициловая
- •Натрия бензоат
- •Натрия салицилат
- •Тема: определение качества лекарственных средств, производных салициловой, фенилуксусной, фенилпропионовой кислот и бутирофенона. Вопросы для самоконтроля.
- •Рекомендуемая литература
- •Оксафенамид
- •Таблетки оксафенамида
- •Кислота ацетилсалициловая
- •Таблетки кислоты ацетилсалициловой
- •Натрия пара-аминосалицилат
- •Ибупрофен
- •Таблетки ибупрофена
- •Диклофенак-натрий
- •Галоперидол
- •Раствор галоперидола для инъекций
- •Тема: определение качества лекарственных средств, производных пара-аминобензойной кислоты и близких по структуре местных анестетиков. Вопросы для самоконтроля.
- •Рекомендуемая литература
- •Бупивакаина гидрохлорид
- •Раствор бупивакаина гидрохлорида для инъекций
- •Анестезин
- •Новокаин
- •Раствор новокаина для инъекций
- •Новокаинамид
- •Метоклопрамида гидрохлорид
- •Раствор метоклопрамида для инъекций
- •Таблетки метоклопрамида
- •Раствор артикаина гидрохлоридл для инъекций
- •Тема: определение качества лекарственных средств из группы арилалкиламинов гидроксифенилалкиламинов и их производных. (занятие 1) Вопросы для самоконтроля
- •Рекомендуемая литература
- •Допамина гидрохлорид
- •Раствор адреналина гидрохлорида 0,1 % или адреналина гидротартрата 0,18% для инъекций
- •Раствор норадреналина гидротартрата 0,2% для инъекций
- •Раствор изопреналина гидрохлорида (изадрина) для инъекций
- •Фенотерола гидробромид
- •Аэрозоль сальбутамола
- •Таблетки верапамила гидрохлорида.
- •Таблетки леводопы
- •Таблетки метилдопы
- •Тема: определение качества лекарственных средств из группы арилалкиламинов, гидроксифенилалкиламинов и их производных. (занятие 2). Вопросы для самоконтроля
- •Рекомендуемая литература
- •Эфедрина гидрохлорид
- •Таблетки эфедрина гидрохлорида
- •Таблетки анаприлина
- •Таблетки атенолола
- •Таблетки тимолола
- •Левомицетин
- •Таблетки левомицетина стеарата
- •Левомицетина сукцинат растворимый
- •Таблетки бромгексина
- •Таблетки амброксола
- •Рекомендуемая литература
- •Общие реакции идентификации сульфаниламидных препаратов
- •Частные реакции идентификаци сульфаниламидных препаратов
- •Раствор сульфацила-натрия 10%, 20% или 30%
- •Таблетки «ко-тримоксазол»
- •Таблетки фуросемида
- •Таблетки дихлотиазида
- •Таблетки карбутамида
- •Таблетки глибенкламида
- •Таблетки метформина
- •Тема: анализ лекарственных средств производных фурана производные 5-нитрофурана Вопросы для самоконтроля
- •Рекомендуемая литература
- •Гризеофульвин
- •Амиодарон
- •Тема: анализ лекарственных средств, производных бензопирана и индана Вопросы для самоконтроля
- •Рекомендуемая литература
- •Токоферола ацетат
- •Таблетки неодикумарина
- •Фенилин
- •Тема: анализ лекарственных средств, производных бензопирана и тиофена Вопросы для самоконтроля
- •Рекомендуемая литература
- •Рутин, кверцетин
- •Дигидрокверцетин
- •Кромолин натрия (интал)
- •Тема: анализ лекарственных средств, производных пиррола Вопросы для самоконтроля
- •Рекомендуемая литература
- •Пирацетам
- •Линкомицин и клиндамицин
- •Тема: анализ лекарственных средств, производных индола Вопросы для самоконтроля
- •Рекомендуемая литература
- •Резерпин
- •Индометацин
- •Таблетки индометацина по 0,025 г
- •Таблетки винпоцетина по 0,005 г
- •Арбидол
- •Тема: анализ лекарственных средств, производных пиразола, тиазола и 1,2,4-триазола Вопросы для самоконтроля
- •Рекомендуемая литература
- •Антипирин
- •Анальгин
- •Бутадион
- •Пропифеназон
- •Тема: анализ лекарственных средств, производных имидазола (1) Вопросы для самоконтроля
- •Рекомендуемая литература
- •Пилокарпина гидрохлорид
- •Метронидазол
- •Тема: анализ лекарственных средств, производных имидазола (2) Вопросы для самоконтроля
- •Рекомендуемая литература
- •Дибазол
- •Нафтизин
- •Ксилометазолин (галазолин)
- •Дибазол (таблетки по 0,02 г и растворах 1% и 2% для инъекций)
- •Тема: анализ лекарственных средств, производных пиперидина и пиперазииа Вопросы для самоконтроля
- •Рекомендуемая литература
- •Фентанил
- •Циннаризин
- •Циклодол
- •Циннаризин в таблетках по 0,025 г
- •Тема: анализ лекарственных средств, производных тропана Вопросы для самоконтроля
- •Рекомендуемая литература
- •Атропина сульфат
- •Тропацин
- •Гоматропина гидробромид, скополамина гидробромид
- •Тема: анализ лекарственных средств, производных пиридина Вопросы для самоконтроля
- •Рекомендуемая литература
- •Пиридоксина гидрохлорид
- •Пиридоксальфосфат
- •Пармидин
- •Тема: анализ лекарственных средств, производных дигидропиридина и пиридин-з-карбоновой кислоты Вопросы для самоконтроля
- •Рекомендуемая литература
- •Никотиновая кислота
- •Никотинамид
- •Диэтиламид никотиновой кислоты
- •Пикамилон
- •Тема: анализ лекарственных средств, производных пиридин-4-карбоновой кислоты Вопросы для самоконтроля
- •Рекомендуемая литература
- •Изониазид
- •Фтивазид
- •Ниаламид
- •Рекомендуемая литература
- •Хингамин
- •Тема: анализ лекарственных средств, производных хинолина, фторхинолона и хиназолина Вопросы для самоконтроля
- •Рекомендуемая литература
- •Нитроксолин
- •Ломефлоксацина гидрохлорид
- •Гранулы хлорхинальдола (0,06 г в 1г) .
- •Тема: анализ лекарственных средств, производных изохинолина Вопросы для самоконтроля
- •Рекомендуемая литература
- •Папаверина гидрохлорид
- •Тема: анализ лекарственных средств, производных пиримидина Вопросы для самоконтроля
- •Рекомендуемая литература
- •Метилурацил
- •Гексамидин
- •Фторафур
- •Зидовудин
- •Тема: анализ лекарственных средств, производных пиримидина, гидантоина и 1,2-бензотиазина Вопросы для самоконтроля
- •Рекомендуемая литература
- •Общегрупповые реакции
- •Барбитал
- •Фенобарбитал
- •Тиопентал-натрий
- •Дифенин
- •Пироксикам
- •Барбитал, фенобарбитал и бензонал
- •Гексенал
- •Тема: анализ лекарственных средств, производных пиримидино-тиазола Вопросы для самоконтроля
- •Рекомендуемая литература
- •Тиамина бромид или тиамина хлорид
- •Фосфотиамин
- •Тема: анализ лекарственных средств производных ксантина Вопросы для самоконтроля
- •Рекомендуемая литература
- •Теобромин
- •Теофиллин
- •Эуфиллин
- •Темисал
- •Пентоксифиллин
- •Тема: анализ лекарственных средств, производных пурина Вопросы для самоконтроля
- •Рекомендуемая литература
- •Аллопуринол
- •Меркаптопурин
- •Азатиоприн
- •Рибоксин
- •Анализ ацикловира в таблетках 0,2 или 0,4
- •Тема: анализ лекарственных средств, производных птеридина Вопросы для самоконтроля
- •Рекомендуемая литература
- •Фолиевая кислота
- •Рибофлавин
- •Рибофлавина мононуклеотид
- •Рекомендуемая литература
- •Аминазин
- •Тема: анализ лекарственных средств, производных бензодиазепина Вопросы для самоконтроля
- •Рекомендуемая литература
- •Количественное определение оксазепама в таблетках
- •Анализ раствора сибазона (диазепам) 2% для инъекций
- •Анализ нитразепама в таблетках
- •Мезапам
- •Алпразолам
- •Тема: анализ лекарственных средств, производных 1,5-дибензодиазепина, бензотиазепина, иминостильбена, 10,11-дигидродибензоциклогептена Вопросы для самоконтроля
- •Рекомендуемая литература
- •Таблетки азалептина 0,025 и 0,1
- •Амитриптилина гидрохлорид
- •Карбамазепин
- •Тема: титрованные растворы. Установка титра и поправочного коэффициента.
- •Вопросы для самоконтроля
- •Рекомендуемая литература
- •Тема: использование метода неводного титрования в анализе лекарственных средств
- •Вопросы для самоконтроля
- •Рекомендуемая литература
- •Тема: анализ сложных лекарственных форм с использованием рефрактометрии
- •Вопросы для самоконтроля
- •Рекомендуемая литература
- •Методики анализа лекарственных форм с использованием рефрактометрии
- •Количественное определение
- •Тема: применение рефрактометрии для определения концентрации спирта в спиртовых лекарственных формах
- •Вопросы для самоконтроля
- •Рекомендуемая литература
- •Методики анализа водно-спиртовых растворов
- •Раствор кислоты борной спиртовой 0,5;1,0;2,0 и 3,0% фс 42-1512-99
- •Литература:
- •Тема: анализ лекарственных форм с применением условного и среднего ориентировочного титров
- •Титр средний ориентировочный (суммарный)
- •Титр условный
- •Рекомендации, которые следует соблюдать при аналитических расчетах:
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
БЕЛГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Фармацевтический факультет
Кафедра фармацевтической химии и фармакогнозии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ И ВЫПОЛНЕНИЯ ЛАБОРАТОРНО-ПРАКТИЧЕСКИХ РАБОТ ПО ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
Для студентов 3 - 5 курсов специальности «Фармация»
Белгород - 2009
TЕMA: ТЕХНИКА БЕЗОПАСНОСТИ РАБОТА С НОРМАТИВНОЙ ДОКУМЕНТАЦИЕЙ, УЧЕБНИКАМИ, ПРАКТИКУМАМИ, УЧЕБНЫМИ ПОСОБИЯМИ КАФЕДРЫ, СПРАВОЧНИКАМИ. ПОРЯДОК ОФОРМЛЕНИЯ РАБОТ. ОБЩИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ НЕОРГАНИЧЕСКОГО ПРОИСХОЖДЕНИЯ: ИСПЫТАНИЕ НА ПОДЛИННОСТЬ.
Вопросы для самоконтроля
1. Основные правила техники безопасности при работе в химической лаборатории.
2. Основные приемы оказания первой медицинской помощи при химических, термических ожогах, поражениях электротоком, порезах, ингаляционных воздействиях токсикантов.
3. Фармацевтическая химия как наука, фармацевтическая терминология: лекарственное средство, лекарственная форма, лекарственный препарат.
4. Структура Государственной фармакопеи X и XI изданий, их значение для оценки качества лекарственных средств.
5. Нормативная документация (НД), фармакопейные статьи предприятий (ФСП), регламентирующие качество лекарственных средств.
6. Опишите пробы и реакции идентификации катионов калия, натрия, аммония, магния, кальция, железа, цинка, свинца, висмута, ртути, серебра, меди (реактивы, условия, эффекты реакций). Напишите соответствующие уравнения химических реакций.
7. Опишите реакции идентификации анионов: хлоридов, бромидов, иодидов, сульфатов, фосфатов, нитритов, нитратов, боратов, карбонатов и гидрокарбонатов (реактивы, условия, эффекты реакций). Напишите соответствующие уравнения химических реакций.
Рекомендуемая литература
1. Государственная фармакопея СССР, X изд.М.Медицина, 1968. - 1079с.
2. Государственная фармакопея XI изд. Вып. 1. - M.:Медицина. 1987. - 336с.
3. Беликов В.Г. Фармацевтическая химия. Т. 1. Общая фармацевтическая химия. М.: Высшая школа. 1993. - С.5-6, 36-40, 129-135, 170-177.
4. Руководство к лабораторным занятиям по фармацевтической химии (под ред. П.Л. Сенова). - М.: Медицина. 1973. - С. 90-106, 351-352.
5. Лабораторные работы по фармацевтической химии / Под ред. В.Г. Беликова. М.: Высшая школа. 1989 - С. 5-13.
6. Конспект лекции.
БЛОК ИНФОРМАЦИИ
Среди лекарственных веществ встречаются соединения, водные растворы которых являются электролитами (кислоты, основания, соли). Основными свойствами электролитов (в отличие от неэлектролитов) является их способность вступать в реакции двойного обмена с другими электролитами. Такие реакции протекают быстро, и части молекул, которыми обмениваются при этих реакциях электролиты, реагируют независимо одна от другой. В реакцию как бы вступают части молекул, которые образуют продукт реакции с определённой частью молекулы реагента. Например, при прибавлении к раствору бариевой соли (хлорида, нитрата, ацетата) раствора любой сернокислой соли образуется один и тот же продукт – сульфат бария:
Ba(NO3)2 + Na2SO4 BaSO4 + 2NaNO3
BaCl2 + Na2SO4 BaSO4 + 2NaCl
Ba(CH3COO)2 + Na2SO4 BaSO4 + 2CH3COONa
Эти реакции объясняются тем, что молекулы химических соединений, растворы которых способны проводить электрический ток, во время растворения вещества распадаются на ионы (электролитическая диссоциация).
Большая часть кислот, оснований и солей являются ионогенными, и реакции электролитов представляют реакции ионогенного типа.
Анализ минеральных веществ основывается на реакциях отдельных ионов. В результате этих реакций возможны следующие случаи:
Образование недиссоциированного соединения в виде осадка:
Са2+ + С2О4 СаС2О4
Образование малодиссоциированного соединения с появлением характерного окрашивания:
Fe3+ + 3(SCN)- Fe(SCN)3
Выделение недиссоциированного газообразного вещества, распознаваемого по характерным признакам (цвет, запах):
SO32- + 2H+ H2O + SO2
Образование малодиссоциированного комплексного соединения:
Ag+ + 2(CN)- [Ag(CN)2]-
Качественные реакции обнаружения катионов.
КАЛИЙ
1. Окрашивание пламени. Соли щелочных и щелочноземельных металлов окрашивают пламя горелки. Это объясняется их восстановлением в пламени горелки до нейтральных атомов, малым потенциалом ионизации s1 – электрона и его способностью легко возбуждаться и переходить на возбуждённые уровни. При обратном переходе электрон испускает квант света.
При внесении солей, содержащих ионы калия в приветное пламя горелки, происходит окрашивание пламени в фиолетовый цвет.
2. К 2 мл раствора KCl прибавляют 1 мл раствора винной кислоты и 1 мл раствора натрия ацетата. При охлаждении и потирании стеклянной палочкой о стенки пробирки выпадает белый кристаллический осадок.
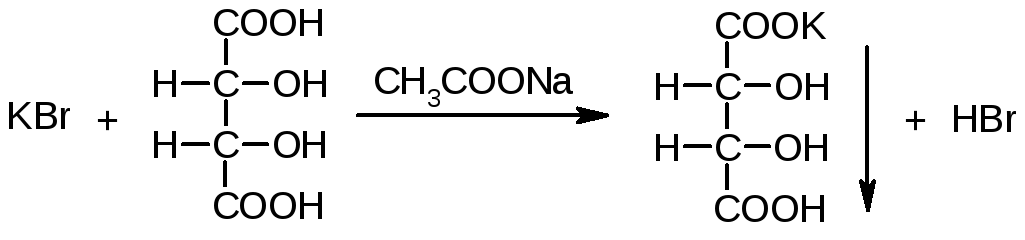
Осадок растворим в кислотах (образование винной кислоты) и в щелочах (образование средних солей). Образование осадка может быть ускорено добавлением спирта или уксусной кислоты.
НАТРИЙ
Окрашивание пламени. Бесцветное пламя горелки окрашивается солями натрия в желтый цвет.
АММОНИЙ
1. Разложение при нагревании. К 3 каплям раствора аммония хлорида прибавляют 4 капли раствора натрия гидроксида и осторожно нагревают. Выделяется аммиак, обнаруживаемый по запаху или по посинению красной лакмусовой бумажки.
NH4+ + NaOH NH3+ Na+ + H2O
2. К 3 каплям раствора хлорида аммония прибавляют 2 - 3 капли реактива Несслера - появляется осадок красно-бурого цвета или желто-бурое окрашивание.
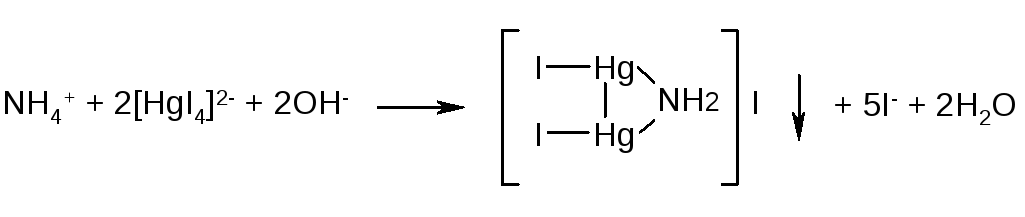
МАГНИЙ
1. К 1 мл раствора соли магния прибавляют 1 мл раствора аммиака и хлорида аммония и по каплям раствор натрия гидрофосфата. Выпадает белый кристаллический осадок.
Mg2+ + PO43– + NH4+ NH4MgPO4
белый
Реакцию проводят в присутствии аммония хлорида во избежание выпадения в щелочной среде осадка Mg(OH)2. Присутствие NH4Cl препятствует выпадению такого осадка вследствие связывания OH- - иона аммоний-ионами. При большом избытке NH4Cl осаждение магний-аммоний фосфата не наступает, потому что образуются комплексные ионы трихлормагния и тетрахлормагния.
2. К 1 мл раствора соли магния прибавляют по каплям раствор 8-оксихинолина - появляется зеленовато-желтый осадок оксихинолята магния.
КАЛЬЦИЙ
1. К раствору препарата прибавляют 1 мл раствора аммония оксалата. Образуется белый осадок.

Осадок нерастворим в уксусной кислоте (отличие от оксалатов бария и стронция) и растворе аммиака, растворим в растворах сильных кислот (образование щавелевой кислоты). Реакцию лучше проводить в слабокислой среде (рН = 6,0 – 6,5).
ЦИНК
1. К 2 мл раствора соли цинка прибавляют 0,5 мл раствора натрия сульфида образуется осадок белого цвета, нерастворимый в уксусной кислоте и растворимый в разведённой хлороводородной кислоте:
Zn2+ + S2– ZnS
белый
ZnS + 2HCl ZnCl2 + Н2S
2. К 2 мл раствора соли цинка прибавляют 0,5 мл кислого раствора калия ферроцианида - образуется белый студенистый осадок, нерастворимый в разведённой соляной кислоте:
Zn2+ + K4[Fe(CN)6] K2Zn[Fe(CN)6] + 2K+
белый
СВИНЕЦ
1. К 1 мл раствора соли свинца прибавляют -4-5 капель раствора калия иодида, выпадает желтый осадок, растворимый в избытке реактива с образованием бесцветного комплекса. PbI2 растворим в горячей воде и в уксусной кислоте. При охлаждении раствора выпадает осадок в виде золотых чешуек.
2. К 3 каплям раствора соли свинца прибавляют несколько капель раствора натрия сульфида, образуется черный осадок.
СЕРЕБРО
1. К раствору серебра нитрата прибавляют раствор аммиака (до растворения образующегося осадка), 2 - 3 капли формалина и нагревают. На стенках пробирки образуется налет металлического серебра (реакция «серебряного зеркала»).
2. Ионы серебра образуют осадки с хлоридами, бромидами, иодидами. Образующиеся галогениды различают по растворимости в растворе аммиака. К 1 мл раствора соли серебра прибавляют 2 - 3 капли раствора натрия хлорида или разведенной кислоты хлороводородной - образуется белый творожистый осадок, растворимый в растворе аммиака, с образованием бесцветного комплексного соединения хлорида диамминсеребра:
AgCl + 2NH3 [Ag(NH3)2]Cl
Хлорид диамминсеребра взаимодействует с азотной кислотой выделяя осадок AgCl.
Осадок бромида серебра светло-жёлтого цвета малорастворим в аммиаке:
Ag+ + Br– AgBr
светло-желтый
Жёлтый осадок йодида серебра нерастворим в растворе аммиака:
Ag+ + I– AgI
желтый
МЕДЬ.
1. Раствор аммиака сначала осаждает из растворов солей меди (II) осадок основных солей меди голубовато-зелёного цвета, который растворим в избытке реактива с образованием тетраамминмедь (II) – иона синего цвета.
К 1 мл раствора сульфата меди прибавляют по каплям раствор аммиака - выпадает синий осадок, который растворяется в избытке реактива с образованием раствора темно-синего цвета.
2CuSO4 + 2NH3 + 2H2O Cu(OH)2SO4 + (NH4)2SO4
Cu(OH)2SO4 + (NH4)2SO4 + 6NH3 2[Cu(NH3)4]2+ + 2SO42- + 2H2O
2. К нескольким каплям раствора меди сульфата прибавляют раствор ферроцианида калия до образования красно-бурого осадка.
ЖЕЛЕЗО (II)
1. К 1 мл раствора железа (П) сульфата прибавляют 1 мл 2М кислоты хлороводородной и 1 мл раствора калия феррицианида; выпадает осадок синего цвета.
Fe2+ + K3[Fe(CN)6] KFe[Fe(CN)6] + 2K+
синий
Соединение КFe3+[Fe2+(CN)6] носит тривиальное название турнбулевой сини и по данным рентгеноструктурных исследований идентично берлинской лазури КFe3+[Fe2+(CN)6]. Реакция проводится в кислой среде.
ЖЕЛЕЗО (III)
1. К 1 мл раствора хлорида железа (III) прибавляют 2-3 капли 2М кислоты хлороводородной и 2-3 капли раствора калия ферроцианида - образуется темно-синий осадок.
Fe3+ + K4[Fe(CN)6] KFe[Fe(CN)6] + 3K+
синий
2. К 1 мл раствора анализируемого вещества прибавляют 1 мл разведенной кислоты хлороводородной и 4-5 капель раствора аммония тиоцианата - появляется винно-красное окрашивание.
Fe3+ + 3SCN– Fe(SCN)3
КАЧЕСТВЕННЫЕ РЕАКЦИИ ОБНАРУЖЕНИЯ АНИОНОВ.
ХЛОРИДЫ, БРОМИДЫ, ИОДИДЫ.
1. К 2 мл раствора испытуемого вещества прибавляют 0,5 мл разведенной кислоты азотной и 0,5 мл раствора серебра нитрата выпадают творожистые осадки белого (AgCl), слегка желтоватого (AgBr), и жёлтого (Agl) цветов. Все осадки нерастворимы в разведенной азотной кислоте и имеют различную растворимость в растворе аммиака (проверить растворимость!).
2. Окисление до элементарного галогена (для бромидов и йодидов). Бромиды идентифицируют по реакции выделения брома в результате окислительно-восстановительной реакции между бромидом и хлорамином в кислой среде. Выделяющийся в результате реакции молекулярный бром извлекают хлороформом. Хлороформный слой окрашивается при этом в желто-бурый цвет.
Йодиды являются выраженными восстановителями. Поэтому слабые окислители выделяют молекулярный йод из йодидов. Йод окрашивает крахмал в синий цвет; раствор йода в хлороформе окрашен в фиолетовый цвет. Сильные окислители переводят йодиды в бесцветные гипойодиты (IO−) или йодаты (IO3−), поэтому выбор окислителя и его концентрация имеет большое значение. ГФ рекомендует использовать для окисления йодидов растворы железа (III) хлорида или натрия нитрита.
В качестве окислителя ГФ предлагает также применять кислоту серную концентрированную, при действии которой на йодиды при нагревании выделяются фиолетовые пары йода.
К 1 мл раствора испытуемого вещества прибавляют 1 мл разведенной кислоты хлороводородной, 0,5 мл раствора хлорамина Б и 1 мл хлороформа. Взбалтывают. Выделившийся бром окрашивает хлороформ в желто-бурый, а иод - в фиолетовый цвет.

2KBr + Cl2 Br2 + 2KCl
СУЛЬФАТЫ
1. К 1 мл раствора анализируемого вещества прибавляют 0,5 мл раствора бария хлорида: появляется белый кристаллический осадок, нерастворимый в растворах минеральных кислот.
ФОСФАТЫ
1. К 1 мл раствора анализируемого вещества прибавляют несколько капель раствора серебра нитрата - образуется желтый осадок, растворимый в разведенной азотной кислоте и растворе аммиака.
3Ag+ + PO43– Ag3PO4
2. К 1 мл раствора соли фосфата прибавляют 1 мл раствора аммония хлорида. 1 ил раствора аммиака, 0,5 мл раствора магния сульфата - образуется белый кристаллический осадок.
БОРАТЫ
Несколько кристалликов борной кислоты смешивают с 1-2 мл этанола, прибавляют 1 каплю концентрированной серной кислоты и поджигают - пламя имеет окрашенные в зеленый цвет края.
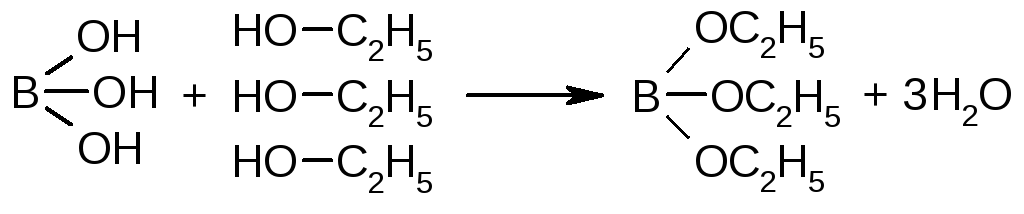
КАРБОНАТЫ И ГИДРОКАРБОНАТЫ
1. К 0.2 г препарата прибавляют 0,5 мл разведенной минеральной кислоты (хлороводородной или серной) - выделяются пузырьки углекислого газа.
CO32– + 2HCl CO2 + H2O + 2Cl–
HCO3– + HCl CO2 + H2O + Cl–
2. К 2 мл раствора анализируемого вещества прибавляют 5 капель насыщенного раствора сульфата магния: карбонаты образуют белый осадок при комнатной температуре, гидрокарбонаты - при кипячении.
ОБРАЗЕЦ ОФОРМЛЕНИЯ ПРОТОКОЛА ЗАНЯТИЯ ПО ОБЩИМ
МЕТОДАМ ОПРЕДЕЛЕНИЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ
СРЕДСТВ НЕОРГАНИЧЕСКОГО ПРОИСХОЖДЕНИЯ. РЕАКЦИИ
НА ПОДЛИННОСТЬ.
ДАТА................................................................................................................
ТЕМА ЗАНЯТИЯ............................................................................................
|
N пп/п
|
Катион/ анион
|
Испытуемое лекарственноесредство |
Краткая методика идентификации |
Уравнение химической реакции |
Наблюдаемый эффект |
|
|
|
|
|
|
|
ТЕМА 2. ОБЩИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ. ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ, ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ И КИПЕНИЯ, КИСЛОТНОСТИ, ЛЕТУЧИХ ВЕЩЕСТВ, ВОДЫ, ЗОЛЫ. ИСПОЛЬЗОВАНИЕ ФИЗИКО-ХИМИЧЕСКИХ КОНСТАНТ В ОЦЕНКЕ ДОБРОКАЧЕСТВЕННОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ.
Вопросы для самоконтроля
1. Назовите источники и причины недоброкачественности лекарственных средств.
2. Приведите основные типы реакций, приводящих к изменению лекарственных веществ под воздействием факторов окружающей среды.
3. Опишите природу и характер примесей. Специфические и неспецифические (общие) примеси. Допустимые и недопустимые примеси.
4. Дайте определение показателей «описание» и «растворимость» согласно ГФ XI, их значение для оценки качества лекарственных средств. Условные термины растворимости.
5. Дайте определение понятиям: температура плавления и затвердевания, температура кипения. Опишите способы их определения.
6. Опишите определение кислотности, летучих веществ, золы и воды в лекарственных средствах. Напишите уравнение химической реакции титрования воды по методу К.Фишера.
7. Опишите возможность использования физико-химических констант в оценке доброкачественности лекарственных средств. Дайте определения понятиям: Rf, Rs, удельный и молярный показатели поглощения, показатель преломления, удельное вращение. Напишите формулы для их расчета.
